化学能转换为电能
图片预览






文档简介
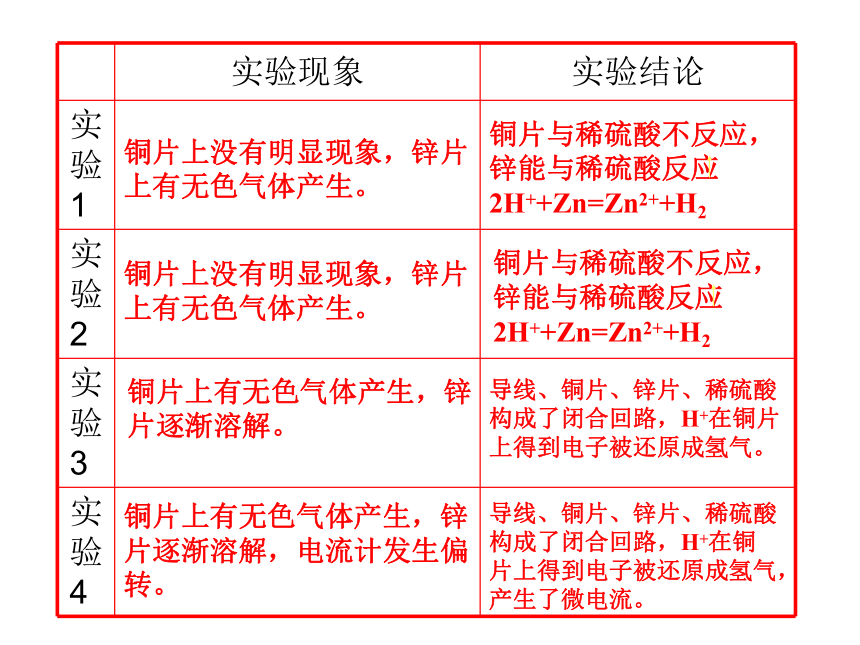
课件25张PPT。化学能转化为电能化学反应中能量变化的形式之一在容器中加入约2/3容积的稀硫酸,请按下列要求实验并记录实验现象:4.在锌片和铜片的导线中间连接一个灵敏电流计,插入盛有稀硫酸的烧杯中。 1.将一块铜片和一块锌片分别插入盛有稀硫酸的烧杯中。
2.将一块铜片和一块锌片同时插入盛有稀硫酸的烧杯中。(铜片和锌片不 要接触)
3.用导线把锌片和铜片连接起来,插入盛有稀硫酸的烧杯中。
铜片上没有明显现象,锌片上有无色气体产生。铜片上没有明显现象,锌片上有无色气体产生。铜片上有无色气体产生,锌片逐渐溶解。铜片上有无色气体产生,锌片逐渐溶解,电流计发生偏转。导线、铜片、锌片、稀硫酸构成了闭合回路,H+在铜片上得到电子被还原成氢气。导线、铜片、锌片、稀硫酸构成了闭合回路,H+在铜片上得到电子被还原成氢气,产生了微电流。思考实验4中灵敏电流计显示有电流通过,电流是如何产生的?
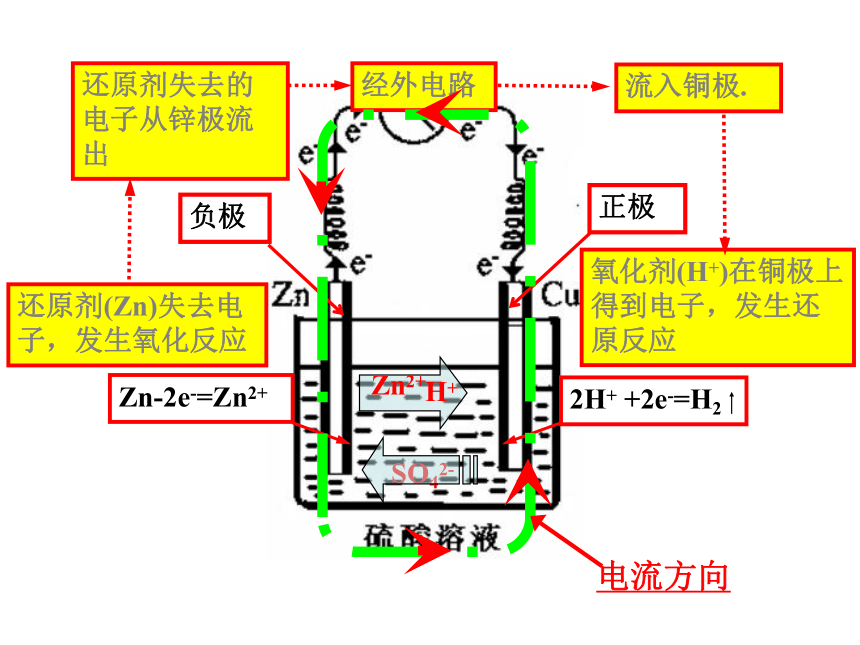
还原剂(Zn)失去电子,发生氧化反应氧化剂(H+)在铜极上得到电子,发生还原反应还原剂失去的电子从锌极流出流入铜极.经外电路H+SO42-电流方向Zn2+意大利物理学家
亚历山德罗.伏打
(Alessandro Volta)伏打电池
1、定义
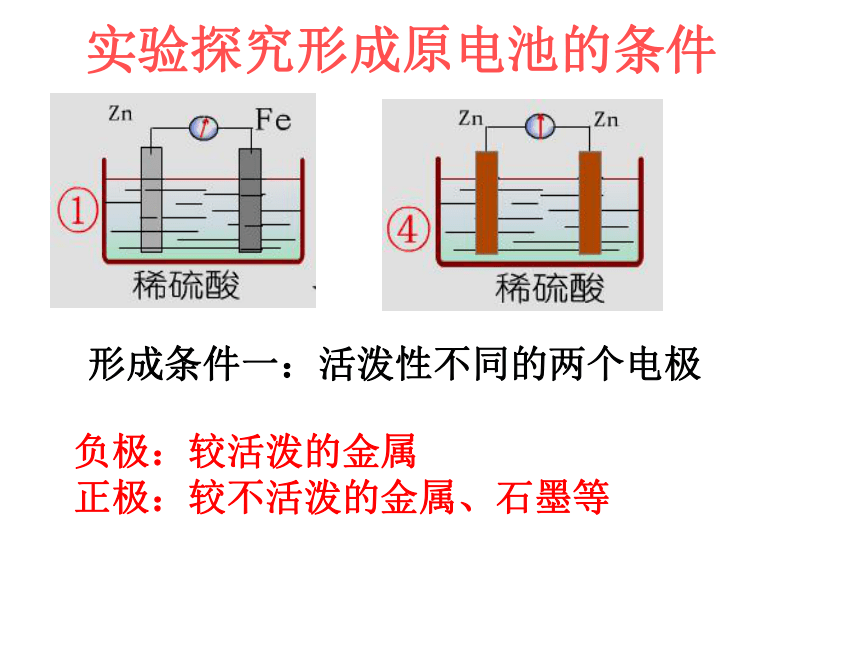
将化学能转化成电能的装置原电池的原理:氧化还原反应一、原电池实验探究形成原电池的条件形成条件一:活泼性不同的两个电极负极:较活泼的金属
正极:较不活泼的金属、石墨等形成条件二:电极需插进电解质溶液中实验探究形成原电池的条件形成条件三:必须形成闭合回路实验探究形成原电池的条件实验探究形成原电池的条件形成条件四:必须存在自发的氧化还原反应2.构成原电池的条件(1)有活泼性不同的两个电极(2)两电极都接触电解质溶液(3)正极、负极、电解质溶液构成闭合回路( 4 )在电极表面上能发生自发进行的氧化还原反应。较活泼的金属较不活泼的金属(或石墨)氧化反应还原反应电子流出电子流入3、正负极和电子流向的判断4、简单原电池的工作原理负极 (锌) 电子流向与电流方向总反应方程式:正极(铜) Zn - 2e-=Zn2+ (锌板溶解,发生氧化反应 )电极反应阳离子正极阴离子负极离子流向:由于金与铁(钢的主要成分)是活动性不同的两种金属,唾液中含有电解质,故构成了原电池,产生了微小的电流,使得格林太太头痛,因此必须换掉其中的一颗假牙。给你Al、Zn、Cu和一只苹果你能制成几种水果电池?动脑动手Al CuAl ZnZn Cu练1:判断下列装置,哪些能形成原电池( )(A)酒精 (B)H2SO4(C)ADEFH2SO4H2SO4(F)(E)(D)(D)(F)(E)2、A、B、C、D四种金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别放入等浓度盐酸中,D比A反应剧烈。将Cu浸入B的盐溶液中无明显变化,如果把Cu浸入C的盐溶液中,有金属C析出。其活动顺序为:( )
A、DCAB B、DABC
C、DBAC D、BADCB练习3判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO41.通常在轮船的尾部和在船壳的水线以下部分,装有一定数量的锌块,请解释原因。请利用:Cu+2AgNO3 = Cu(NO3)2+2Ag 的反应原理,设计一个能产生电流的原电池装置,并写出两个电极上的电极反应。再见
2.将一块铜片和一块锌片同时插入盛有稀硫酸的烧杯中。(铜片和锌片不 要接触)
3.用导线把锌片和铜片连接起来,插入盛有稀硫酸的烧杯中。
铜片上没有明显现象,锌片上有无色气体产生。铜片上没有明显现象,锌片上有无色气体产生。铜片上有无色气体产生,锌片逐渐溶解。铜片上有无色气体产生,锌片逐渐溶解,电流计发生偏转。导线、铜片、锌片、稀硫酸构成了闭合回路,H+在铜片上得到电子被还原成氢气。导线、铜片、锌片、稀硫酸构成了闭合回路,H+在铜片上得到电子被还原成氢气,产生了微电流。思考实验4中灵敏电流计显示有电流通过,电流是如何产生的?
还原剂(Zn)失去电子,发生氧化反应氧化剂(H+)在铜极上得到电子,发生还原反应还原剂失去的电子从锌极流出流入铜极.经外电路H+SO42-电流方向Zn2+意大利物理学家
亚历山德罗.伏打
(Alessandro Volta)伏打电池
1、定义
将化学能转化成电能的装置原电池的原理:氧化还原反应一、原电池实验探究形成原电池的条件形成条件一:活泼性不同的两个电极负极:较活泼的金属
正极:较不活泼的金属、石墨等形成条件二:电极需插进电解质溶液中实验探究形成原电池的条件形成条件三:必须形成闭合回路实验探究形成原电池的条件实验探究形成原电池的条件形成条件四:必须存在自发的氧化还原反应2.构成原电池的条件(1)有活泼性不同的两个电极(2)两电极都接触电解质溶液(3)正极、负极、电解质溶液构成闭合回路( 4 )在电极表面上能发生自发进行的氧化还原反应。较活泼的金属较不活泼的金属(或石墨)氧化反应还原反应电子流出电子流入3、正负极和电子流向的判断4、简单原电池的工作原理负极 (锌) 电子流向与电流方向总反应方程式:正极(铜) Zn - 2e-=Zn2+ (锌板溶解,发生氧化反应 )电极反应阳离子正极阴离子负极离子流向:由于金与铁(钢的主要成分)是活动性不同的两种金属,唾液中含有电解质,故构成了原电池,产生了微小的电流,使得格林太太头痛,因此必须换掉其中的一颗假牙。给你Al、Zn、Cu和一只苹果你能制成几种水果电池?动脑动手Al CuAl ZnZn Cu练1:判断下列装置,哪些能形成原电池( )(A)酒精 (B)H2SO4(C)ADEFH2SO4H2SO4(F)(E)(D)(D)(F)(E)2、A、B、C、D四种金属,将A和B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别放入等浓度盐酸中,D比A反应剧烈。将Cu浸入B的盐溶液中无明显变化,如果把Cu浸入C的盐溶液中,有金属C析出。其活动顺序为:( )
A、DCAB B、DABC
C、DBAC D、BADCB练习3判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO41.通常在轮船的尾部和在船壳的水线以下部分,装有一定数量的锌块,请解释原因。请利用:Cu+2AgNO3 = Cu(NO3)2+2Ag 的反应原理,设计一个能产生电流的原电池装置,并写出两个电极上的电极反应。再见
