从微观结构看物质的多样性
图片预览






文档简介
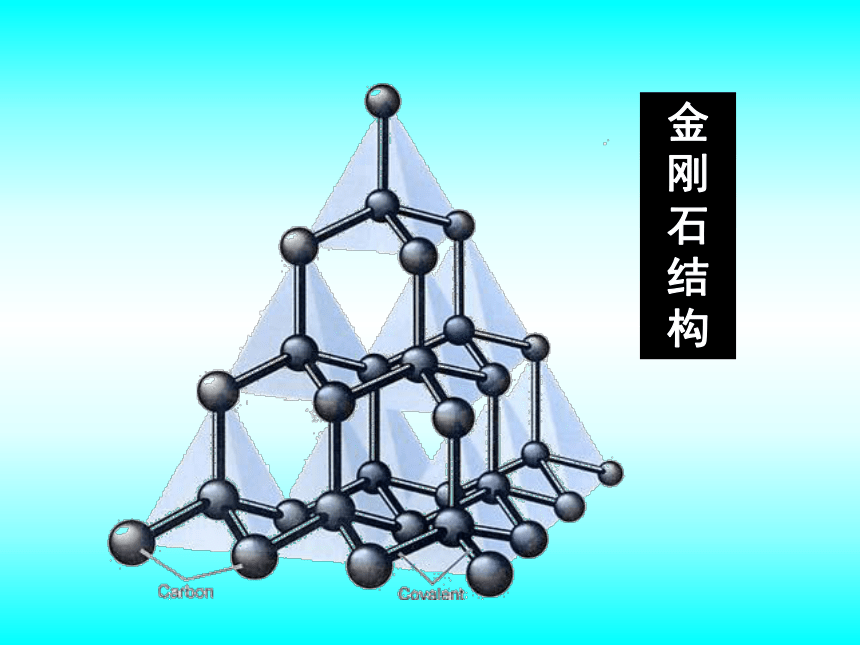
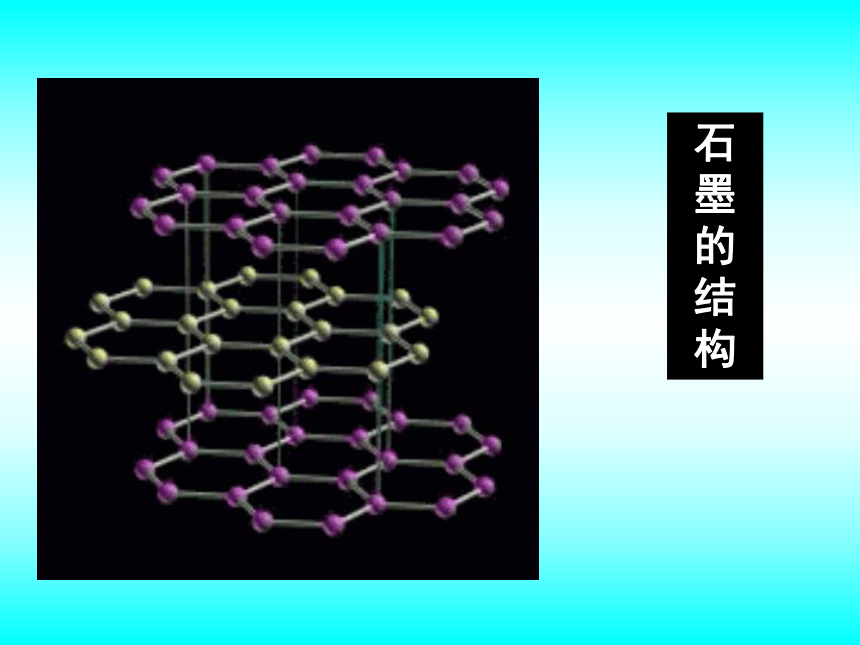
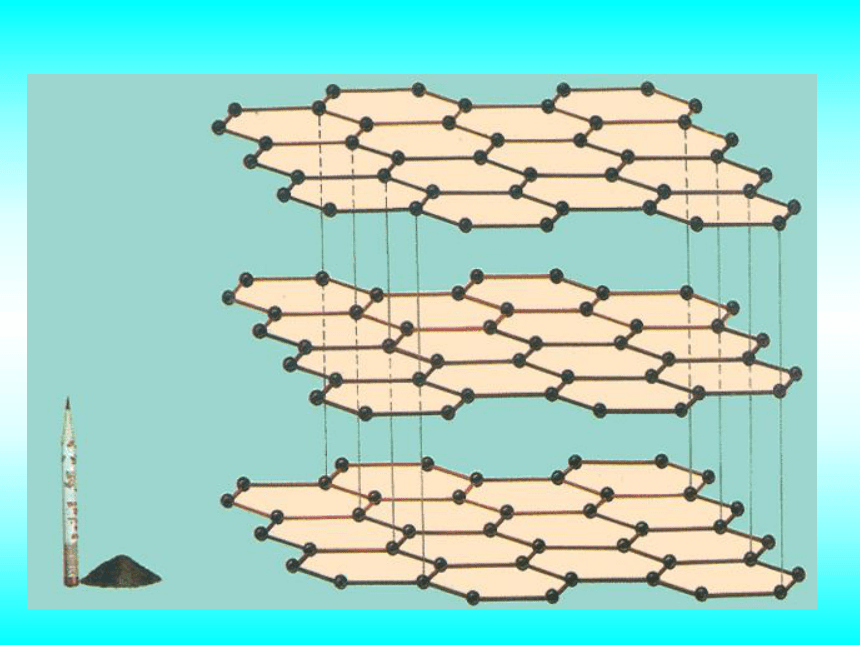
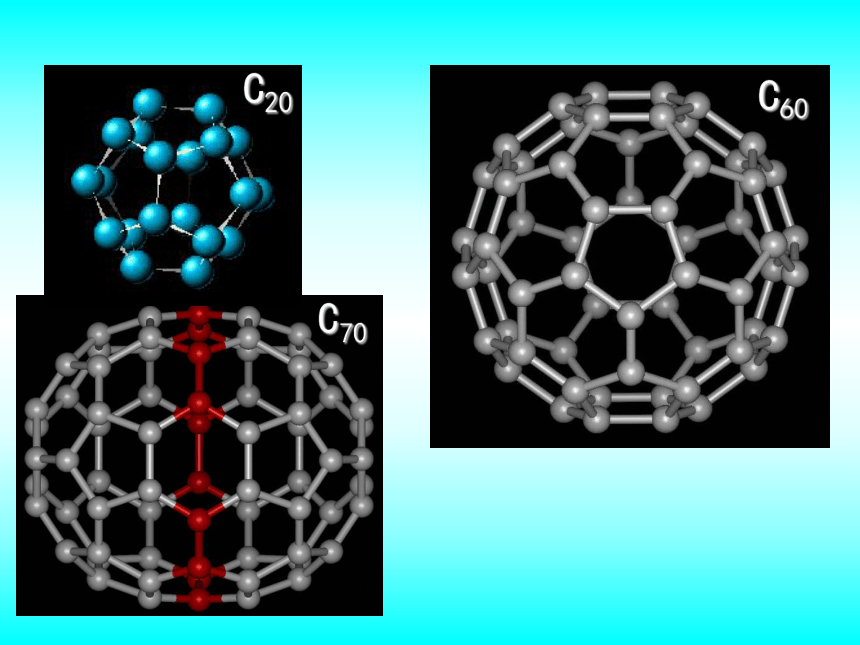
课件38张PPT。专题1 从微观看物质的多样性微观结构与物质的多样性第三单元同素异形现象金刚石石墨金刚石结构石墨的结构纳米碳管C20C60C70同素异形体是指同一种元素形成的不同单质。
同种元素形成的不同单质的现象叫做同素异形现象。
同素异形体的组成元素相同,但物质结构不同
※注意:
①互为同素异形体的物质一定是单质。
②“不同单质”中的“不同”包括单质结构不同(如金刚石和石墨)和分子内原子数目不同(如O2和03)同素异形体性质的比较
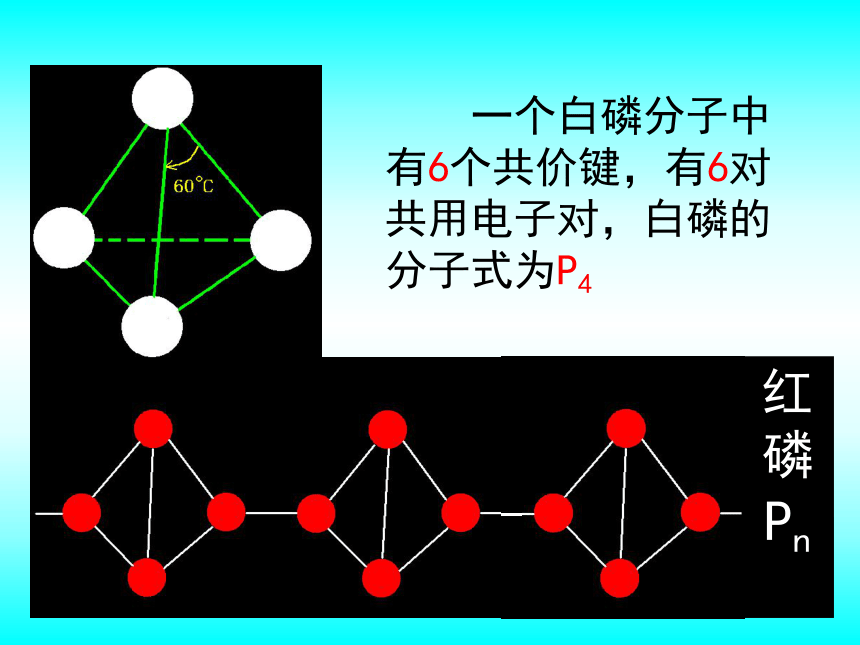
互为同素异形体的物质,物理性质不同,但化学性质相似,彼此在一定条件下可以相互转化。 臭氧在通常状况下是淡蓝色的气体,有鱼腥味,氧化性极强。白磷和红磷 一个白磷分子中有6个共价键,有6对共用电子对,白磷的分子式为P4红磷Pn
4P+5O2 2P2O5点燃分子式:均为C4H10
沸点:-0.5℃ -11.7℃同分异构现象 分子式相同而结构不同的化合物互称为同分异构体。 化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象。 同分异构现象的广泛存在,是有机化合物种类繁多的原因之一。不同类型的晶体
美丽的雪花
固体晶体非晶体单晶体多晶体定义:离子化合物中的阴、阳离子按一定的方式有规则地排列而形成的晶体叫做离子晶体实例:食盐、氯化铯物理性质:具有较高的熔沸点,在熔融状态
或水溶液中能导电,有些离子晶
体溶于水,有些难溶于水离子晶体形成离子晶体的物质: KOH 、CuSO4、NH4Cl、
CaO等离子化合物氯化钠晶体中离子的排列方式氯化钠晶体和氯化铯晶体中离子的排列方式定义:分子间通过分子间作用力相结合的晶
体,叫做分子晶体。实例:干冰、冰等共价化合物物理性质:熔、沸点低,硬度小,在水中的
溶解度存在很大的差异。分子晶体形成分子晶体的物质:H2、Cl2、He、HCl、
H2O、CO2等干冰及干冰中二氧化碳分子的排列方式【讨论与思考】 CO2和SiO2的一些物理性质如下表所示,通过比较判断SiO2晶体是否属于分子晶体。熔 点沸 点干 冰(CO2)-56.2℃-78.4℃SiO21723℃2230℃定义:这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体实例:二氧化硅晶体、金刚石物理性质:熔、熔沸点很高,硬度很大,难溶
于水,一般不导电。原子晶体形成原子晶体的物质:金刚石、金刚砂(SiC)
晶体硅、石英(SiO2)金刚石结构石英晶体中硅、氧原子排列方式不同类型的晶体 物 质 熔 沸 点 的 比 较
(1)不同类晶体:一般情况下,原子晶体>离子晶体
>分子晶体
(2)同种类型晶体:构成晶体质点间的作用大,则熔
沸点高,反之则小。
①离子晶体:离子所带的电荷数越高,离子半径
越小,则其熔沸点就越高。
②分子晶体:对于同类分子晶体,相对分子质量
越大,则熔沸点越高。
③原子晶体:一般原子半径越小,则熔沸点越高
(3)常温常压下状态
①熔点:固态物质>液态物质
②沸点:液态物质>气态物质信息提示【规律总结】
1、含离子键的化合物可形成离子晶体
2、只含共价键的单质、化合物多数形成分子晶体,少
数形成原子晶体如金刚石、晶体硅、SiO2等。
3、金属一般可形成金属晶体 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.CO2和H2
C.NaCl和HCl D.CCl4和KClB【例1】 下列关于化学键的下列叙述中,正确的是( ).
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中不含离子键AD【例2】【作业】常规训练再见
同种元素形成的不同单质的现象叫做同素异形现象。
同素异形体的组成元素相同,但物质结构不同
※注意:
①互为同素异形体的物质一定是单质。
②“不同单质”中的“不同”包括单质结构不同(如金刚石和石墨)和分子内原子数目不同(如O2和03)同素异形体性质的比较
互为同素异形体的物质,物理性质不同,但化学性质相似,彼此在一定条件下可以相互转化。 臭氧在通常状况下是淡蓝色的气体,有鱼腥味,氧化性极强。白磷和红磷 一个白磷分子中有6个共价键,有6对共用电子对,白磷的分子式为P4红磷Pn
4P+5O2 2P2O5点燃分子式:均为C4H10
沸点:-0.5℃ -11.7℃同分异构现象 分子式相同而结构不同的化合物互称为同分异构体。 化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象。 同分异构现象的广泛存在,是有机化合物种类繁多的原因之一。不同类型的晶体
美丽的雪花
固体晶体非晶体单晶体多晶体定义:离子化合物中的阴、阳离子按一定的方式有规则地排列而形成的晶体叫做离子晶体实例:食盐、氯化铯物理性质:具有较高的熔沸点,在熔融状态
或水溶液中能导电,有些离子晶
体溶于水,有些难溶于水离子晶体形成离子晶体的物质: KOH 、CuSO4、NH4Cl、
CaO等离子化合物氯化钠晶体中离子的排列方式氯化钠晶体和氯化铯晶体中离子的排列方式定义:分子间通过分子间作用力相结合的晶
体,叫做分子晶体。实例:干冰、冰等共价化合物物理性质:熔、沸点低,硬度小,在水中的
溶解度存在很大的差异。分子晶体形成分子晶体的物质:H2、Cl2、He、HCl、
H2O、CO2等干冰及干冰中二氧化碳分子的排列方式【讨论与思考】 CO2和SiO2的一些物理性质如下表所示,通过比较判断SiO2晶体是否属于分子晶体。熔 点沸 点干 冰(CO2)-56.2℃-78.4℃SiO21723℃2230℃定义:这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体实例:二氧化硅晶体、金刚石物理性质:熔、熔沸点很高,硬度很大,难溶
于水,一般不导电。原子晶体形成原子晶体的物质:金刚石、金刚砂(SiC)
晶体硅、石英(SiO2)金刚石结构石英晶体中硅、氧原子排列方式不同类型的晶体 物 质 熔 沸 点 的 比 较
(1)不同类晶体:一般情况下,原子晶体>离子晶体
>分子晶体
(2)同种类型晶体:构成晶体质点间的作用大,则熔
沸点高,反之则小。
①离子晶体:离子所带的电荷数越高,离子半径
越小,则其熔沸点就越高。
②分子晶体:对于同类分子晶体,相对分子质量
越大,则熔沸点越高。
③原子晶体:一般原子半径越小,则熔沸点越高
(3)常温常压下状态
①熔点:固态物质>液态物质
②沸点:液态物质>气态物质信息提示【规律总结】
1、含离子键的化合物可形成离子晶体
2、只含共价键的单质、化合物多数形成分子晶体,少
数形成原子晶体如金刚石、晶体硅、SiO2等。
3、金属一般可形成金属晶体 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.SO2和SiO2 B.CO2和H2
C.NaCl和HCl D.CCl4和KClB【例1】 下列关于化学键的下列叙述中,正确的是( ).
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中不含离子键AD【例2】【作业】常规训练再见
