元素第一电离能
图片预览






文档简介
课件23张PPT。专题二原子结构与元素性质
第二单元 元素性质的递变规律
(第二课时)元素主要性质有哪些?它们各有怎样的递变规律?1.金属性:同一周期从左到右金属性逐渐减弱;
同一主族从上到下金属性逐渐增强。2.非金属性:同一周期从左到右非金属性逐渐增强;
同一主族从上到下非金属性逐渐减弱。3.元素主要化合价:正价:从+1变到+7,负价:从-4变到-14.原子半径:同一周期从左到右原子半径逐渐减小;
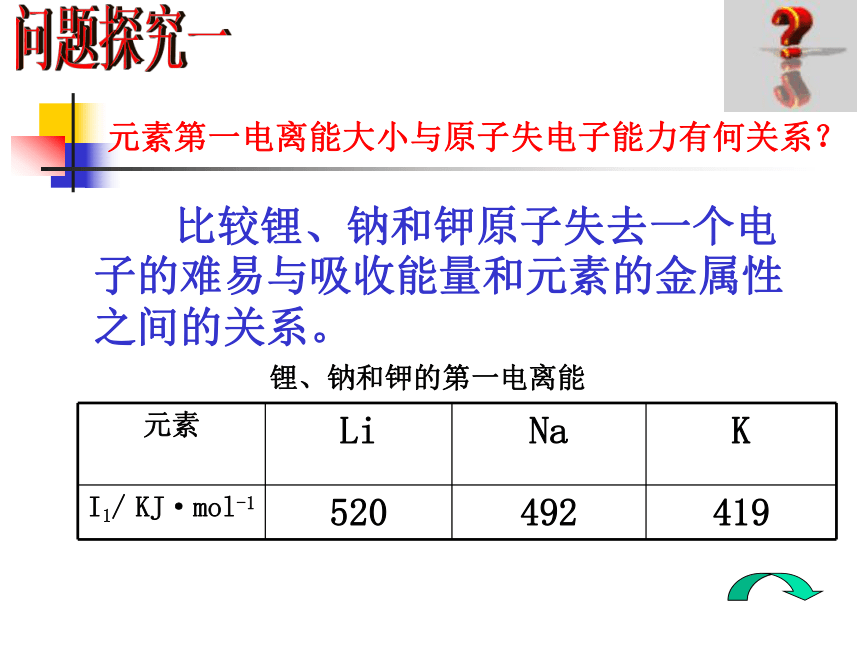
同一主族从上到下原子半径逐渐增大。5.元素第一电离能的周期性变化你知道吗?知识回顾 元素第一电离能是指气态原子失去一个电子形成+1价气态阳离子所需的最低能量。1.元素第一电离能定义:概念应用元素第一电离能大小与原子失电子能力有何关系?问题探究一锂、钠和钾的第一电离能 比较锂、钠和钾原子失去一个电子的难易与吸收能量和元素的金属性之间的关系。2.元素第一电离能意义: 表示元素的原子在气态时失去一个电子的难易程度。元素的第一电离能越小表示它越容易失去电子,即该元素的金属性越强。元素第一电离能的周期性变化第一电离能越小,原子越易失去第一个电子;
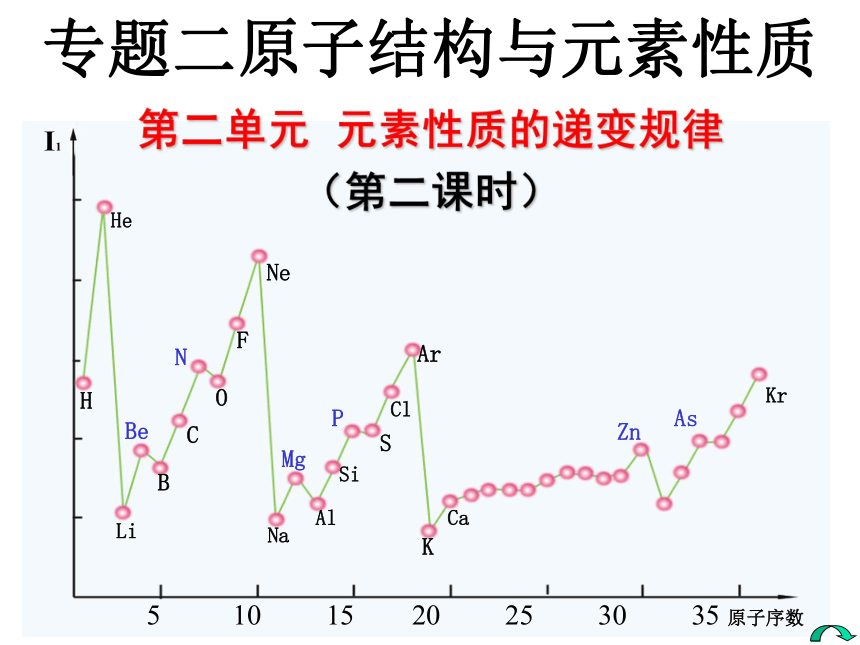
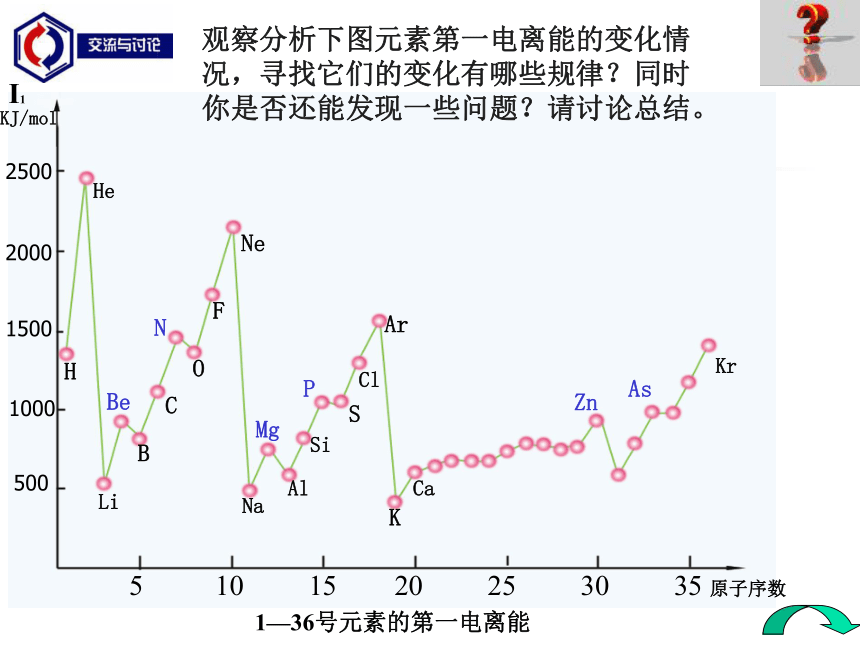
第一电离能越大,原子越难失去第一个电子。问题探究二 元素的第一电离能有什么变化规律呢?观察分析下图元素第一电离能的变化情况,寻找它们的变化有哪些规律?同时你是否还能发现一些问题?请讨论总结。NPBeMgZnAs 5 10 15 20 25 30 35 原子序数I1 1—36号元素的第一电离能LiBHHeCOFNeNaAlSiSClArKCaKrKJ/mol5001000150020002500 (1).总体上:金属元素的第一电离能都 较小 ,非金属元素和稀有气体元素的第一电离能都 较大 。(2).同一周期元素的第一电离能从左到右呈增大趋势。(3).同一主族元素的第一电离能从上到下逐渐减小。(4).在同一周期中第一电离能最小的是碱金属元素,最大的是
稀有气体元素。(5).在第二周期中Be和N元素及第三周期中Mg和P的第一电离能大于相邻的元素的第一电离能。总结一下为什么?为什么 ?为什么 ?为什么?为什么?3.元素第一电离能的变化规律规律与总结(1). 金属元素的第一电离能都较小 ,非金属元素
和稀有气体元素的第一电离能都较大 ;为什么? 因为金属元素原子的最外层电子数都比较少,容易失去电子,所以金属元素的第一电离能都比较小;而非金属元素原子的最外层电子比较多,不容易失去电子,稀有气体元素原子外围电子排布式为nS2nP6(He为1S2),是稳定结构,更难失去电子,因此它们的第一电离能都比较大。(从比较金属元素、非金属元素及稀有气体元素的最外层电子数多少入手。)3.元素第一电离能的变化规律(2).同一周期元素的第一电离能 从左到右元素的第一电离能总体上是呈增大趋势。 为什么? (从原子结构的变化来解释。)
因为同一周期从左到右随着核电荷数的增加,元素原子半径减少,核对外层电子引力逐渐增大,失电子所需的能量呈增加趋势,即元素的第一电离能呈增大趋势。3.元素第一电离能的变化规律(3).同一主族元素的第一电离能从上到下,元素第一电离能逐渐减小。 为什么? (从同主族的原子结构变化来回答。)
因为同一主族从上到下,随着核电荷数的增加,电子层数增加,原子半径增大,核对外层电子的引力减小,失电子所需的能量减小,元素第一电离能逐渐减小。3.元素第一电离能的变化规律(4).在同一周期中第一电离能最小的是碱金属元素,最大的是稀有气体元素。为什么? 因为碱金属元素原子的外围电子排布式为nS1,在同周期中(除稀有气体)原子半径最大,核对外层电子引力最小,最容易失去最外层的一个电子,所以碱金属元素的第一电离能在同一周期中最小。而稀有气体元素原子的外围电子排布式为nS2nP6(He为1S2),是稳定结构,在同一周期中最难失去电子,所以在同一周期中稀有气体的第一电离能最大。(从它们的原子的外围电子排布式和原子结构的特点来思考。)3.元素第一电离能的变化规律(5).在第二周期中Be和N元素及第三周期中Mg和P的第一电离能大于它们相邻的元素的第一电离能。为什么? 提示:请同学们先写出Be、B、N、O、Mg、Al、P、S的电子排布式,并作比较。 Be:1S2 2S22P0 (B:1S2 2S22P1)
N:1S2 2S22P3 (O:1S2 2S22P4)
Mg:1S2 2S22P6 3S23P0 (Al:1S2 2S22P6 3S23P1)
P:1S2 2S22P6 3S23P3 (S:1S2 2S22P6 3S23P4)3.元素第一电离能的变化规律当原子核外电子排布在能量相等的轨道上形成全空(P0、d0、f0)或半充满(p3、d5、f7)或全充满(p6、d10、f14)结构时原子处于能量较低状态(即洪特规则特例),所以失电子所需能量较大,即I1较大。而Be、N、Mg、P元素的原子结构恰好满足这一点,所以导致它们的第一电离能大于它们相邻元素。3.元素第一电离能的变化规律同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势;
同一主族,随着电子层数的增加,元素的第一电离能逐渐减小。 即元素第一电离能随着元素核电荷数的递增呈现周期性变化。元素第一电离能的周期性变化元素第一电离能的周期性变化是原子核外电子排布周期性变化的必然结果。4.影响元素的第一电离能大小的因素元素第一电离能的周期性变化(1)原子核对核外电子的引力
(2)原子达到稳定结构的趋势
根据第一电离能的定义, 你能说出什么是元素的第二电离能、元素的第三电离能......吗?讨论后回答。拓展视野 元素的第二、三电离能 气态电中性基态原子失去一个电子形成+1价气态阳离子所需最低能量叫第一电离能,用I1 表示;从+1价气态离子中再失去一个电子,形成+2价气态离子所需要的最低能量叫第二电离能,用I2 表示;依次类推,可得到I3、I4、I5……为什么?同一种元素的逐级电离能大小关系:
I1 从表中数据可知:Na元素的I2远大于I1,因此Na容易失去第一个电子,而不易失去第二个电子;即Na易形成Na+,而不易形成Na2+ 。镁元素的I1、I2相差不大,I3远大于它们,说明镁容易失去两个电子,而不易失去第三个电子,因此镁易形成Mg2+,而不易形成Mg3+。观察分析下表电离能数据回答问题:问题: 解释为什么钠易形成Na+,而不易形成Na2+;镁元素易形成Mg2+,而不易形成Mg3+?问题1:为什么钠元素的I2远大于I1,而镁元素的I3远大于I1、I2?用所学的原子结构或离子结构知识解释。知识应用观察分析下表电离能数据回答问题:提示:钠离子和镁离子的电子排布式为:
Li+: 1S2 2S22P6 是稳定结构;
Mg2+:1S2 2S22P6,它的P轨道为全充满,结构稳定。如果它们再要失去电子,所需的能量就很大。问题2.用表中提供的数据解释:为什么钠原子的最外层电子数是1而镁原子的最外层电子数为2?知识应用观察分析下表电离能数据回答问题: 钠元素I1远小于I2、I3,说明钠原子核外有一个电子离核远,受核的引力小,易失去;同时也说明I2、I3代表的电子与I1代表的电子不在同一电子层,所以钠原子的最外层电子数为1。而镁元素的I1和I2相差不大,说明它们代表的电子是在同一电子层,I3远大于I1、I2,说明I3代表的电子与I1、I2代表的电子不在同一电子层,所以镁原子最外层的电子数为2。 1、判断下列元素间的第一电离能的大小
Na K N P
F Ne Cl S
Mg Al O N>>>><<课堂练习2、将下列元素按第一电离能由大到小的顺序排列
①K Na Li
②B C Be N
③He Ne Ar
④ Na Al S PLi >Na> KN> C >Be> BHe >Ne > Ar
P >S >Al> Na课堂练习NPBeMgZnAs 5 10 15 20 25 30 35 原子序数I1 1—36号元素的第一电离能LiBHHeCOFNeNaAlSiSClArKCaKrKJ/mol5001000150020002500
第二单元 元素性质的递变规律
(第二课时)元素主要性质有哪些?它们各有怎样的递变规律?1.金属性:同一周期从左到右金属性逐渐减弱;
同一主族从上到下金属性逐渐增强。2.非金属性:同一周期从左到右非金属性逐渐增强;
同一主族从上到下非金属性逐渐减弱。3.元素主要化合价:正价:从+1变到+7,负价:从-4变到-14.原子半径:同一周期从左到右原子半径逐渐减小;
同一主族从上到下原子半径逐渐增大。5.元素第一电离能的周期性变化你知道吗?知识回顾 元素第一电离能是指气态原子失去一个电子形成+1价气态阳离子所需的最低能量。1.元素第一电离能定义:概念应用元素第一电离能大小与原子失电子能力有何关系?问题探究一锂、钠和钾的第一电离能 比较锂、钠和钾原子失去一个电子的难易与吸收能量和元素的金属性之间的关系。2.元素第一电离能意义: 表示元素的原子在气态时失去一个电子的难易程度。元素的第一电离能越小表示它越容易失去电子,即该元素的金属性越强。元素第一电离能的周期性变化第一电离能越小,原子越易失去第一个电子;
第一电离能越大,原子越难失去第一个电子。问题探究二 元素的第一电离能有什么变化规律呢?观察分析下图元素第一电离能的变化情况,寻找它们的变化有哪些规律?同时你是否还能发现一些问题?请讨论总结。NPBeMgZnAs 5 10 15 20 25 30 35 原子序数I1 1—36号元素的第一电离能LiBHHeCOFNeNaAlSiSClArKCaKrKJ/mol5001000150020002500 (1).总体上:金属元素的第一电离能都 较小 ,非金属元素和稀有气体元素的第一电离能都 较大 。(2).同一周期元素的第一电离能从左到右呈增大趋势。(3).同一主族元素的第一电离能从上到下逐渐减小。(4).在同一周期中第一电离能最小的是碱金属元素,最大的是
稀有气体元素。(5).在第二周期中Be和N元素及第三周期中Mg和P的第一电离能大于相邻的元素的第一电离能。总结一下为什么?为什么 ?为什么 ?为什么?为什么?3.元素第一电离能的变化规律规律与总结(1). 金属元素的第一电离能都较小 ,非金属元素
和稀有气体元素的第一电离能都较大 ;为什么? 因为金属元素原子的最外层电子数都比较少,容易失去电子,所以金属元素的第一电离能都比较小;而非金属元素原子的最外层电子比较多,不容易失去电子,稀有气体元素原子外围电子排布式为nS2nP6(He为1S2),是稳定结构,更难失去电子,因此它们的第一电离能都比较大。(从比较金属元素、非金属元素及稀有气体元素的最外层电子数多少入手。)3.元素第一电离能的变化规律(2).同一周期元素的第一电离能 从左到右元素的第一电离能总体上是呈增大趋势。 为什么? (从原子结构的变化来解释。)
因为同一周期从左到右随着核电荷数的增加,元素原子半径减少,核对外层电子引力逐渐增大,失电子所需的能量呈增加趋势,即元素的第一电离能呈增大趋势。3.元素第一电离能的变化规律(3).同一主族元素的第一电离能从上到下,元素第一电离能逐渐减小。 为什么? (从同主族的原子结构变化来回答。)
因为同一主族从上到下,随着核电荷数的增加,电子层数增加,原子半径增大,核对外层电子的引力减小,失电子所需的能量减小,元素第一电离能逐渐减小。3.元素第一电离能的变化规律(4).在同一周期中第一电离能最小的是碱金属元素,最大的是稀有气体元素。为什么? 因为碱金属元素原子的外围电子排布式为nS1,在同周期中(除稀有气体)原子半径最大,核对外层电子引力最小,最容易失去最外层的一个电子,所以碱金属元素的第一电离能在同一周期中最小。而稀有气体元素原子的外围电子排布式为nS2nP6(He为1S2),是稳定结构,在同一周期中最难失去电子,所以在同一周期中稀有气体的第一电离能最大。(从它们的原子的外围电子排布式和原子结构的特点来思考。)3.元素第一电离能的变化规律(5).在第二周期中Be和N元素及第三周期中Mg和P的第一电离能大于它们相邻的元素的第一电离能。为什么? 提示:请同学们先写出Be、B、N、O、Mg、Al、P、S的电子排布式,并作比较。 Be:1S2 2S22P0 (B:1S2 2S22P1)
N:1S2 2S22P3 (O:1S2 2S22P4)
Mg:1S2 2S22P6 3S23P0 (Al:1S2 2S22P6 3S23P1)
P:1S2 2S22P6 3S23P3 (S:1S2 2S22P6 3S23P4)3.元素第一电离能的变化规律当原子核外电子排布在能量相等的轨道上形成全空(P0、d0、f0)或半充满(p3、d5、f7)或全充满(p6、d10、f14)结构时原子处于能量较低状态(即洪特规则特例),所以失电子所需能量较大,即I1较大。而Be、N、Mg、P元素的原子结构恰好满足这一点,所以导致它们的第一电离能大于它们相邻元素。3.元素第一电离能的变化规律同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势;
同一主族,随着电子层数的增加,元素的第一电离能逐渐减小。 即元素第一电离能随着元素核电荷数的递增呈现周期性变化。元素第一电离能的周期性变化元素第一电离能的周期性变化是原子核外电子排布周期性变化的必然结果。4.影响元素的第一电离能大小的因素元素第一电离能的周期性变化(1)原子核对核外电子的引力
(2)原子达到稳定结构的趋势
根据第一电离能的定义, 你能说出什么是元素的第二电离能、元素的第三电离能......吗?讨论后回答。拓展视野 元素的第二、三电离能 气态电中性基态原子失去一个电子形成+1价气态阳离子所需最低能量叫第一电离能,用I1 表示;从+1价气态离子中再失去一个电子,形成+2价气态离子所需要的最低能量叫第二电离能,用I2 表示;依次类推,可得到I3、I4、I5……为什么?同一种元素的逐级电离能大小关系:
I1
Li+: 1S2 2S22P6 是稳定结构;
Mg2+:1S2 2S22P6,它的P轨道为全充满,结构稳定。如果它们再要失去电子,所需的能量就很大。问题2.用表中提供的数据解释:为什么钠原子的最外层电子数是1而镁原子的最外层电子数为2?知识应用观察分析下表电离能数据回答问题: 钠元素I1远小于I2、I3,说明钠原子核外有一个电子离核远,受核的引力小,易失去;同时也说明I2、I3代表的电子与I1代表的电子不在同一电子层,所以钠原子的最外层电子数为1。而镁元素的I1和I2相差不大,说明它们代表的电子是在同一电子层,I3远大于I1、I2,说明I3代表的电子与I1、I2代表的电子不在同一电子层,所以镁原子最外层的电子数为2。 1、判断下列元素间的第一电离能的大小
Na K N P
F Ne Cl S
Mg Al O N>>>><<课堂练习2、将下列元素按第一电离能由大到小的顺序排列
①K Na Li
②B C Be N
③He Ne Ar
④ Na Al S PLi >Na> KN> C >Be> BHe >Ne > Ar
P >S >Al> Na课堂练习NPBeMgZnAs 5 10 15 20 25 30 35 原子序数I1 1—36号元素的第一电离能LiBHHeCOFNeNaAlSiSClArKCaKrKJ/mol5001000150020002500
