沉淀溶解平衡的应用
图片预览





文档简介
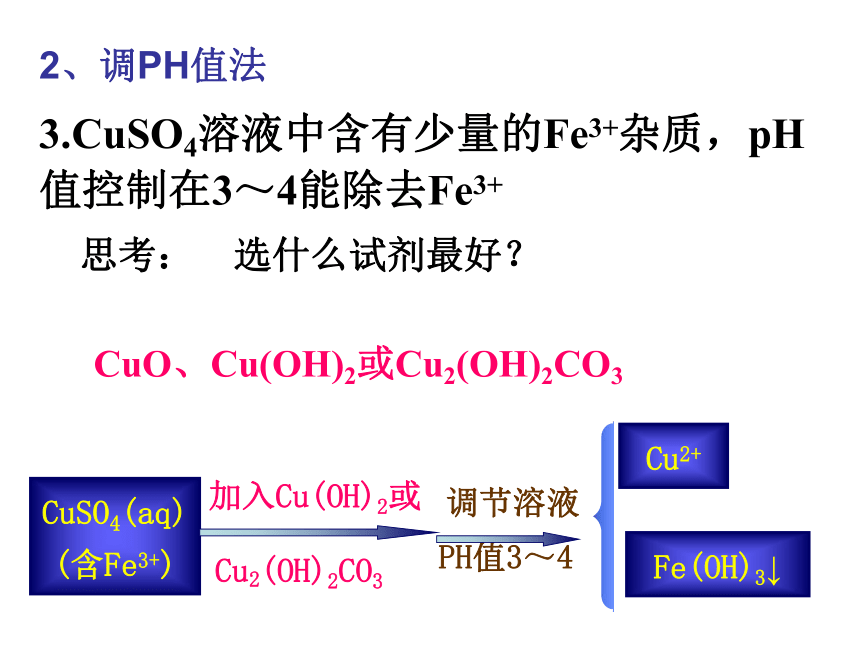
课件18张PPT。2沉淀溶解平衡的应用1.如果误食可溶性钡盐,造成钡中毒,应尽快用5.0%的硫酸钠溶液给患者洗胃。为何不能用Na2CO3?2.精制食盐时,可加入适量的NaOH溶液除去氯化钠中的Mg2+ 1、加沉淀剂法Mg2+ +2OH- == Mg(OH)2 ↓3.CuSO4溶液中含有少量的Fe3+杂质,pH值控制在3~4能除去Fe3+ 思考: 选什么试剂最好?CuO、Cu(OH)2或Cu2(OH)2CO3CuSO4(aq)
(含Fe3+)加入Cu(OH)2或Cu2(OH)2CO3PH值3~4调节溶液Fe(OH)3↓Cu2+2、调PH值法实验一:取一支试管,向其中滴加2ml氯化钠溶液,然后向其中逐滴加入硝酸银溶液,观察现象并记录。实验二:向实验1的试管里滴加碘化钾溶液,观测现象并纪录。实验三:向实验2的试管中滴加硫化钠溶液。活动与探究产生白色沉淀Ag++Cl-=AgCl↓白色沉淀→黄色沉淀黄色沉淀→黑色沉淀已知25℃时AgCl、 AgI、Ag2S 的溶解度分别是1.5×10-4 g 、 2.1×10-7 g 、1.3×10-16 g ,分析上述实验现象的产生原因。
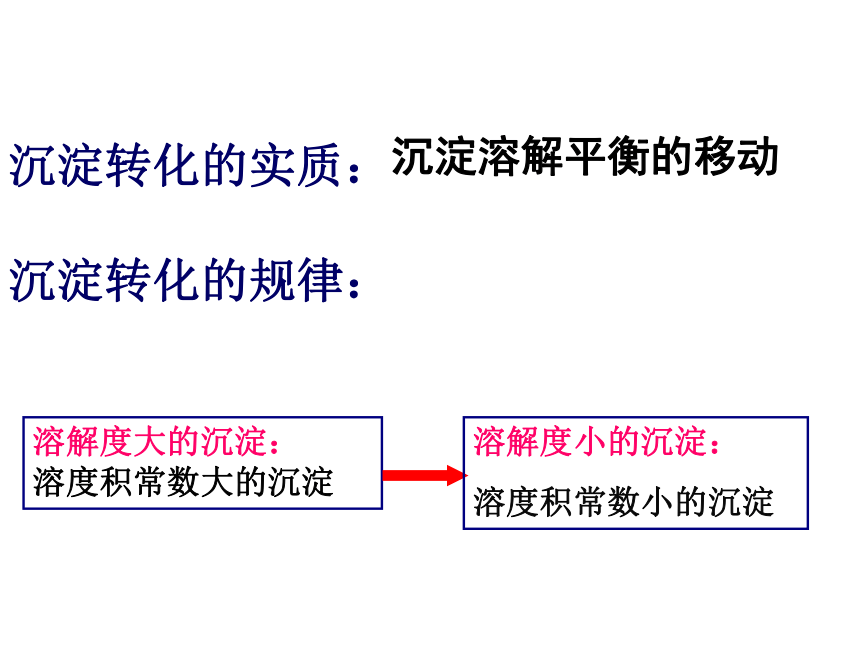
讨 论 由溶解度大的难溶物转化为溶解度小的难溶物沉淀转化方向:AgCl → AgI → Ag2S沉淀转化的实质:
沉淀转化的规律:沉淀溶解平衡的移动
溶解度大的沉淀:
溶度积常数大的沉淀溶解度小的沉淀:
溶度积常数小的沉淀(1)钙、鳞在骨骼牙齿中的存在形式Ca5(PO4)3OH羟基磷酸钙(2)存在的溶解平衡Ca5(PO4)3OH(s)5Ca2+(aq) + 3PO43-(aq) + OH- (aq) 糖吃多了易患龋齿,请大家完成教科书P83页交流与讨论。 化学与生活糖在酶的作用下产生了一种有机弱酸——乳酸能中和OH-,使平衡向脱矿方向移动,羟基磷灰石溶解,加速腐蚀牙齿3)含氟牙膏的使用使用含氟牙膏,可以使难溶物转化为更难溶物质。氟磷灰石更能抵抗酸的侵蚀,使牙齿更坚固注:氟过量会导致氟斑牙,因此,生活在水中含氟量较高的地区的人,不宜使用含氟牙膏 重晶石(主要成分是BaSO4)是制备钡化合物的重要原料 :BaSO4不溶于酸,但可以用饱和Na2CO3溶液处理转化为易溶于酸的BaCO3BaSO4 、BaCO3Ba2+BaSO4……BaCO31、 BaSO4的ksp比 BaCO3小,为什么可以转化?
2、饱和Na2CO3溶液的作用是什么?
3、如何操作才能保证绝大多数BaSO4 转化为BaCO3? 化学与生产化学法除锅炉水垢的流程图水垢成分CaCO3
Mg(OH)2 CaSO4 用饱和Na2CO3
溶液浸泡数天疏松的水垢CaCO3
Mg(OH)2
写出除去水垢过程中发生的所有离子方程式用酸除去水垢 化学与生产开心辞典1.在0.1 mol·L-1 KCl、KBr、KI混合溶液中,逐滴加入AgNO3溶液, 最先产生的沉淀是 ( )
A.AgCl? ????????????
B.AgBr
C.AgI ?
D.三种沉淀同时产生CC2. 要除去MgCl2酸性溶液里少量的FeCl3,不宜选用的试剂是( )
(A)MgO??? (B)MgCO3???
(C)NaOH??? (D)Mg(OH)2
A3.在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀( )
A.溶解; B.增多;
C.不变; D.无法判断
4.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡
则下列说法正确的是
A.恒温下向溶液中加CaO,后溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中的固体质量增加
D.向溶液中加入少量的NaOH固体, Ca(OH)2固体质量不变C5.工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质 FeS、MnS,使这些金属离子形成硫化物沉淀除去。根据以上事实,可推知FeS、MnS具有的相关性质是 ( )
A.在水中的溶解能力大于CuS、CdS、PbS
B.在水中的溶解能力小于CuS、CdS、PbS
C.在水中的溶解能力与CuS、CdS、PbS相同
D.二者均具有较强的吸附性
A请各位多多指导
(含Fe3+)加入Cu(OH)2或Cu2(OH)2CO3PH值3~4调节溶液Fe(OH)3↓Cu2+2、调PH值法实验一:取一支试管,向其中滴加2ml氯化钠溶液,然后向其中逐滴加入硝酸银溶液,观察现象并记录。实验二:向实验1的试管里滴加碘化钾溶液,观测现象并纪录。实验三:向实验2的试管中滴加硫化钠溶液。活动与探究产生白色沉淀Ag++Cl-=AgCl↓白色沉淀→黄色沉淀黄色沉淀→黑色沉淀已知25℃时AgCl、 AgI、Ag2S 的溶解度分别是1.5×10-4 g 、 2.1×10-7 g 、1.3×10-16 g ,分析上述实验现象的产生原因。
讨 论 由溶解度大的难溶物转化为溶解度小的难溶物沉淀转化方向:AgCl → AgI → Ag2S沉淀转化的实质:
沉淀转化的规律:沉淀溶解平衡的移动
溶解度大的沉淀:
溶度积常数大的沉淀溶解度小的沉淀:
溶度积常数小的沉淀(1)钙、鳞在骨骼牙齿中的存在形式Ca5(PO4)3OH羟基磷酸钙(2)存在的溶解平衡Ca5(PO4)3OH(s)5Ca2+(aq) + 3PO43-(aq) + OH- (aq) 糖吃多了易患龋齿,请大家完成教科书P83页交流与讨论。 化学与生活糖在酶的作用下产生了一种有机弱酸——乳酸能中和OH-,使平衡向脱矿方向移动,羟基磷灰石溶解,加速腐蚀牙齿3)含氟牙膏的使用使用含氟牙膏,可以使难溶物转化为更难溶物质。氟磷灰石更能抵抗酸的侵蚀,使牙齿更坚固注:氟过量会导致氟斑牙,因此,生活在水中含氟量较高的地区的人,不宜使用含氟牙膏 重晶石(主要成分是BaSO4)是制备钡化合物的重要原料 :BaSO4不溶于酸,但可以用饱和Na2CO3溶液处理转化为易溶于酸的BaCO3BaSO4 、BaCO3Ba2+BaSO4……BaCO31、 BaSO4的ksp比 BaCO3小,为什么可以转化?
2、饱和Na2CO3溶液的作用是什么?
3、如何操作才能保证绝大多数BaSO4 转化为BaCO3? 化学与生产化学法除锅炉水垢的流程图水垢成分CaCO3
Mg(OH)2 CaSO4 用饱和Na2CO3
溶液浸泡数天疏松的水垢CaCO3
Mg(OH)2
写出除去水垢过程中发生的所有离子方程式用酸除去水垢 化学与生产开心辞典1.在0.1 mol·L-1 KCl、KBr、KI混合溶液中,逐滴加入AgNO3溶液, 最先产生的沉淀是 ( )
A.AgCl? ????????????
B.AgBr
C.AgI ?
D.三种沉淀同时产生CC2. 要除去MgCl2酸性溶液里少量的FeCl3,不宜选用的试剂是( )
(A)MgO??? (B)MgCO3???
(C)NaOH??? (D)Mg(OH)2
A3.在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀( )
A.溶解; B.增多;
C.不变; D.无法判断
4.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡
则下列说法正确的是
A.恒温下向溶液中加CaO,后溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中的固体质量增加
D.向溶液中加入少量的NaOH固体, Ca(OH)2固体质量不变C5.工业废水中常含有Cu2+、Cd2+、Pb2+等重金属离子,可通过加入过量的难溶电解质 FeS、MnS,使这些金属离子形成硫化物沉淀除去。根据以上事实,可推知FeS、MnS具有的相关性质是 ( )
A.在水中的溶解能力大于CuS、CdS、PbS
B.在水中的溶解能力小于CuS、CdS、PbS
C.在水中的溶解能力与CuS、CdS、PbS相同
D.二者均具有较强的吸附性
A请各位多多指导
