2009年泉州市高中毕业班第二次质检理综(化学部分)
文档属性
| 名称 | 2009年泉州市高中毕业班第二次质检理综(化学部分) |  | |
| 格式 | rar | ||
| 文件大小 | 117.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-05-27 16:42:00 | ||
图片预览

文档简介
化学科
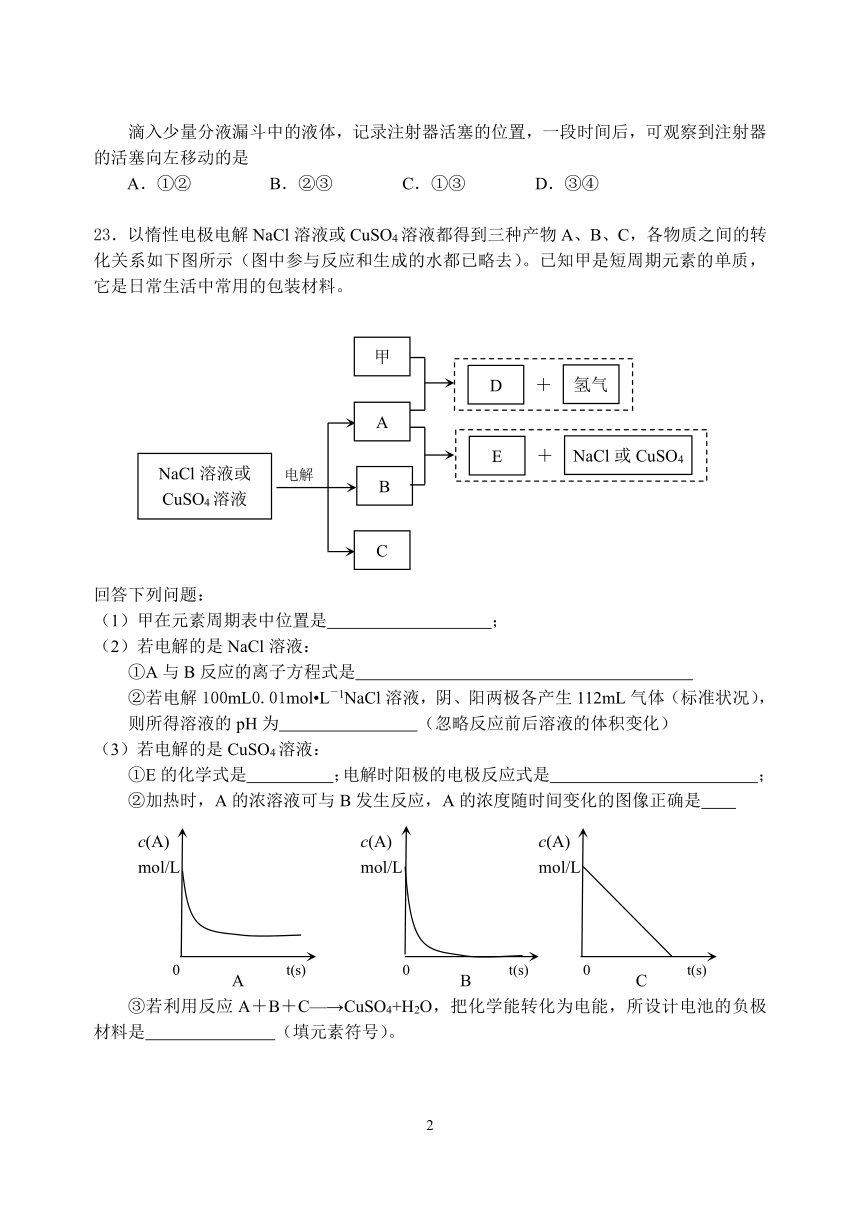
6.下列说法错误的是
A.化学可以识别、改变和创造分子
B.在化学反应中,反应前后原子种类、原子数目和质量一定不变
C.摩尔是一个单位,用于计量物质所含微观粒子的多少
D.同温同压下,相同体积的任何物质,它们的物质的量一定相等
7.在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向逆反应方向移动
B.升高温度,平衡向正反应方向移动
C.加入水稀释,溶液中c(H+)一定增大
D.加入少量CH3COONa固体,平衡向正反应方向移动
8.反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,下列说法正确的是
A.H2CrO4是氧化剂,H2O是氧化产物 B.若3mol H2O2完全反应,则反应中共转移了6NA个电子 C.还原剂与氧化剂的质量比是1:2(M(H2CrO4)=118,M(H2O2)=34) D.氧化产物和还原产物的物质的量之比为2:3
9.下列叙述正确的是
A.汽油、柴油和植物油都是碳氢化合物
B.石油的分馏和煤的干馏都是物理变化
C.纤维素、淀粉、蛋白质在一定条件下都能发生水解反应
D.苯环内含有碳碳单键和碳碳双键
10.下列离子在溶液中能大量共存的是
A.NH4+、SO42-、NO3-、H+?????????? B.I-、NO3-、H+、K+ C.NH4+、Cl-、OH-、NO3- ???????????D.Na+、Ca2+、SO32-、SO42-
11.关于非金属元素O、N、S、Cl的叙述,正确的是
A.在通常情况下,其单质均为气体?? B.非金属性按O、N、S、Cl顺序依次递减
C.每种元素只能形成一种氢化物??????????D.都属于主族元素
12.右图装置的分液漏斗和锥形瓶中所盛的药品如下表所示:
编号
分液漏斗
锥形瓶
①
食盐水
铁钉
②
H2O2水溶液
二氧化锰固体
③
NaOH溶液
FeSO4溶液
④
冷浓硫酸
铝片
滴入少量分液漏斗中的液体,记录注射器活塞的位置,一段时间后,可观察到注射器的活塞向左移动的是
A.①② B.②③ C.①③ D.③④
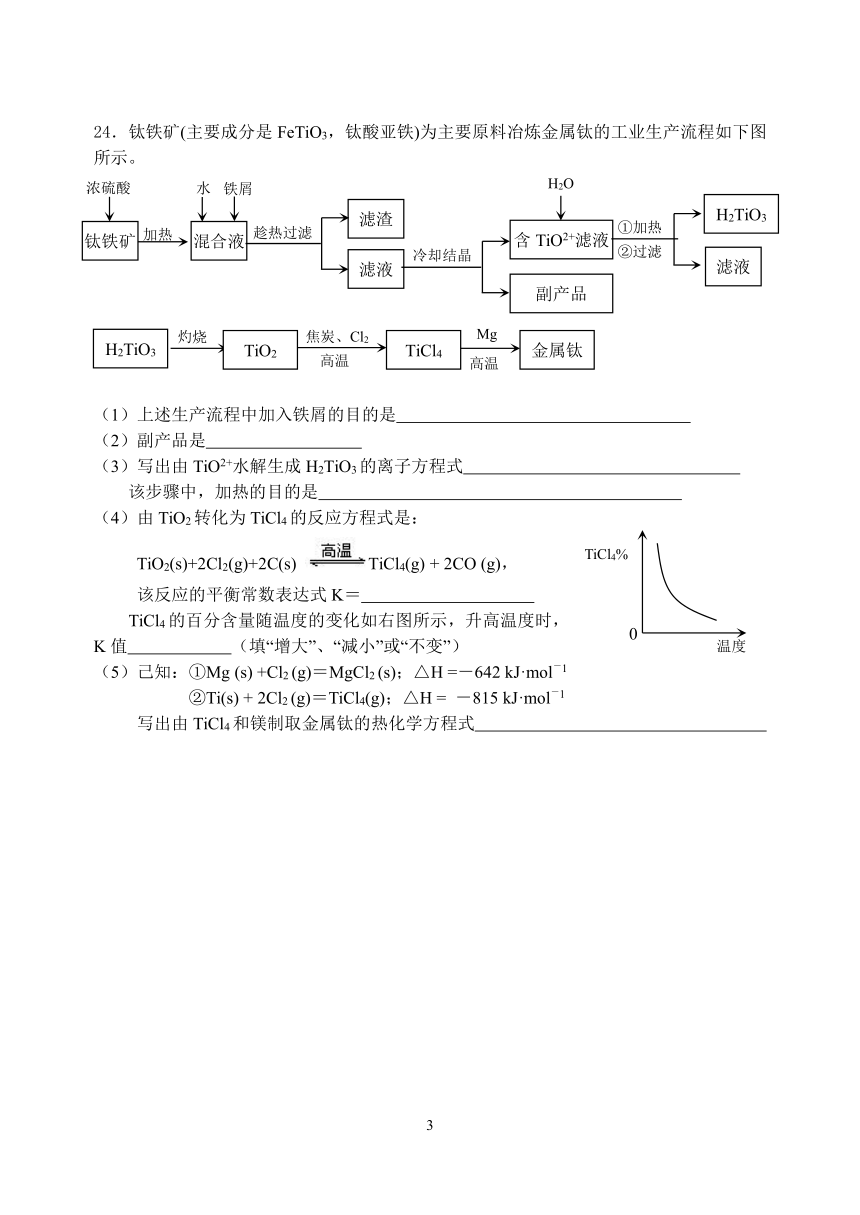
23.以惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。
回答下列问题:
(1)甲在元素周期表中位置是 ;
(2)若电解的是NaCl溶液:
①A与B反应的离子方程式是
②若电解100mL0.01mol?L-1NaCl溶液,阴、阳两极各产生112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)
(3)若电解的是CuSO4溶液:
①E的化学式是 ;电解时阳极的电极反应式是 ;
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是
A B C
③若利用反应A+B+C—→CuSO4+H2O,把化学能转化为电能,所设计电池的负极材料是 (填元素符号)。
24.钛铁矿(主要成分是FeTiO3,钛酸亚铁)为主要原料冶炼金属钛的工业生产流程如下图所示。
(1)上述生产流程中加入铁屑的目的是
(2)副产品是
(3)写出由TiO2+水解生成H2TiO3的离子方程式
该步骤中,加热的目的是
(4)由TiO2转化为TiCl4的反应方程式是: TiO2(s)+2Cl2(g)+2C(s) TiCl4(g) + 2CO (g), 该反应的平衡常数表达式K=
TiCl4的百分含量随温度的变化如右图所示,升高温度时,K值 (填“增大”、“减小”或“不变”)
(5)己知:①Mg (s) +Cl2 (g)=MgCl2 (s);△H =-642 kJ·mol-1
②Ti(s) + 2Cl2 (g)=TiCl4(g);△H = -815 kJ·mol-1
写出由TiCl4和镁制取金属钛的热化学方程式
25.碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
【定性实验】检验溶液中的阴、阳离子。
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是 和
(2)根据实验现象,碳铵与NaOH溶液反应的离子方程式可能是
【定量实验】测定碳铵中C元素和N元素质量比。
该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如下图所示。
(1)碳铵固体应放在 中进行加热。
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(2)从安全的角度考虑,尾气处理的装置可以选用
A B C D
(3)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是 g。
(4)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理。 (填“合理”“不合理”),理由是 。
30.【化学性质与结构】(13分)
很多物质都具有的四面体结构或结构单元。
(1)甲、乙是同主族的两种短周期元素,其单质都具有正四面体的结构或结构单元,甲元素的基态原子的最外层电子排布式为nsnnpn,甲元素的最高价氧化物的分子中含有 个σ键和 个π键。若使乙的最高价氧化物晶体熔化,需要破坏的作用力是
。甲元素和乙元素的电负性较大的是 (填元素符号)。
(2)NH3和PH3都具有四面体结构。NH3和PH3的分解温度分别是1073K和713.2K,NH3比PH3的分解温度高的原因是 ; (3)配合物Ni(CO)4也具有四面体结构,已知常温下Ni(CO)4为液态,易溶于CCl4、苯等有机溶剂。写出基态Ni的电子排布式 ,Ni(CO)4属于 晶体。
(4)Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是 和 。
31.【有机化学基础】(13分)
下图转化关系中,化合物B既能使溴的CCl4溶液褪色,又能与NaHCO3溶液反应生成无色气体;D、E均为高分子化合物;已知一个碳原子同时连接两个羟基的结构不稳定。根据下图填空:
(1)A的结构简式是 ;B中含有官能团名称是 ;
(2)反应③的化学方程式是 ;
(3)反应①的反应类型是 ;
(4)高分子化合物E可作为可降解塑料,E的结构简式是 ;
(5)A的一种同分异构体具有下列性质:不能发生银镜反应,经核磁共振氢谱分析显示,分子中只有2种不同结构位置的氢原子,且两种氢原子个数比为1:2,该同分异构体的结构简式是
6、D 7、B 8、B 9、C 10、A 11、D 12、C
23.(共15分)
(1)第3周期第ⅢA族 (2分)
(2) ①Cl2+2OH-= Cl-+ClO-+H2O; (3分)
②13 (2分)
(3) ①SO2;4OH--4e-=O2↑+H2O (各2分,共4分)
②A (2分)
③Cu (2分)
24.(共15分)
(1)将Fe3+还原为Fe2+ (2分)
(2)FeSO4·7H2O(或 FeSO4) (2分)
(3)TiO2+ +H2OH2TiO3 +2H+;促进TiO2+的水解 (各2分,共4分)
(4);增大 (各2分,共4分)
(5)TiCl4(g)+Mg (s)=Ti(s)+MgCl2 (s) ;△H =-469kJ·mol-1 (3分)
25.(共15分)
【定性实验】
(1)HCO3-、CO32- (各1分,共2分)
(2)NH4++OH-=NH3↑+H2O;HCO3-+OH-=CO32-+H2O
(或NH4++HCO3-+2OH-=NH3+CO32-+2H2O) (3分)
【定量实验】
(1)A (2分)
(2)A (2分)
(3) (3分)
(4)本小题属于开放性试题,若考生回答“合理”或“不合理”且理由能做出相应解释,可酌情给分。例如:考生回答
①不合理,因为碳铵中可能含有HCO3-,不能与BaCl2产生沉淀,所测得碳元素质量分数不准确。给3分
②合理,因为碳铵中只含有CO32-,加入BaCl2能完全生成沉淀,可准确测得碳元素的质量”。给3分
③不合理;测得的结果不准确。给2分
30.【化学性质与结构】(共13分)
(1)2;2; (各1分,共2分)
共价键;C (各1分,共2分)
(2)N-H键键能大于P-H键,因此NH3分解温度高于PH3 (2分)
(3)1s22s22p63s23p63d8或[Ar] 3s23p63d8; (3分)
分子 (2分)
(4)4s;4p (2分)
31.【有机化学基础】(共13分)
(1) (2分)
碳碳双键、羧基 (各1分,共2分)
(2)
(3分)
(3)消去反应 (2分)
(4) (2分)
(5) (2分)
6.下列说法错误的是
A.化学可以识别、改变和创造分子
B.在化学反应中,反应前后原子种类、原子数目和质量一定不变
C.摩尔是一个单位,用于计量物质所含微观粒子的多少
D.同温同压下,相同体积的任何物质,它们的物质的量一定相等
7.在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向逆反应方向移动
B.升高温度,平衡向正反应方向移动
C.加入水稀释,溶液中c(H+)一定增大
D.加入少量CH3COONa固体,平衡向正反应方向移动
8.反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,下列说法正确的是
A.H2CrO4是氧化剂,H2O是氧化产物 B.若3mol H2O2完全反应,则反应中共转移了6NA个电子 C.还原剂与氧化剂的质量比是1:2(M(H2CrO4)=118,M(H2O2)=34) D.氧化产物和还原产物的物质的量之比为2:3
9.下列叙述正确的是
A.汽油、柴油和植物油都是碳氢化合物
B.石油的分馏和煤的干馏都是物理变化
C.纤维素、淀粉、蛋白质在一定条件下都能发生水解反应
D.苯环内含有碳碳单键和碳碳双键
10.下列离子在溶液中能大量共存的是
A.NH4+、SO42-、NO3-、H+?????????? B.I-、NO3-、H+、K+ C.NH4+、Cl-、OH-、NO3- ???????????D.Na+、Ca2+、SO32-、SO42-
11.关于非金属元素O、N、S、Cl的叙述,正确的是
A.在通常情况下,其单质均为气体?? B.非金属性按O、N、S、Cl顺序依次递减
C.每种元素只能形成一种氢化物??????????D.都属于主族元素
12.右图装置的分液漏斗和锥形瓶中所盛的药品如下表所示:
编号
分液漏斗
锥形瓶
①
食盐水
铁钉
②
H2O2水溶液
二氧化锰固体
③
NaOH溶液
FeSO4溶液
④
冷浓硫酸
铝片
滴入少量分液漏斗中的液体,记录注射器活塞的位置,一段时间后,可观察到注射器的活塞向左移动的是
A.①② B.②③ C.①③ D.③④
23.以惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。
回答下列问题:
(1)甲在元素周期表中位置是 ;
(2)若电解的是NaCl溶液:
①A与B反应的离子方程式是
②若电解100mL0.01mol?L-1NaCl溶液,阴、阳两极各产生112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化)
(3)若电解的是CuSO4溶液:
①E的化学式是 ;电解时阳极的电极反应式是 ;
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是
A B C
③若利用反应A+B+C—→CuSO4+H2O,把化学能转化为电能,所设计电池的负极材料是 (填元素符号)。
24.钛铁矿(主要成分是FeTiO3,钛酸亚铁)为主要原料冶炼金属钛的工业生产流程如下图所示。
(1)上述生产流程中加入铁屑的目的是
(2)副产品是
(3)写出由TiO2+水解生成H2TiO3的离子方程式
该步骤中,加热的目的是
(4)由TiO2转化为TiCl4的反应方程式是: TiO2(s)+2Cl2(g)+2C(s) TiCl4(g) + 2CO (g), 该反应的平衡常数表达式K=
TiCl4的百分含量随温度的变化如右图所示,升高温度时,K值 (填“增大”、“减小”或“不变”)
(5)己知:①Mg (s) +Cl2 (g)=MgCl2 (s);△H =-642 kJ·mol-1
②Ti(s) + 2Cl2 (g)=TiCl4(g);△H = -815 kJ·mol-1
写出由TiCl4和镁制取金属钛的热化学方程式
25.碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
【定性实验】检验溶液中的阴、阳离子。
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是 和
(2)根据实验现象,碳铵与NaOH溶液反应的离子方程式可能是
【定量实验】测定碳铵中C元素和N元素质量比。
该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如下图所示。
(1)碳铵固体应放在 中进行加热。
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(2)从安全的角度考虑,尾气处理的装置可以选用
A B C D
(3)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是 g。
(4)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理。 (填“合理”“不合理”),理由是 。
30.【化学性质与结构】(13分)
很多物质都具有的四面体结构或结构单元。
(1)甲、乙是同主族的两种短周期元素,其单质都具有正四面体的结构或结构单元,甲元素的基态原子的最外层电子排布式为nsnnpn,甲元素的最高价氧化物的分子中含有 个σ键和 个π键。若使乙的最高价氧化物晶体熔化,需要破坏的作用力是
。甲元素和乙元素的电负性较大的是 (填元素符号)。
(2)NH3和PH3都具有四面体结构。NH3和PH3的分解温度分别是1073K和713.2K,NH3比PH3的分解温度高的原因是 ; (3)配合物Ni(CO)4也具有四面体结构,已知常温下Ni(CO)4为液态,易溶于CCl4、苯等有机溶剂。写出基态Ni的电子排布式 ,Ni(CO)4属于 晶体。
(4)Zn(NH3)42+离子也具有四面体结构,Zn2+可提供4个能量最低的空轨道与NH3参与形成配位键,这4个空轨道是 和 。
31.【有机化学基础】(13分)
下图转化关系中,化合物B既能使溴的CCl4溶液褪色,又能与NaHCO3溶液反应生成无色气体;D、E均为高分子化合物;已知一个碳原子同时连接两个羟基的结构不稳定。根据下图填空:
(1)A的结构简式是 ;B中含有官能团名称是 ;
(2)反应③的化学方程式是 ;
(3)反应①的反应类型是 ;
(4)高分子化合物E可作为可降解塑料,E的结构简式是 ;
(5)A的一种同分异构体具有下列性质:不能发生银镜反应,经核磁共振氢谱分析显示,分子中只有2种不同结构位置的氢原子,且两种氢原子个数比为1:2,该同分异构体的结构简式是
6、D 7、B 8、B 9、C 10、A 11、D 12、C
23.(共15分)
(1)第3周期第ⅢA族 (2分)
(2) ①Cl2+2OH-= Cl-+ClO-+H2O; (3分)
②13 (2分)
(3) ①SO2;4OH--4e-=O2↑+H2O (各2分,共4分)
②A (2分)
③Cu (2分)
24.(共15分)
(1)将Fe3+还原为Fe2+ (2分)
(2)FeSO4·7H2O(或 FeSO4) (2分)
(3)TiO2+ +H2OH2TiO3 +2H+;促进TiO2+的水解 (各2分,共4分)
(4);增大 (各2分,共4分)
(5)TiCl4(g)+Mg (s)=Ti(s)+MgCl2 (s) ;△H =-469kJ·mol-1 (3分)
25.(共15分)
【定性实验】
(1)HCO3-、CO32- (各1分,共2分)
(2)NH4++OH-=NH3↑+H2O;HCO3-+OH-=CO32-+H2O
(或NH4++HCO3-+2OH-=NH3+CO32-+2H2O) (3分)
【定量实验】
(1)A (2分)
(2)A (2分)
(3) (3分)
(4)本小题属于开放性试题,若考生回答“合理”或“不合理”且理由能做出相应解释,可酌情给分。例如:考生回答
①不合理,因为碳铵中可能含有HCO3-,不能与BaCl2产生沉淀,所测得碳元素质量分数不准确。给3分
②合理,因为碳铵中只含有CO32-,加入BaCl2能完全生成沉淀,可准确测得碳元素的质量”。给3分
③不合理;测得的结果不准确。给2分
30.【化学性质与结构】(共13分)
(1)2;2; (各1分,共2分)
共价键;C (各1分,共2分)
(2)N-H键键能大于P-H键,因此NH3分解温度高于PH3 (2分)
(3)1s22s22p63s23p63d8或[Ar] 3s23p63d8; (3分)
分子 (2分)
(4)4s;4p (2分)
31.【有机化学基础】(共13分)
(1) (2分)
碳碳双键、羧基 (各1分,共2分)
(2)
(3分)
(3)消去反应 (2分)
(4) (2分)
(5) (2分)
同课章节目录
