专题一 化学家眼中的物质世界复习(浙江省温州市)
文档属性
| 名称 | 专题一 化学家眼中的物质世界复习(浙江省温州市) |  | |
| 格式 | rar | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-05-29 16:54:00 | ||
图片预览



文档简介
课件51张PPT。专题1 化学家眼中的物质世界一:物质的分类及其转化
1:物质的的分类
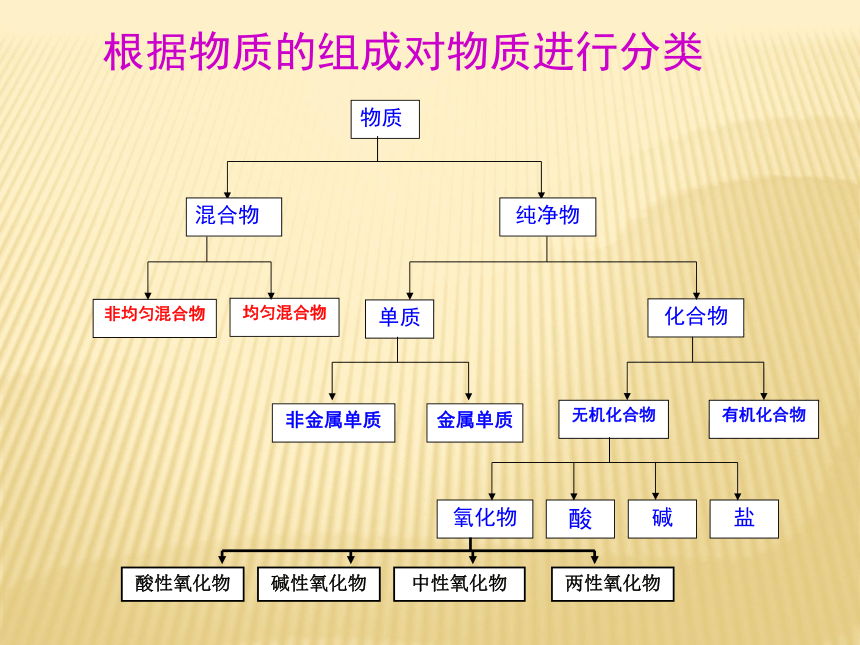
P3图1-2
(1)酸性氧化物、碱性氧化物
CaO CO2 等
酸性氧化物:
CO2、SO2等能与碱反应生成盐和水的氧化物碱性氧化物:
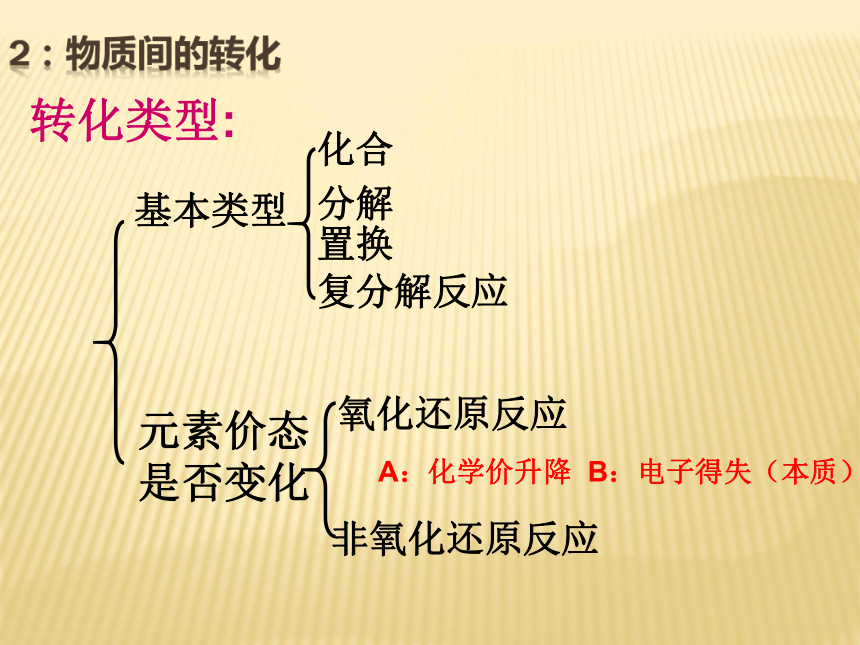
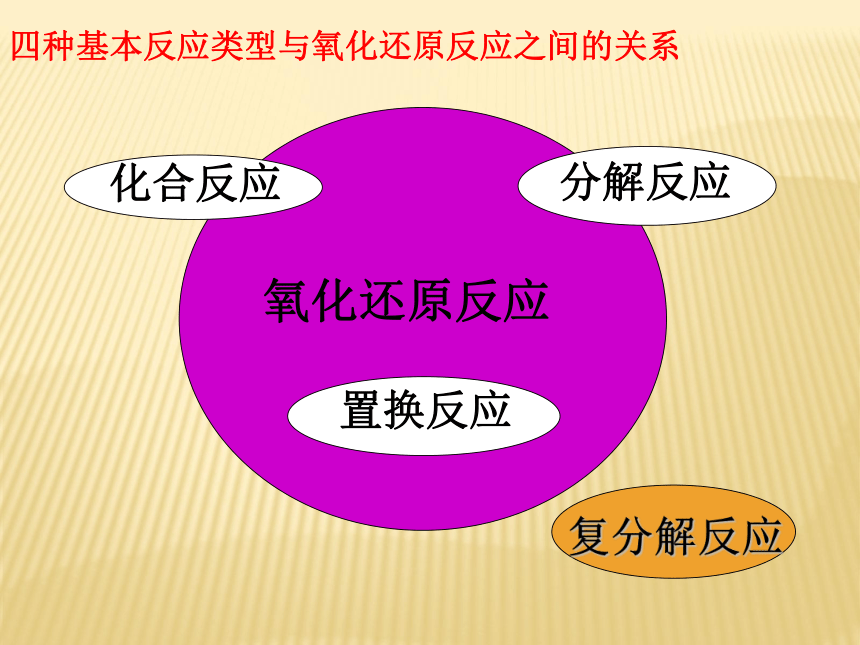
CaO、Na2O等能与酸反应生成盐和水的氧化物物质根据物质的组成对物质进行分类转化类型:基本类型元素价态是否变化2:物质间的转化 A:化学价升降 B:电子得失(本质)氧化还原反应四种基本反应类型与氧化还原反应之间的关系
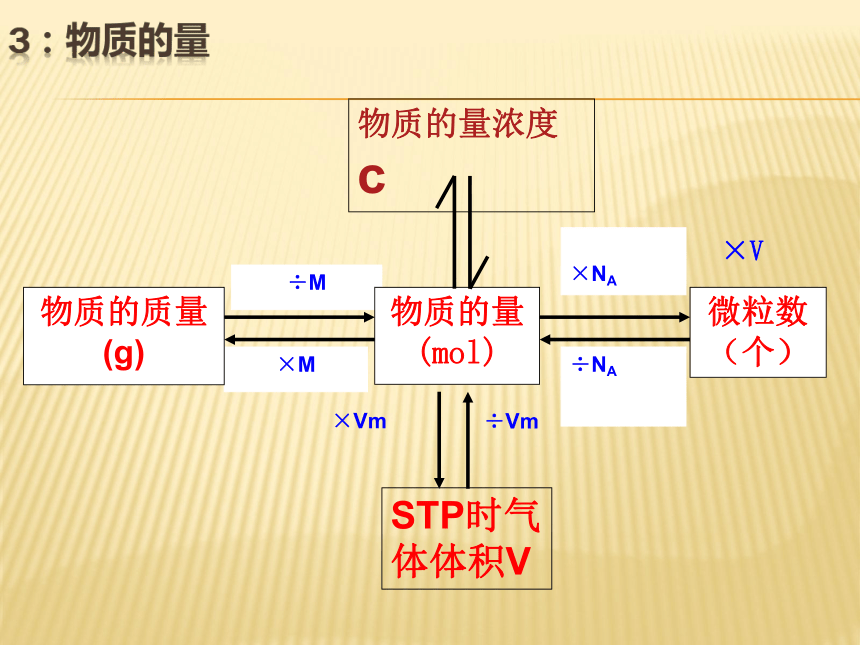
÷ V ×V
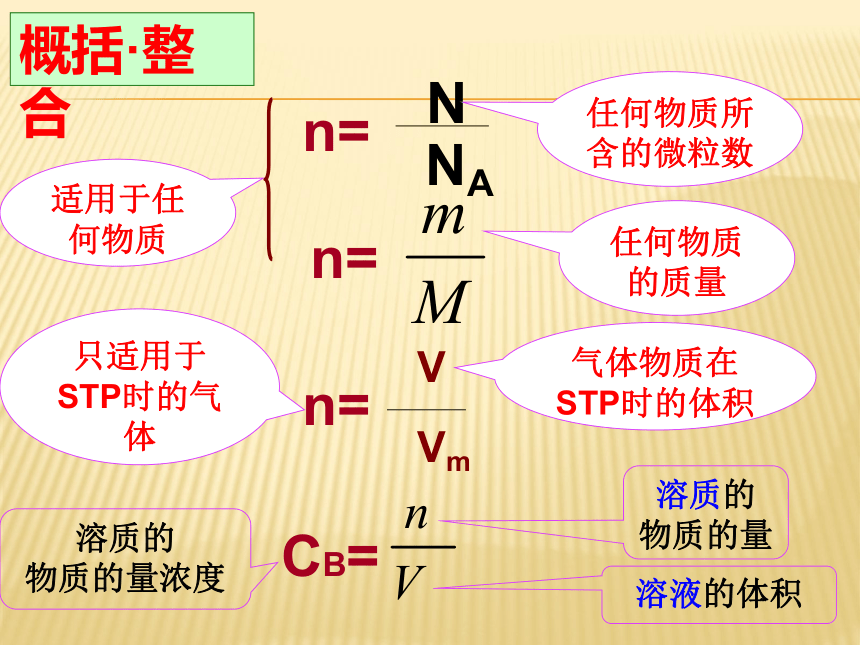
物质的量浓度c3:物质的量 n=任何物质所含的微粒数任何物质的质量气体物质在STP时的体积只适用于STP时的气体概括·整合CB=溶质的
物质的量浓度溶液的体积溶质的
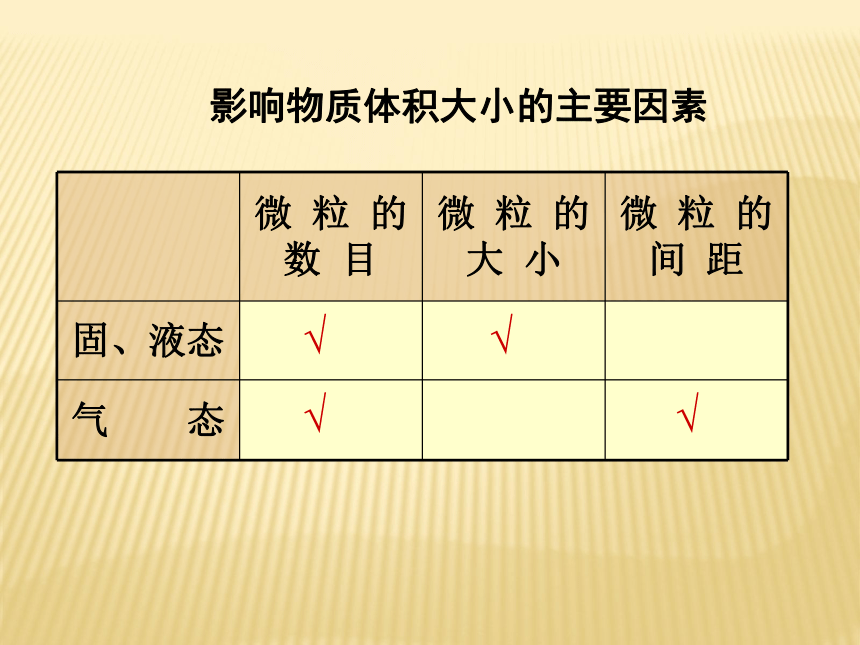
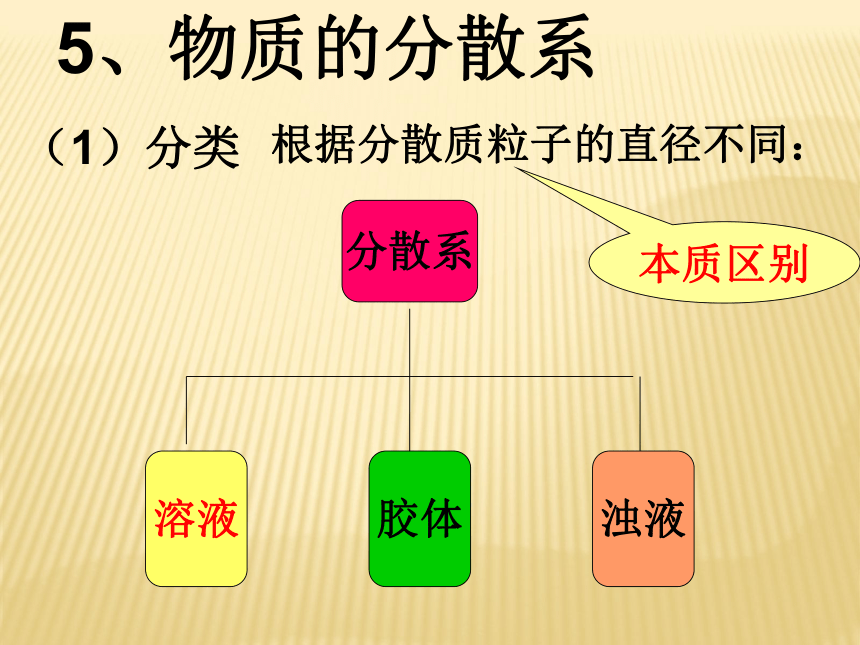
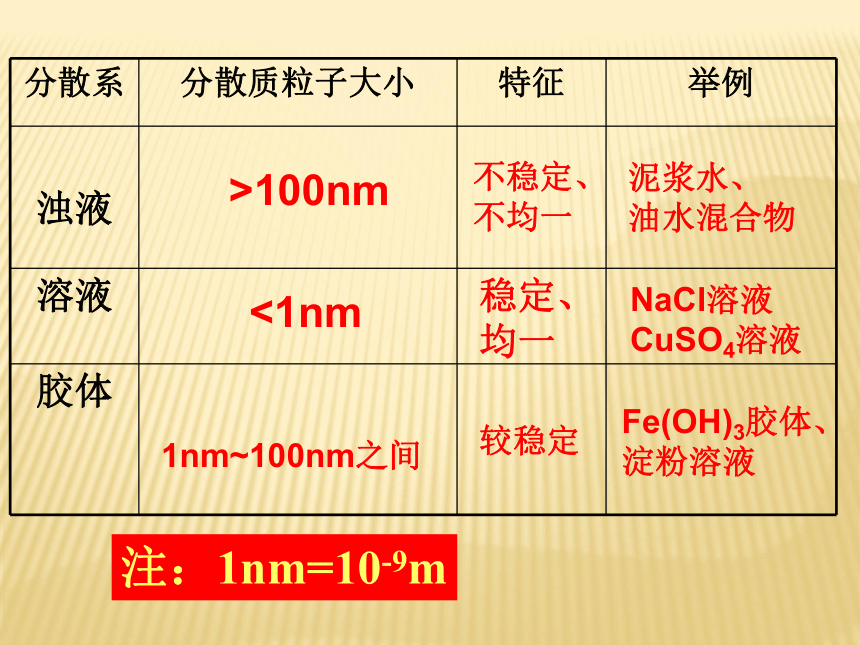
物质的量不同聚集状态物质的结构与性质微观结构微粒的运动 方 式有固定的形状,几乎不能被压缩没有固定的形状,但不能被压缩没有固定的形状,且容易被压缩微粒排列紧密,微粒间的空隙很小微粒排列较紧密,微粒间的空隙较小微粒之间的距离较大在固定的位置上振动可以自由移动可以自由移动4、物质的聚集状态影响物质体积大小的主要因素√ √ √ √ (1)分类根据分散质粒子的直径不同:本质区别5、物质的分散系 注:1nm=10-9m>100nm<1nm1nm~100nm之间不稳定、不均一稳定、
均一较稳定泥浆水、
油水混合物NaCl溶液
CuSO4溶液Fe(OH)3胶体、
淀粉溶液
CuSO4溶液Fe(OH)3胶体(2)、胶体的性质与应用A:丁达尔效应在污水中加入明矾 浑浊现象消失(B)胶体的凝聚沉降提纯: 可通过渗析法提纯胶体。C:渗析法6、电解质与非电解质在水溶液中或熔融状态下能导电的化合物。如酸、碱和盐金属氧化物(溶于水和熔融都能导电)化合物等。非电解质:酒精、蔗糖练习1:⑴硫酸 ⑵蔗糖 ⑶氨 ⑷HNO3 ⑸NH3·H2O⑹锌粒 ⑺NH4Cl ⑻乙醇⑼碳酸钙 ⑽Ca(OH)2 ⑾H3PO4 ⑿Na2O(13)盐酸
判断上述物质中属于非电解质的是_________。
属于电解质的是______。
2、 3、 81 、4 、 5 、7、9 、10 、11、 12电离方程式NaCl Na+ + Cl-请写出下列物质的电离方程式:
CO2 、氯化钠、硫酸、
碳酸氢钠、硫酸氢钠、碳酸钠一:基本实验方法单元二: 研究物质的 实验方法 操作要点:“一贴,二低,三靠”分离液体和不溶
于液体的固体
例如用过滤法除
去粗盐中的泥沙 。二 结晶 结晶方法:蒸发结晶冷却结晶此法主要用于溶解度随温度改变而变化不大的物质。(如氯化钠)此法主要用于溶解度随温度下降而明显减小的物质。三 蒸馏(例如蒸馏含有Fe3+的水提纯其中水份,蒸馏石油提纯不同沸点的有机组分) 分离分离沸点不同的互溶的液态混合物四 萃取和分液1 原理:萃取:利用某溶质在互不相溶的溶剂中的溶解度不同,一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来,再利用分液的原理和方法将它们分离开来。分液:把两种互不相溶的液体(且密度不同)分开的操作步骤:检漏装液振荡静置分液分液漏斗、
铁架台、
烧杯实验萃取(1)用量筒量取10ml碘的饱和水溶液,倒入分液漏斗,
然后再注入4ml四氯化碳(CCl4),盖好玻璃塞。装液
(2)用右手压住分液漏斗口部,左手握住活塞部分,
分液漏斗转过来用力振荡。振荡
(3)把分液漏斗放在铁架台上,静置。静置
(4)待液体分层后,将分液漏斗上的玻璃塞打开,或使
塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液
漏斗下面的活塞打开,使下层液体漫漫流出。分液
(分液时,下层液体从漏斗管流出,上层液体从上口流)
7、渗析 用半透膜分离溶液和胶体8 升华分离某些具有升华特性的固体和受热不分解的固体组成的混合物三:常见物质的检验 一些物质的检验方法与盐酸反应,产生气体通入澄清石灰水有无色无味气体产生,澄清石灰水变浑浊用紫色石蕊试液;用PH试纸紫色石蕊变红;
PH试纸变色,PH<7用紫色石蕊试液;用PH试纸紫色石蕊变蓝;
PH试纸变色,PH>7与碘水反应变蓝灼烧有烧焦羽毛的气味检验试剂:氢氧化钠(或其他强碱溶液)、
红色石蕊试纸实验操作及现象:
固体氯化铵中加浓的氢氧化钠加热,用湿润
的红色石蕊试纸在试管口检验,试纸变蓝。化学方程式:1、NH4+的检验检验试剂:AgNO3 ,稀的硝酸实验操作及实验现象:
KCl溶液中滴加AgNO3,生成白色沉淀,
再加稀硝酸,振荡,沉淀不溶解.NH4Cl+AgNO3==AgCl +NH4NO3
Cl-的检验化学方程式:检验试剂:氯化钡,稀盐酸 实验操作及实验现象:
在硫酸铵溶液中加稀盐酸酸化,
再加氯化钡,出现 沉淀且不溶解(NH4)2SO4+BaCl2====BaSO4 +2NH4Cl
SO42-的检验化学方程式:注意加料的先后顺序Na+、K+的检验焰色反应: 许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。焰色反应是指金属元素的性质。焰色反应实验步骤:(3)用稀盐酸洗净铂丝(方法同(1)),
并将铂丝保存好。(1)取一根铂丝(或光洁无绣的铁丝)在稀盐酸中清洗一下,然后在火焰上灼烧,反复多次,直至与火焰同色。(2)蘸取试样在火焰上灼烧,观察火焰的颜色(钾要透过蓝色钴玻璃观察)目的:洗净防止其他杂质的干扰。溶液的配制和分析一、物质的量浓度1、 定义:以单位体积溶液中所含有的溶质的物质的量来表示溶液的组成。2、 单位:mol/L (或mol/m3)3、公式:例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?
解:n(NaCl) = C(NaCl)·V
= 1.6mol/L×0.25L = 0.4mol
m(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g
答:需要NaCl的质量为23.4g。
3.有关溶液稀释和浓缩的计算
思路:稀溶液前后溶质的物质的量相等
1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L, 其体积为多少毫升?
解:10mL×2mol/L=V(H2SO4) ×0.5mol/L结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 配制500mL0.1mol/LNa2CO3溶液。1、实验仪器: 烧杯、玻璃棒、胶头滴管、托盘天平、药匙、量筒、纸片、试剂瓶 500mL容量瓶、二:一定物质的量浓度溶液的配制 配制一定物质的量浓度溶液5.3gNa2CO31、计算2. 称量3. 溶解4. 转移5. 洗涤6.定容7. 摇匀8. 装瓶贴签二、实验步骤3、误差判断???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变第三单元
人类对原子结构的认识原子结构演变图示各层电子的数目 原子符号核电荷数电子层(1)、原子结构示意图2、核外电子分层排布2.原子的构成关系式2:(质量关系)
质量数(A)=质子数(Z)+中子数(N)原子组成符号a、b、c、d、e各代表什么? a——代表质量数;
b——代表核电荷数(质子数)
c——代表离子所带的电荷数
d——代表化合价
e——代表原子个数元素:具有相同质子数的同一类原子的总称。同位素:质子数相同而中子数不同的核素互称为同位素。(两同两不同)核素:具有一定质子数和一定中子数的一种原子。3、元素、核素、同位素H、 D、 T氢、 重氢、 超重氢3.元素、核素和同位素的关系
1:物质的的分类
P3图1-2
(1)酸性氧化物、碱性氧化物
CaO CO2 等
酸性氧化物:
CO2、SO2等能与碱反应生成盐和水的氧化物碱性氧化物:
CaO、Na2O等能与酸反应生成盐和水的氧化物物质根据物质的组成对物质进行分类转化类型:基本类型元素价态是否变化2:物质间的转化 A:化学价升降 B:电子得失(本质)氧化还原反应四种基本反应类型与氧化还原反应之间的关系
÷ V ×V
物质的量浓度c3:物质的量 n=任何物质所含的微粒数任何物质的质量气体物质在STP时的体积只适用于STP时的气体概括·整合CB=溶质的
物质的量浓度溶液的体积溶质的
物质的量不同聚集状态物质的结构与性质微观结构微粒的运动 方 式有固定的形状,几乎不能被压缩没有固定的形状,但不能被压缩没有固定的形状,且容易被压缩微粒排列紧密,微粒间的空隙很小微粒排列较紧密,微粒间的空隙较小微粒之间的距离较大在固定的位置上振动可以自由移动可以自由移动4、物质的聚集状态影响物质体积大小的主要因素√ √ √ √ (1)分类根据分散质粒子的直径不同:本质区别5、物质的分散系 注:1nm=10-9m>100nm<1nm1nm~100nm之间不稳定、不均一稳定、
均一较稳定泥浆水、
油水混合物NaCl溶液
CuSO4溶液Fe(OH)3胶体、
淀粉溶液
CuSO4溶液Fe(OH)3胶体(2)、胶体的性质与应用A:丁达尔效应在污水中加入明矾 浑浊现象消失(B)胶体的凝聚沉降提纯: 可通过渗析法提纯胶体。C:渗析法6、电解质与非电解质在水溶液中或熔融状态下能导电的化合物。如酸、碱和盐金属氧化物(溶于水和熔融都能导电)化合物等。非电解质:酒精、蔗糖练习1:⑴硫酸 ⑵蔗糖 ⑶氨 ⑷HNO3 ⑸NH3·H2O⑹锌粒 ⑺NH4Cl ⑻乙醇⑼碳酸钙 ⑽Ca(OH)2 ⑾H3PO4 ⑿Na2O(13)盐酸
判断上述物质中属于非电解质的是_________。
属于电解质的是______。
2、 3、 81 、4 、 5 、7、9 、10 、11、 12电离方程式NaCl Na+ + Cl-请写出下列物质的电离方程式:
CO2 、氯化钠、硫酸、
碳酸氢钠、硫酸氢钠、碳酸钠一:基本实验方法单元二: 研究物质的 实验方法 操作要点:“一贴,二低,三靠”分离液体和不溶
于液体的固体
例如用过滤法除
去粗盐中的泥沙 。二 结晶 结晶方法:蒸发结晶冷却结晶此法主要用于溶解度随温度改变而变化不大的物质。(如氯化钠)此法主要用于溶解度随温度下降而明显减小的物质。三 蒸馏(例如蒸馏含有Fe3+的水提纯其中水份,蒸馏石油提纯不同沸点的有机组分) 分离分离沸点不同的互溶的液态混合物四 萃取和分液1 原理:萃取:利用某溶质在互不相溶的溶剂中的溶解度不同,一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来,再利用分液的原理和方法将它们分离开来。分液:把两种互不相溶的液体(且密度不同)分开的操作步骤:检漏装液振荡静置分液分液漏斗、
铁架台、
烧杯实验萃取(1)用量筒量取10ml碘的饱和水溶液,倒入分液漏斗,
然后再注入4ml四氯化碳(CCl4),盖好玻璃塞。装液
(2)用右手压住分液漏斗口部,左手握住活塞部分,
分液漏斗转过来用力振荡。振荡
(3)把分液漏斗放在铁架台上,静置。静置
(4)待液体分层后,将分液漏斗上的玻璃塞打开,或使
塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液
漏斗下面的活塞打开,使下层液体漫漫流出。分液
(分液时,下层液体从漏斗管流出,上层液体从上口流)
7、渗析 用半透膜分离溶液和胶体8 升华分离某些具有升华特性的固体和受热不分解的固体组成的混合物三:常见物质的检验 一些物质的检验方法与盐酸反应,产生气体通入澄清石灰水有无色无味气体产生,澄清石灰水变浑浊用紫色石蕊试液;用PH试纸紫色石蕊变红;
PH试纸变色,PH<7用紫色石蕊试液;用PH试纸紫色石蕊变蓝;
PH试纸变色,PH>7与碘水反应变蓝灼烧有烧焦羽毛的气味检验试剂:氢氧化钠(或其他强碱溶液)、
红色石蕊试纸实验操作及现象:
固体氯化铵中加浓的氢氧化钠加热,用湿润
的红色石蕊试纸在试管口检验,试纸变蓝。化学方程式:1、NH4+的检验检验试剂:AgNO3 ,稀的硝酸实验操作及实验现象:
KCl溶液中滴加AgNO3,生成白色沉淀,
再加稀硝酸,振荡,沉淀不溶解.NH4Cl+AgNO3==AgCl +NH4NO3
Cl-的检验化学方程式:检验试剂:氯化钡,稀盐酸 实验操作及实验现象:
在硫酸铵溶液中加稀盐酸酸化,
再加氯化钡,出现 沉淀且不溶解(NH4)2SO4+BaCl2====BaSO4 +2NH4Cl
SO42-的检验化学方程式:注意加料的先后顺序Na+、K+的检验焰色反应: 许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。焰色反应是指金属元素的性质。焰色反应实验步骤:(3)用稀盐酸洗净铂丝(方法同(1)),
并将铂丝保存好。(1)取一根铂丝(或光洁无绣的铁丝)在稀盐酸中清洗一下,然后在火焰上灼烧,反复多次,直至与火焰同色。(2)蘸取试样在火焰上灼烧,观察火焰的颜色(钾要透过蓝色钴玻璃观察)目的:洗净防止其他杂质的干扰。溶液的配制和分析一、物质的量浓度1、 定义:以单位体积溶液中所含有的溶质的物质的量来表示溶液的组成。2、 单位:mol/L (或mol/m3)3、公式:例2:配制250mL1.6mol/LNaCl溶液,需要NaCl的质量是多少?
解:n(NaCl) = C(NaCl)·V
= 1.6mol/L×0.25L = 0.4mol
m(NaCl)=n(NaCl)·M(NaCl)
=0.4mol×58.5g/mol = 23.4g
答:需要NaCl的质量为23.4g。
3.有关溶液稀释和浓缩的计算
思路:稀溶液前后溶质的物质的量相等
1。将10毫升2 mol/L的硫酸溶液加水稀释到0.5mol/L, 其体积为多少毫升?
解:10mL×2mol/L=V(H2SO4) ×0.5mol/L结论:浓溶液配制稀溶液前后溶质的量不变
C1V1= C2V2 配制500mL0.1mol/LNa2CO3溶液。1、实验仪器: 烧杯、玻璃棒、胶头滴管、托盘天平、药匙、量筒、纸片、试剂瓶 500mL容量瓶、二:一定物质的量浓度溶液的配制 配制一定物质的量浓度溶液5.3gNa2CO31、计算2. 称量3. 溶解4. 转移5. 洗涤6.定容7. 摇匀8. 装瓶贴签二、实验步骤3、误差判断???? 根据 C = n / V 或(n = m / V)分析(以配制某浓度NaOH溶液为例,请同学们将C 的结果填入表中)减小 不变减小 减小 不变减小 减小 不变减小 不变减小 增大 减小 不变减小 不变增大减小不变减小 增大不变增大 减小 不变不变不变第三单元
人类对原子结构的认识原子结构演变图示各层电子的数目 原子符号核电荷数电子层(1)、原子结构示意图2、核外电子分层排布2.原子的构成关系式2:(质量关系)
质量数(A)=质子数(Z)+中子数(N)原子组成符号a、b、c、d、e各代表什么? a——代表质量数;
b——代表核电荷数(质子数)
c——代表离子所带的电荷数
d——代表化合价
e——代表原子个数元素:具有相同质子数的同一类原子的总称。同位素:质子数相同而中子数不同的核素互称为同位素。(两同两不同)核素:具有一定质子数和一定中子数的一种原子。3、元素、核素、同位素H、 D、 T氢、 重氢、 超重氢3.元素、核素和同位素的关系
