从海水中获得的化学物质 综合复习教案(浙江省温州市)
文档属性
| 名称 | 从海水中获得的化学物质 综合复习教案(浙江省温州市) |
|
|
| 格式 | rar | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-05-29 00:00:00 | ||
图片预览








文档简介
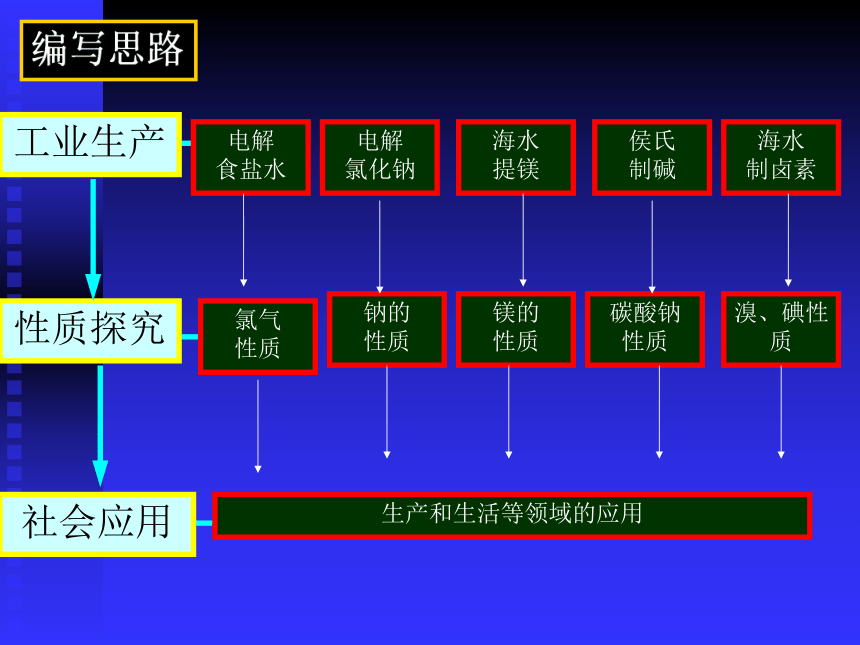
课件25张PPT。编写思路工业生产性质探究社会应用必修1:专题2说课仪征中学 李 萍从海水中获得的化学物质学习目标 根据生产、生活中的应用实例或通过实验探究,了解钠、镁、氯及其重要化合物的主要性质和重要应用。
通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。
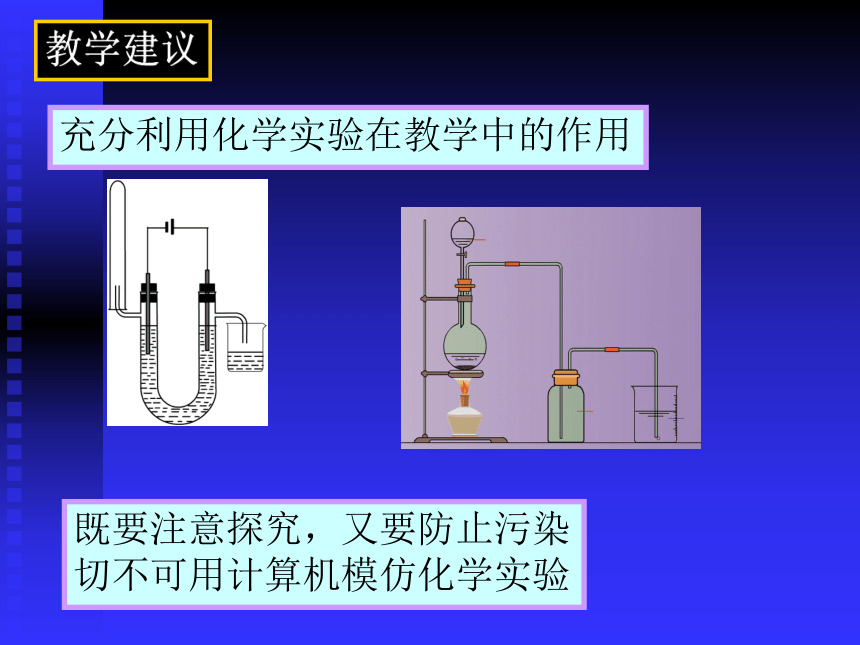
根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。 教学建议充分利用化学实验在教学中的作用既要注意探究,又要防止污染
切不可用计算机模仿化学实验关注元素化合物的重要性质及应用 元素化合物的知识不可穷尽,学生无需也不可能全部掌握。 Cl2与FeBr2的反应
碳酸钠、碳酸氢钠与盐酸反应速率的比较
镁与氮气等的反应
卤素互化物的反应等第一单元《氯、溴、碘及其化合物》第一课时:Cl2的工业制法,实验室制法及应用第二课时:Cl2的性质第三课时:溴、碘的提取课时建议教学目标了解海水晒盐的过程及氯化钠的用途;
掌握氯气的工业制法和实验室制法,了解氯气的用途;
通过引导学生观察实验,分析演示实验现象,培养学生观察和分析问题的能力。重点、难点氯气的工业制法和实验室制法第一课时强化重点、突破难点的做法课前准备:要求学生查阅相关资料,了解海水晒盐的过程和氯化钠的用途;了解氯气的用途。
问题一:工业上以氯化钠为原料是如何制取氯气的?
问题二:实验室用什么方法来制取氯气?小结:实验室制取氯气的原理____,装置_____。
分析气体发生装置选择原则
讨论 ①氯气的收集方法。
②氯气中可能混有何种杂质?如何除去?
③氯气有毒,尾气如何处理?作业:P54. 8 P36.交流与讨论教学目标了解氯气的物理性质,掌握氯气的化学性质;
通过引导学生观察、分析演示实验的现象和实验探究活动,培养学生的观察问题、分析问题和动手能力。重点、难点:氯气的化学性质第二课时强化重点、突破难点的做法演示教材P37实验1-5,学生观察分析现象,完成表2-2后相互交流补充。
组织学生完成教材P38探究实验1-4后,讨论:
①氯气能否与水反应?
②溶于水的氯气能否与水完全反应?
③氯水的成份?氯水中何种物质有漂白性?次氯酸为何有漂白性?其原理与活性炭漂白是否相同?次氯酸还有哪些性质?久置的氯水的成份是否会变化?
④漂白粉可应用于饮用水消毒,其原理是什么?
小结:1、氯气的物理性质:……
2、氯气的化学性质:……教学目标了解从海水中提取溴、碘的过程,了解溴、碘及其化合物的用途;
掌握氯、溴、碘间的置换反应;
学会用化合价的观点及电子转移的观点来理解氧化还原反应,会用“双线桥”分析氧化还原反应。
了解氧化剂、还原剂;氧化性、还原性;氧化产物、还原产物的概念。重点:用化合价及电子转移的观点来理解氧化还原反应第三课时难点:用化合价升降和电子转移的观点来分析氧化还原反应强化重点、突破难点的做法问题一:如何从海水和海洋生物中提取溴、碘?
问题二:从海水和海洋生物中提取溴、碘均用到了氯气,其作用是什么?
组织学生进行教材P41探究实验1、2,完成表2-3后小结:氯气可把溴化钾中溴离子,碘化钾中碘离子置换出来。指出:这就是提取溴和碘的原理。
引导学生分析: 2KBr + Cl2 = 2KCl + Br2
2KI + Cl2 = 2KCl + I2 2KI + Br2 = 2KBr + I2
反应前后元素价态的变化和电子转移情况,从而引出氧化还原反应的相关概念。如①氧化还原反应的定义、实质、特征、判断方法;②氧化剂、还原剂;氧化性、还原性;氧化产物、还原产物的概念;③如何“双线桥”表示氧化还原反应电子转移情况;④前强后弱的规律。作业:P42.交流与讨论 P42. 1、2、3、4、5第二单元《钠、镁及其化合物》第一课时:金属钠的性质和应用第二课时:碳酸钠的性质与应用第三课时:离子方程式课时建议第四课时:镁的提取与应用教学目标使学生认识钠是一种很活泼的金属,了解钠的物理性质,掌握钠的化学性质;
通过钠的有关性质实验以及对实验现象的讨论,培养学生的观察能力和思维能力。第一课时重点:从钠的原子结构特征认识钠的化学性质难点:对实验现象的观察和分析强化重点、突破难点的做法引入:由学生画出钠的原子结构示意图,分析原子 结构特点,设疑:钠原子最外层只有一个电子,决定了其在反应中发生什么变化?显示什么性质?具体体现在可与哪些物质反应?
演示教材P43实验1-3,引导学生观察现象,完成表2-4,思考P44问题3。
小结:钠的物理性质:……
钠的化学 性质:……强化重点、突破难点的做法 讨论:①钠的保存应注意什么问题?
②分析钠与盐酸反应的产物,写出方程式。
③分析钠与硫酸铜溶液反应的产物,讨论若把钠投到熔融硫酸铜中产物将发生什么变化?指出:工业上不采用此法冶炼铜由于钠的制取很困难(见P54拓展视野),而采用湿法炼铜成本低,操作简单。但对于稀有金属钛、锆、铌、钽等就用钠来
置换。如TiCl + 4Na Ti + 4NaCl700 -800℃教学目标了解碳酸钠、碳酸氢钠的性质,用途及鉴别方法。
了解侯氏制碱法的原理。重点:碳酸钠、碳酸氢钠的性质第二课时强化重点的做法课前准备:学生查阅相关资料,了解碳酸钠、碳酸氢钠的用途。
问题一:性质决定用途,碳酸钠的用途是由哪些性质决定的?
学生完成教材P45探究实验2、3、4、5后小结碳酸钠的化学性质:……
讨论:碳酸钠被称为“纯碱”的原因?
问题二:碳酸钠的用途如些之广,工业上又是如何制取的?
引导学生阅读相关内容后小结:侯氏制碱的方法:……原理:……
问题三:碳酸钠、碳酸氢钠均为钠盐,它们的性质有何不同?如何鉴别?
引导学生阅读教材P48相关内容后讨论:碳酸钠与碳酸氢钠的鉴别方法。碳酸氢钠如何转化为碳酸钠?教学目标了解电解质(强电解质、弱电解质)的含义;
使学生了解离子反应,掌握离子方程式的书写,离子反应发生的条件;重点:电解质的含义,离子方程式的书写。第三课时难点:离子方程式的书写引入:完成下列反应:
Na2CO3 + Ca(OH)2 —
Na2CO3 + CaCl2 —
Na2CO3 + HCl —
设疑:上述反应的实质是什么?
演示同浓度NaOH、NaCl、HCl、NH3·H2O、CH3COOH、蔗糖、酒精溶液的导电性实验,引出:
①
强化重点、突破难点的做法 ②电离方程式的书写
在学生书写碳酸钠、氯化钙、氯化钠电离方程式的基础上,分析碳酸钠与氢氧化钙溶液反应的实质为:
CO32-+ Ca2+ = CaCO3↓从而引出离子反应、离子方程式的书写问题。
在引导学生阅读教材P47相关内容后,完成P47问题解决2,分析碳酸钠与HCl,碳酸钠与Ca(OH)2反应的实质。
设疑:离子间反应需满足何种条件?
引导阅读教材P51相关内容后小结:溶液中离子反应的条件:……
强化重点、突破难点的做法作业:P51. 3、6 P53. 1 P54. 7 教学目标了解镁的提取过程及应用
掌握镁的性质重点:镁的性质第四课时强化重点的做法引导学生阅读教材P50有关从海水中提取镁的内容。强调两点:①MgCl2·6H2O必须在干燥的氯化氢的气流中加热才能得到氯化镁;②制取镁是熔融氯化镁,而不是氯化镁溶液。
引导学生完成教材P50观察和思考后小结:镁的性质,写出方程式,标出电子转移方向和数目。
讨论:Mg在反应中均显还原性,如何从结构上解释?作业:P51. 7 P54. 6、9
通过实验事实认识离子反应及其发生的条件,了解常见离子的检验方法。
根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。 教学建议充分利用化学实验在教学中的作用既要注意探究,又要防止污染
切不可用计算机模仿化学实验关注元素化合物的重要性质及应用 元素化合物的知识不可穷尽,学生无需也不可能全部掌握。 Cl2与FeBr2的反应
碳酸钠、碳酸氢钠与盐酸反应速率的比较
镁与氮气等的反应
卤素互化物的反应等第一单元《氯、溴、碘及其化合物》第一课时:Cl2的工业制法,实验室制法及应用第二课时:Cl2的性质第三课时:溴、碘的提取课时建议教学目标了解海水晒盐的过程及氯化钠的用途;
掌握氯气的工业制法和实验室制法,了解氯气的用途;
通过引导学生观察实验,分析演示实验现象,培养学生观察和分析问题的能力。重点、难点氯气的工业制法和实验室制法第一课时强化重点、突破难点的做法课前准备:要求学生查阅相关资料,了解海水晒盐的过程和氯化钠的用途;了解氯气的用途。
问题一:工业上以氯化钠为原料是如何制取氯气的?
问题二:实验室用什么方法来制取氯气?小结:实验室制取氯气的原理____,装置_____。
分析气体发生装置选择原则
讨论 ①氯气的收集方法。
②氯气中可能混有何种杂质?如何除去?
③氯气有毒,尾气如何处理?作业:P54. 8 P36.交流与讨论教学目标了解氯气的物理性质,掌握氯气的化学性质;
通过引导学生观察、分析演示实验的现象和实验探究活动,培养学生的观察问题、分析问题和动手能力。重点、难点:氯气的化学性质第二课时强化重点、突破难点的做法演示教材P37实验1-5,学生观察分析现象,完成表2-2后相互交流补充。
组织学生完成教材P38探究实验1-4后,讨论:
①氯气能否与水反应?
②溶于水的氯气能否与水完全反应?
③氯水的成份?氯水中何种物质有漂白性?次氯酸为何有漂白性?其原理与活性炭漂白是否相同?次氯酸还有哪些性质?久置的氯水的成份是否会变化?
④漂白粉可应用于饮用水消毒,其原理是什么?
小结:1、氯气的物理性质:……
2、氯气的化学性质:……教学目标了解从海水中提取溴、碘的过程,了解溴、碘及其化合物的用途;
掌握氯、溴、碘间的置换反应;
学会用化合价的观点及电子转移的观点来理解氧化还原反应,会用“双线桥”分析氧化还原反应。
了解氧化剂、还原剂;氧化性、还原性;氧化产物、还原产物的概念。重点:用化合价及电子转移的观点来理解氧化还原反应第三课时难点:用化合价升降和电子转移的观点来分析氧化还原反应强化重点、突破难点的做法问题一:如何从海水和海洋生物中提取溴、碘?
问题二:从海水和海洋生物中提取溴、碘均用到了氯气,其作用是什么?
组织学生进行教材P41探究实验1、2,完成表2-3后小结:氯气可把溴化钾中溴离子,碘化钾中碘离子置换出来。指出:这就是提取溴和碘的原理。
引导学生分析: 2KBr + Cl2 = 2KCl + Br2
2KI + Cl2 = 2KCl + I2 2KI + Br2 = 2KBr + I2
反应前后元素价态的变化和电子转移情况,从而引出氧化还原反应的相关概念。如①氧化还原反应的定义、实质、特征、判断方法;②氧化剂、还原剂;氧化性、还原性;氧化产物、还原产物的概念;③如何“双线桥”表示氧化还原反应电子转移情况;④前强后弱的规律。作业:P42.交流与讨论 P42. 1、2、3、4、5第二单元《钠、镁及其化合物》第一课时:金属钠的性质和应用第二课时:碳酸钠的性质与应用第三课时:离子方程式课时建议第四课时:镁的提取与应用教学目标使学生认识钠是一种很活泼的金属,了解钠的物理性质,掌握钠的化学性质;
通过钠的有关性质实验以及对实验现象的讨论,培养学生的观察能力和思维能力。第一课时重点:从钠的原子结构特征认识钠的化学性质难点:对实验现象的观察和分析强化重点、突破难点的做法引入:由学生画出钠的原子结构示意图,分析原子 结构特点,设疑:钠原子最外层只有一个电子,决定了其在反应中发生什么变化?显示什么性质?具体体现在可与哪些物质反应?
演示教材P43实验1-3,引导学生观察现象,完成表2-4,思考P44问题3。
小结:钠的物理性质:……
钠的化学 性质:……强化重点、突破难点的做法 讨论:①钠的保存应注意什么问题?
②分析钠与盐酸反应的产物,写出方程式。
③分析钠与硫酸铜溶液反应的产物,讨论若把钠投到熔融硫酸铜中产物将发生什么变化?指出:工业上不采用此法冶炼铜由于钠的制取很困难(见P54拓展视野),而采用湿法炼铜成本低,操作简单。但对于稀有金属钛、锆、铌、钽等就用钠来
置换。如TiCl + 4Na Ti + 4NaCl700 -800℃教学目标了解碳酸钠、碳酸氢钠的性质,用途及鉴别方法。
了解侯氏制碱法的原理。重点:碳酸钠、碳酸氢钠的性质第二课时强化重点的做法课前准备:学生查阅相关资料,了解碳酸钠、碳酸氢钠的用途。
问题一:性质决定用途,碳酸钠的用途是由哪些性质决定的?
学生完成教材P45探究实验2、3、4、5后小结碳酸钠的化学性质:……
讨论:碳酸钠被称为“纯碱”的原因?
问题二:碳酸钠的用途如些之广,工业上又是如何制取的?
引导学生阅读相关内容后小结:侯氏制碱的方法:……原理:……
问题三:碳酸钠、碳酸氢钠均为钠盐,它们的性质有何不同?如何鉴别?
引导学生阅读教材P48相关内容后讨论:碳酸钠与碳酸氢钠的鉴别方法。碳酸氢钠如何转化为碳酸钠?教学目标了解电解质(强电解质、弱电解质)的含义;
使学生了解离子反应,掌握离子方程式的书写,离子反应发生的条件;重点:电解质的含义,离子方程式的书写。第三课时难点:离子方程式的书写引入:完成下列反应:
Na2CO3 + Ca(OH)2 —
Na2CO3 + CaCl2 —
Na2CO3 + HCl —
设疑:上述反应的实质是什么?
演示同浓度NaOH、NaCl、HCl、NH3·H2O、CH3COOH、蔗糖、酒精溶液的导电性实验,引出:
①
强化重点、突破难点的做法 ②电离方程式的书写
在学生书写碳酸钠、氯化钙、氯化钠电离方程式的基础上,分析碳酸钠与氢氧化钙溶液反应的实质为:
CO32-+ Ca2+ = CaCO3↓从而引出离子反应、离子方程式的书写问题。
在引导学生阅读教材P47相关内容后,完成P47问题解决2,分析碳酸钠与HCl,碳酸钠与Ca(OH)2反应的实质。
设疑:离子间反应需满足何种条件?
引导阅读教材P51相关内容后小结:溶液中离子反应的条件:……
强化重点、突破难点的做法作业:P51. 3、6 P53. 1 P54. 7 教学目标了解镁的提取过程及应用
掌握镁的性质重点:镁的性质第四课时强化重点的做法引导学生阅读教材P50有关从海水中提取镁的内容。强调两点:①MgCl2·6H2O必须在干燥的氯化氢的气流中加热才能得到氯化镁;②制取镁是熔融氯化镁,而不是氯化镁溶液。
引导学生完成教材P50观察和思考后小结:镁的性质,写出方程式,标出电子转移方向和数目。
讨论:Mg在反应中均显还原性,如何从结构上解释?作业:P51. 7 P54. 6、9
