从海水中获得的化学物质 复习(浙江省温州市)
文档属性
| 名称 | 从海水中获得的化学物质 复习(浙江省温州市) |

|
|
| 格式 | rar | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-05-29 00:00:00 | ||
图片预览



文档简介
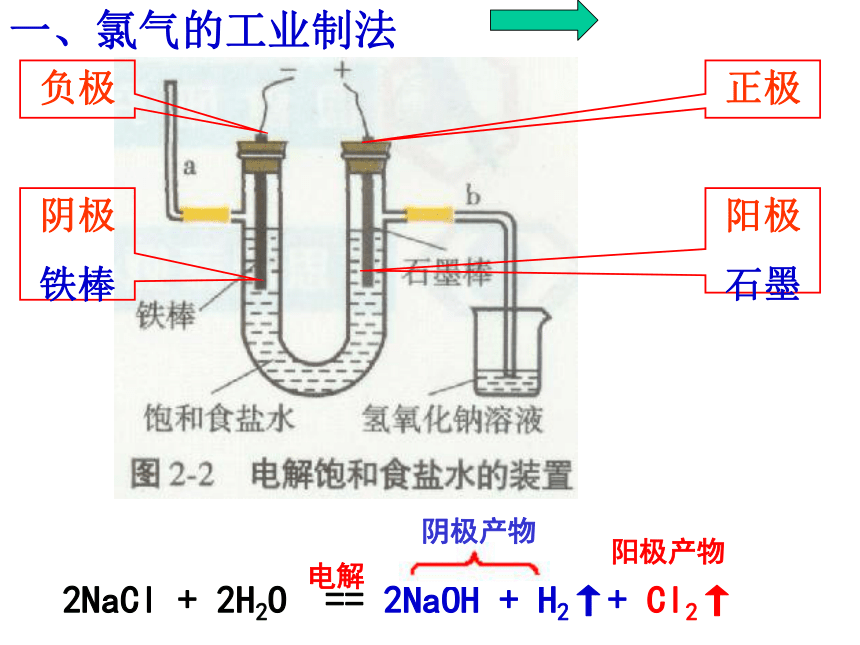
课件59张PPT。从海水中获得的化学物质第一单元 氯、溴、碘及其化合物专题2正极负极阴极
铁棒阳极
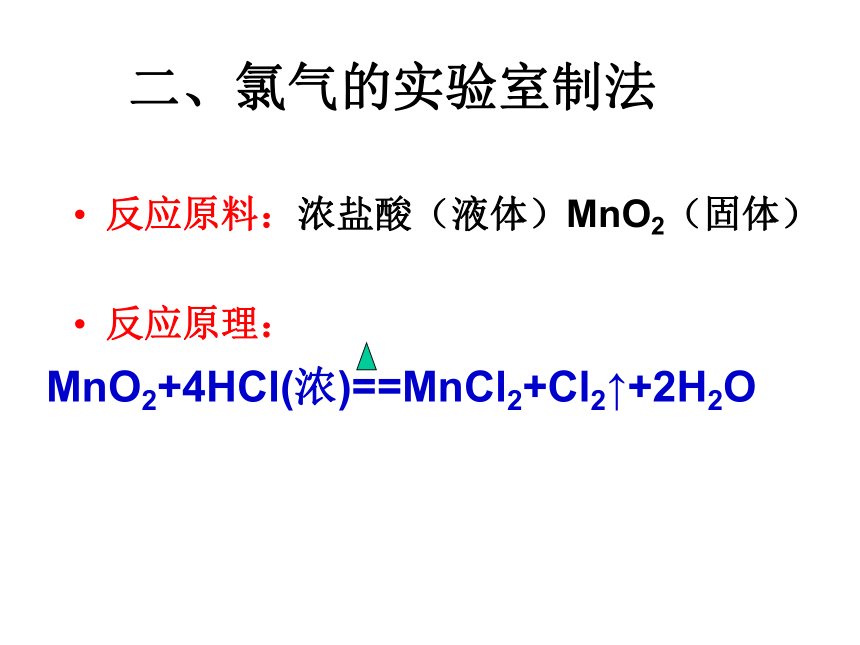
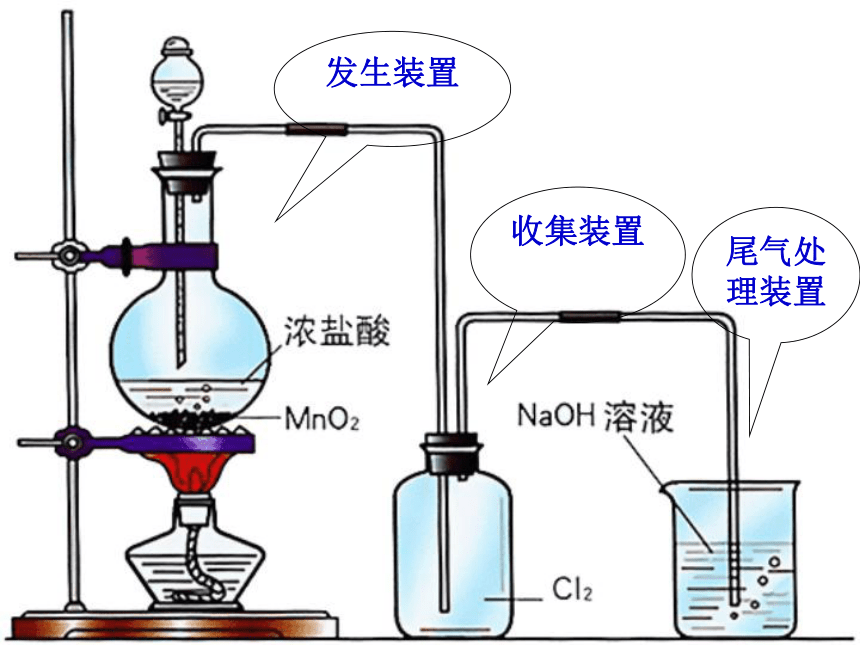
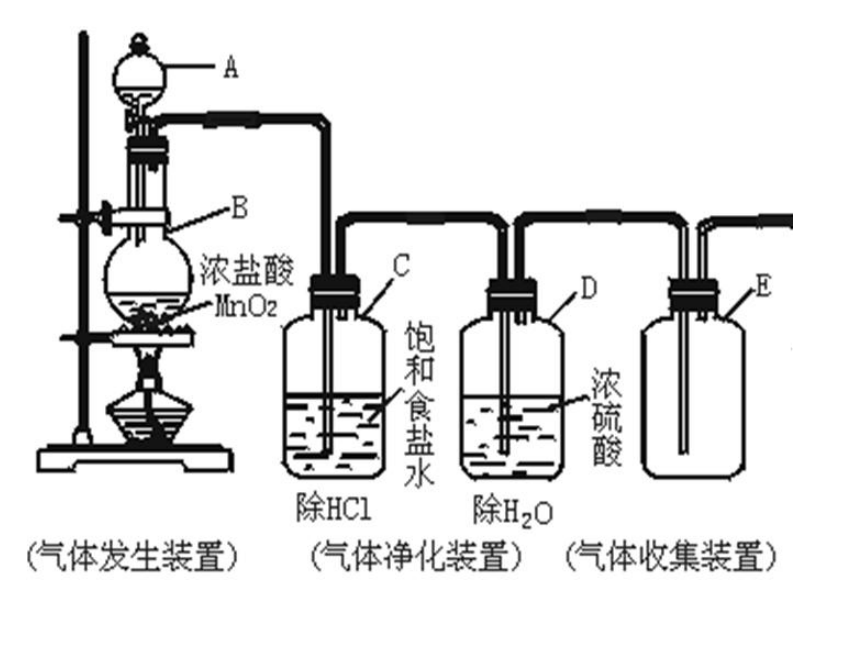
石墨一、氯气的工业制法阴极产物阳极产物二、氯气的实验室制法反应原料:浓盐酸(液体)MnO2(固体)
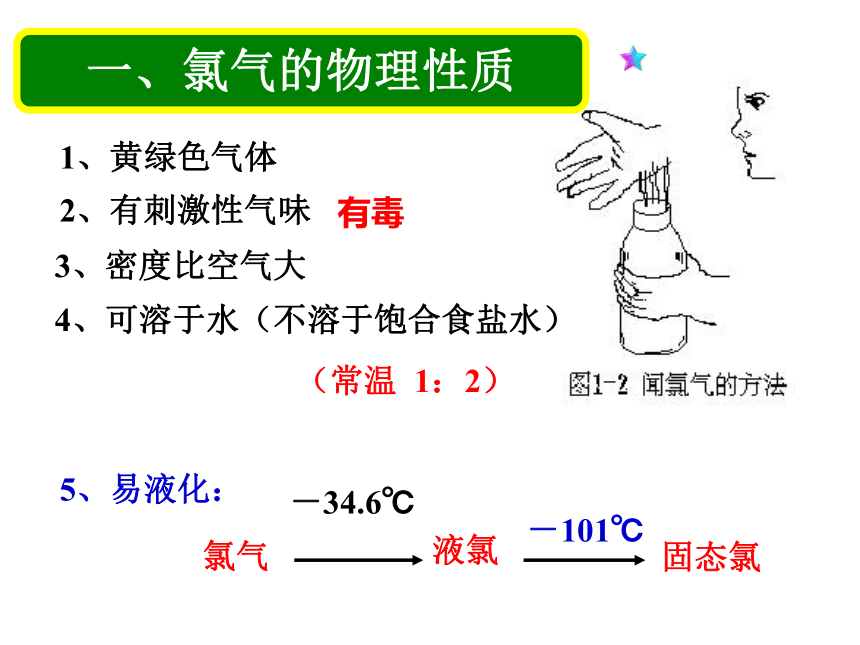
反应原理:发生装置收集装置尾气处理装置 三:氯气的性质1、黄绿色气体2、有刺激性气味有毒3、密度比空气大4、可溶于水(不溶于饱合食盐水)(常温 1:2)氯气液氯固态氯-34.6℃-101℃5、易液化:一、氯气的物理性质①钠与氯气的反应
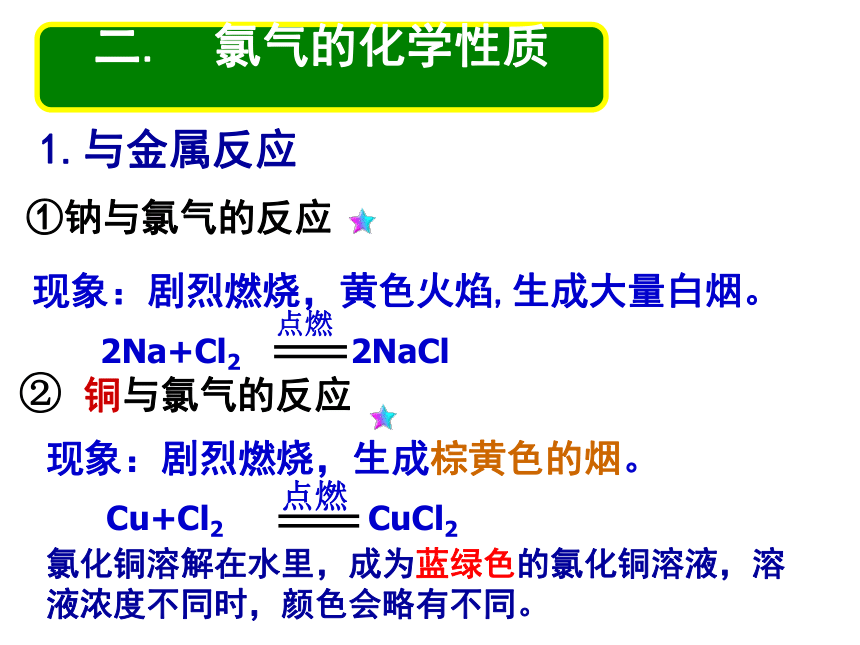
② 铜与氯气的反应现象:剧烈燃烧,黄色火焰,生成大量白烟。 现象:剧烈燃烧,生成棕黄色的烟。二. 氯气的化学性质
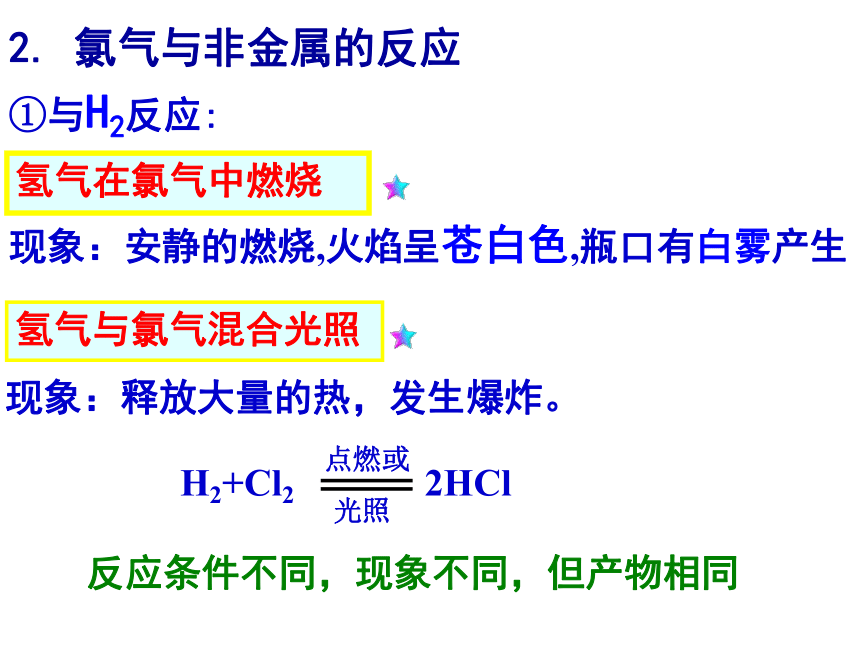
1.与金属反应氯化铜溶解在水里,成为蓝绿色的氯化铜溶液,溶液浓度不同时,颜色会略有不同。 事实证明,氯气可与大多数金属在点燃或加热的条件下直接化合,而且生成高价态金属氯化物。请写出Cl2与 Fe 在燃烧条件下的化学反应方程式 (先看实验)棕褐色的烟2. 氯气与非金属的反应现象:安静的燃烧,火焰呈苍白色,瓶口有白雾产生现象:释放大量的热,发生爆炸。氢气在氯气中燃烧氢气与氯气混合光照①与H2反应:反应条件不同,现象不同,但产物相同现象:产生了大量白色烟雾
2P + 3Cl2 2 PCl3
2P + 5Cl2 2 PCl5(固体)(液体)②磷在氯气中燃烧Cl2不足,产物为液态,现象:白雾
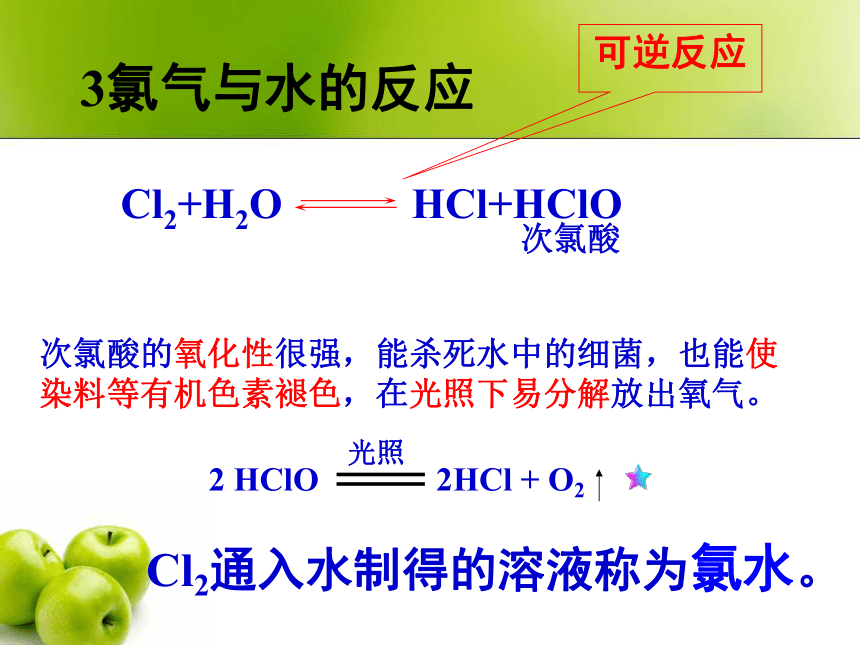
Cl2足量,产物为固态,现象:白烟3氯气与水的反应Cl2+H2O次氯酸的氧化性很强,能杀死水中的细菌,也能使染料等有机色素褪色,在光照下易分解放出氧气。
Cl2通入水制得的溶液称为氯水。HCl+HClO次氯酸可逆反应新制氯水中
含有微粒:久置氯水中
含有微粒:Cl2 、 H2O 、 HClO
H+ 、Cl ― 、 ClO ― 、 OH ― H2O
Cl ― 、 H+ 、 OH ―实际为盐酸新制氯水的主要成分:
Cl2、HCl、HClO、H2O小结Cl2 + 2NaOH =NaCl + NaClO + H2O2Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O ①氯气与NaOH反应4. 氯气与碱的反应 ②氯气与Ca(OH)2反应课本P43漂白粉的主要成分漂白粉的
有效成分Ca(ClO) 2+H2O+CO2==CaCO3 +2HClO
漂白粉的失效原理:Ca(ClO) 2+H2O+CO2==CaCO3 +2HClO漂白粉的漂白原理:
2HClO == 2HCl+O2
光照Ca(ClO) 2+2HCl==CaCl2+2HClO漂白粉的保存: 隔绝空气,密封保存1.制盐酸 — 4.制农药、制氯仿等含氯化合物Cl2与H2反应Cl2与Ca(OH)2反应--次氯酸的强氧化性3.制漂白粉—三、氯气的用途2.消毒剂、杀菌剂、漂白剂溴、碘的提取一、物理性质1.溴(Br2): ①深红棕色液体
②易挥发(刺激性气味,有毒)
③具有强的腐蚀性,会严重灼伤皮肤、橡胶
④在水中溶解度不大,易
溶于乙醇、CCl4、苯等
⑤ ρBr2 >ρH2O溴的蒸气红棕色2.碘(I2):①紫黑色晶体 ,有金属光泽
②易升华,蒸气为紫红色 刺激性(蒸气)
③在水中溶解度比溴还小,易溶于乙醇、CCl4、苯等
④淀粉遇碘单质变蓝(橙黄色) 二、Cl2 Br2 I2间的置换反应2KBr + Cl2 == 2KCl + Br2
2KI + Cl2 == 2KCl + I22KI + Br2 == 2KBr + I2氧化性比较:
Cl2 > Br2 > I2三、Cl-、 Br- 、 I-的鉴别生成不溶于稀硝酸的白色沉淀生成不溶于稀硝酸的淡黄色沉淀生成不溶于稀硝酸的黄色沉淀KCl + AgNO3 = AgCl + KNO3KBr + AgNO3 = AgBr + KNO3KI + AgNO3 = AgI + KNO3氧化还原反应议一议氧化还原反应分析2Na + Cl2 = 2NaCl0 0 +1 -1
反应物还原剂化合价升降电子转移反应类型升高失电子氧化反应降价得电子还原反应氧化剂物质本质特征同时发生本质定义:有电子发生转移的反应有电子转移的反应(或有化合价发生变化)2KBr + Cl2 == Br2 + 2KCl失去 2 x e-得到 2 x e-
氧化剂:含有元素化合价降低的物质还原剂:含有元素化合价升高的物质
升失氧还氧化剂、还原剂和氧化产物、还原产物的关系发生氧化反应发生还原反应氧化还原反应中的守恒:1.失去电子总数=得到电子总数2.化合价生高总数=化合价降低总数3.质量守恒3CO+Fe2O3==2Fe+3CO2
2KClO3==2KCl+3O2 ↑
Fe+H2SO4==FeSO4+H2 ↑△△MnO2——钠的性质及应用从海水中获得的化学物质一:电解熔融NaCl制取Na19世纪初科学家戴维的疑惑:
电解饱和食盐水得不到Na?
色 状:
硬 度:
密 度:
熔 点:
导电、传热性:
银白色,是有金属光泽的固体小,质软(可用刀切割)小(0.97g/cm3),比水小,比煤油大低( 97.81oC)良导体钠思考:金属钠断面颜色变暗,为什么?二、钠的物理性质(1)钠与氧气反应常温下,4Na + O2 = 2Na2O银白色的切面很快变成白色(白色固体)三、钠的化学性质加热:2Na + O2 == Na2O2 (淡黄色)Na2O2 中氧的化合价是-1,淡黄色粉末。过氧化钠的用途:和水,二氧化碳反应生成氧气。呼吸面具中、潜艇作供氧剂。具有氧化性,做漂白剂。过氧化钠介绍:2Na2O2+2H2O==4NaOH+O2↑
2Na2O2+2CO2==2Na2CO3+O2↑表:氧化钠与过氧化钠的比较—白色固体 淡黄色固体 -2价 -1价 常温 点燃 不稳定 稳定 Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 强氧化性、漂白性 供氧剂、漂白剂 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2(2)钠与其它非金属反应A:在氯气中燃烧: 2 Na + S = Na2S研磨 B:钠和硫粉研磨:(火星四射、发生爆炸)实验现象讨论2Na +2H2O == 2NaOH +H2↑3、钠与水反应制Na2O2TiCl4 + 4Na = Ti + 4NaCl700~800℃熔融碳酸钠的性质与应用一、碳酸钠的性质Na2CO3+Ca(OH)2=CaCO3↓+2NaOHNa2CO3+BaCl2=BaCO3↓+2NaCl2.与碱3.与盐1.与酸4、水溶液呈碱性 热碱去油污(一)物理性质
白色固体,易溶于水, 俗名:纯碱
(二)化学性质 二、碳酸钠与碳酸氢钠的转化 Na2CO3+CO2+H2O
=2NaHCO3碳酸钠和碳酸氢钠的比较P52 Na2CO3NaHCO3纯碱 苏打小苏打白色粉末白色晶体易溶于水比碳酸钠溶解度小慢快Na2CO3+2HCl=2NaCl+CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O较稳定不稳定三:Na2CO3和NaHCO3 的用途Na2CO3:玻璃、制皂、造纸、纺织
NaHCO3:发酵、治疗胃酸过多第二单元 钠、镁及其化合物专题2 从海水中获得的化学物质离子反应物
质混合物纯净物单质化合物电解质非电解质(如酸、碱、盐)(如蔗糖、酒精等)电解质:在水溶液中或者熔融状态下能导电的化合物。非电解质:无论在水溶液中还是在熔融状态下都不能导
电的化合物。复习:把化合物分成电解质与非电解质的根本标准是:一定条件下 。能否电离1、强电解质在水溶液中能完全电离的电解质。如:强酸(HCl、H2SO4、HNO3等)
强碱(NaOH、Ba(OH)2等)
绝大多数盐(NaCl、KNO3等)
一、强、弱电解质在溶液中完全以离子的形式存在 。2、弱电解质在水溶液中部分电离的电解质。
水溶液中离子和分子共存。如:弱酸(HF、H2S、HClO、CH3COOH等)
弱碱(NH3·H2O、 Fe(OH)3、Cu(OH)2等)
H2O一、强、弱电解质3、电离强电解质用等号,弱电解质用可逆符号。 如: HCl = H+ + Cl- 一、强、弱电解质(1)定义:电解质在水溶液中或熔融状态下产生
自由移动的离子的过程。NaOH = Na+ + OH-
NaCl = Na++Cl-CH3COOH H+ + CH3COO—
NH3·H2O NH4+ + OH—
需通电吗?(2)表示方法——电离方程式写出下列物质的电离方程式:Na2CO3 = 2Na++CO32-
Ca(OH)2 = Ca2++2OH-
HF H++F-
H2CO3 H+ + H CO3-多元弱酸分步电离,以第一步电离为主Na2CO3
Ca(OH)2
HF
H2CO31. 定义:用实际参加反应的离子符号表示离子反应的式子。 2. 离子方程式: 有离子参加的化学反应。
(用离子方程式表示)
Ca2++CO32-=CaCO3↓二、离子反应3.离子方程式的意义:①表示某一具体化学反应的实质。②表示同一类反应的离子方程式。 CuSO4溶液与BaCl2溶液进行离子反应
的实质是:SO42- + Ba2+ == BaSO4↓反应使溶液中的某些离子浓度减小。二、离子反应4、离子反应方程式书写步骤: (硝酸银溶液与氯化钠溶液反应)
⑴写⑵拆
AgNO3+ NaCl = AgCl + NaNO3Ag+ + NO3- + Na+ +Cl- = AgCl + Na+ + NO3-⑶删Ag+ +Cl- = AgCl ⑷查:检查方程式两边是否遵守质量守恒、电荷守恒
和得失电子守恒(将易溶于水、易电离的物质拆成离子形式)5.离子反应发生的条件:(1)生成难溶性物质(见课本溶解性表)
(2)生成难电离物质(弱酸、弱碱、水等)
(3)生成挥发性物质复分解反应型 氧化—还原型强氧化剂+强还原剂=弱氧化剂+弱还原剂 离子间的氧化还原反应:取决于氧化剂和还原剂的相对强弱,氧化剂和还原剂越强,离子反应越完全。 水溶液 ,有离子参加或生成反应 1.溶液中离子不能大量共存情况:
(1)离子间发生复分解反应
生成难溶物、挥发性物质、难电离物质
(2)离子间发生氧化还原反应等
同一溶液中若离子间会发生离子反应,
离子之间便不能在溶液中大量共存。二、离子共存问题练习:判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3-
② Ca2+ Na+ SO42- NO3-
③ H+ K+ Cl- OH-
④ NH4+ K+ OH- SO42-
⑤ SO42- K+ H+ HCO3-
⑥ Na+ K+ OH- HCO3-
⑦ K+ H+ I- MnO4- ① Ca2+ Na+ CO32- NO3- 生成难溶物 CaCO3 ② Ca2+ Na+ SO42- NO3- 生成微溶物 CaSO4
③ H+ K+ Cl- OH- 生成水
⑤ SO42- K+ H+ HCO3- 生成CO2 和H2O
⑥ Na+ K+ OH- HCO3- 生成CO32-和水
⑦ K+ H+ I- MnO4- MnO4- 能把 I-氧化 ④ NH4+ K+ OH- SO42- 生成 NH3 · H2O镁的提取及应用海水提取镁的工艺流程图二、从海水中提取镁的过程及原理:海水提镁的步骤: 贝壳(CaCO3)生石灰
(CaO)
石灰乳MgCl2·6H2OMgCl2MgMg(OH)2三、镁的物理性质:银白色的金属,镁的硬度较小,熔点较低,是热和电的良导体,质地柔软。四、镁的化学性质:5. 与水反应 Mg+2H2O=Mg(OH)2+H2↑6.与盐溶液反应(置换较不活泼的金属)五.镁的用途 1、镁合金(约含镁80%)被大量用于火箭、导弹
和飞机等制造业,美名为“国防金属”。2、镁元素能维护心肌纤维正常舒缩功能和冠状
动脉弹性,有“心脏保护神”的美称,镁还可以
用来制药。 3、镁可以用来制造导弹和焰火。 4、制耐火材料(MgO)熔点高。
铁棒阳极
石墨一、氯气的工业制法阴极产物阳极产物二、氯气的实验室制法反应原料:浓盐酸(液体)MnO2(固体)
反应原理:发生装置收集装置尾气处理装置 三:氯气的性质1、黄绿色气体2、有刺激性气味有毒3、密度比空气大4、可溶于水(不溶于饱合食盐水)(常温 1:2)氯气液氯固态氯-34.6℃-101℃5、易液化:一、氯气的物理性质①钠与氯气的反应
② 铜与氯气的反应现象:剧烈燃烧,黄色火焰,生成大量白烟。 现象:剧烈燃烧,生成棕黄色的烟。二. 氯气的化学性质
1.与金属反应氯化铜溶解在水里,成为蓝绿色的氯化铜溶液,溶液浓度不同时,颜色会略有不同。 事实证明,氯气可与大多数金属在点燃或加热的条件下直接化合,而且生成高价态金属氯化物。请写出Cl2与 Fe 在燃烧条件下的化学反应方程式 (先看实验)棕褐色的烟2. 氯气与非金属的反应现象:安静的燃烧,火焰呈苍白色,瓶口有白雾产生现象:释放大量的热,发生爆炸。氢气在氯气中燃烧氢气与氯气混合光照①与H2反应:反应条件不同,现象不同,但产物相同现象:产生了大量白色烟雾
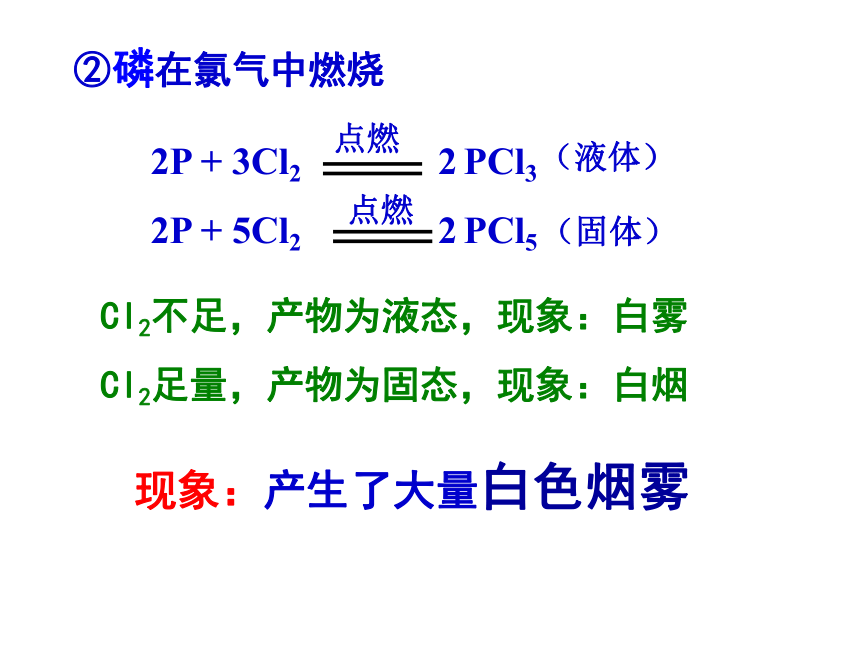
2P + 3Cl2 2 PCl3
2P + 5Cl2 2 PCl5(固体)(液体)②磷在氯气中燃烧Cl2不足,产物为液态,现象:白雾
Cl2足量,产物为固态,现象:白烟3氯气与水的反应Cl2+H2O次氯酸的氧化性很强,能杀死水中的细菌,也能使染料等有机色素褪色,在光照下易分解放出氧气。
Cl2通入水制得的溶液称为氯水。HCl+HClO次氯酸可逆反应新制氯水中
含有微粒:久置氯水中
含有微粒:Cl2 、 H2O 、 HClO
H+ 、Cl ― 、 ClO ― 、 OH ― H2O
Cl ― 、 H+ 、 OH ―实际为盐酸新制氯水的主要成分:
Cl2、HCl、HClO、H2O小结Cl2 + 2NaOH =NaCl + NaClO + H2O2Cl2 + 2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O ①氯气与NaOH反应4. 氯气与碱的反应 ②氯气与Ca(OH)2反应课本P43漂白粉的主要成分漂白粉的
有效成分Ca(ClO) 2+H2O+CO2==CaCO3 +2HClO
漂白粉的失效原理:Ca(ClO) 2+H2O+CO2==CaCO3 +2HClO漂白粉的漂白原理:
2HClO == 2HCl+O2
光照Ca(ClO) 2+2HCl==CaCl2+2HClO漂白粉的保存: 隔绝空气,密封保存1.制盐酸 — 4.制农药、制氯仿等含氯化合物Cl2与H2反应Cl2与Ca(OH)2反应--次氯酸的强氧化性3.制漂白粉—三、氯气的用途2.消毒剂、杀菌剂、漂白剂溴、碘的提取一、物理性质1.溴(Br2): ①深红棕色液体
②易挥发(刺激性气味,有毒)
③具有强的腐蚀性,会严重灼伤皮肤、橡胶
④在水中溶解度不大,易
溶于乙醇、CCl4、苯等
⑤ ρBr2 >ρH2O溴的蒸气红棕色2.碘(I2):①紫黑色晶体 ,有金属光泽
②易升华,蒸气为紫红色 刺激性(蒸气)
③在水中溶解度比溴还小,易溶于乙醇、CCl4、苯等
④淀粉遇碘单质变蓝(橙黄色) 二、Cl2 Br2 I2间的置换反应2KBr + Cl2 == 2KCl + Br2
2KI + Cl2 == 2KCl + I22KI + Br2 == 2KBr + I2氧化性比较:
Cl2 > Br2 > I2三、Cl-、 Br- 、 I-的鉴别生成不溶于稀硝酸的白色沉淀生成不溶于稀硝酸的淡黄色沉淀生成不溶于稀硝酸的黄色沉淀KCl + AgNO3 = AgCl + KNO3KBr + AgNO3 = AgBr + KNO3KI + AgNO3 = AgI + KNO3氧化还原反应议一议氧化还原反应分析2Na + Cl2 = 2NaCl0 0 +1 -1
反应物还原剂化合价升降电子转移反应类型升高失电子氧化反应降价得电子还原反应氧化剂物质本质特征同时发生本质定义:有电子发生转移的反应有电子转移的反应(或有化合价发生变化)2KBr + Cl2 == Br2 + 2KCl失去 2 x e-得到 2 x e-
氧化剂:含有元素化合价降低的物质还原剂:含有元素化合价升高的物质
升失氧还氧化剂、还原剂和氧化产物、还原产物的关系发生氧化反应发生还原反应氧化还原反应中的守恒:1.失去电子总数=得到电子总数2.化合价生高总数=化合价降低总数3.质量守恒3CO+Fe2O3==2Fe+3CO2
2KClO3==2KCl+3O2 ↑
Fe+H2SO4==FeSO4+H2 ↑△△MnO2——钠的性质及应用从海水中获得的化学物质一:电解熔融NaCl制取Na19世纪初科学家戴维的疑惑:
电解饱和食盐水得不到Na?
色 状:
硬 度:
密 度:
熔 点:
导电、传热性:
银白色,是有金属光泽的固体小,质软(可用刀切割)小(0.97g/cm3),比水小,比煤油大低( 97.81oC)良导体钠思考:金属钠断面颜色变暗,为什么?二、钠的物理性质(1)钠与氧气反应常温下,4Na + O2 = 2Na2O银白色的切面很快变成白色(白色固体)三、钠的化学性质加热:2Na + O2 == Na2O2 (淡黄色)Na2O2 中氧的化合价是-1,淡黄色粉末。过氧化钠的用途:和水,二氧化碳反应生成氧气。呼吸面具中、潜艇作供氧剂。具有氧化性,做漂白剂。过氧化钠介绍:2Na2O2+2H2O==4NaOH+O2↑
2Na2O2+2CO2==2Na2CO3+O2↑表:氧化钠与过氧化钠的比较—白色固体 淡黄色固体 -2价 -1价 常温 点燃 不稳定 稳定 Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 强氧化性、漂白性 供氧剂、漂白剂 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2(2)钠与其它非金属反应A:在氯气中燃烧: 2 Na + S = Na2S研磨 B:钠和硫粉研磨:(火星四射、发生爆炸)实验现象讨论2Na +2H2O == 2NaOH +H2↑3、钠与水反应制Na2O2TiCl4 + 4Na = Ti + 4NaCl700~800℃熔融碳酸钠的性质与应用一、碳酸钠的性质Na2CO3+Ca(OH)2=CaCO3↓+2NaOHNa2CO3+BaCl2=BaCO3↓+2NaCl2.与碱3.与盐1.与酸4、水溶液呈碱性 热碱去油污(一)物理性质
白色固体,易溶于水, 俗名:纯碱
(二)化学性质 二、碳酸钠与碳酸氢钠的转化 Na2CO3+CO2+H2O
=2NaHCO3碳酸钠和碳酸氢钠的比较P52 Na2CO3NaHCO3纯碱 苏打小苏打白色粉末白色晶体易溶于水比碳酸钠溶解度小慢快Na2CO3+2HCl=2NaCl+CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O较稳定不稳定三:Na2CO3和NaHCO3 的用途Na2CO3:玻璃、制皂、造纸、纺织
NaHCO3:发酵、治疗胃酸过多第二单元 钠、镁及其化合物专题2 从海水中获得的化学物质离子反应物
质混合物纯净物单质化合物电解质非电解质(如酸、碱、盐)(如蔗糖、酒精等)电解质:在水溶液中或者熔融状态下能导电的化合物。非电解质:无论在水溶液中还是在熔融状态下都不能导
电的化合物。复习:把化合物分成电解质与非电解质的根本标准是:一定条件下 。能否电离1、强电解质在水溶液中能完全电离的电解质。如:强酸(HCl、H2SO4、HNO3等)
强碱(NaOH、Ba(OH)2等)
绝大多数盐(NaCl、KNO3等)
一、强、弱电解质在溶液中完全以离子的形式存在 。2、弱电解质在水溶液中部分电离的电解质。
水溶液中离子和分子共存。如:弱酸(HF、H2S、HClO、CH3COOH等)
弱碱(NH3·H2O、 Fe(OH)3、Cu(OH)2等)
H2O一、强、弱电解质3、电离强电解质用等号,弱电解质用可逆符号。 如: HCl = H+ + Cl- 一、强、弱电解质(1)定义:电解质在水溶液中或熔融状态下产生
自由移动的离子的过程。NaOH = Na+ + OH-
NaCl = Na++Cl-CH3COOH H+ + CH3COO—
NH3·H2O NH4+ + OH—
需通电吗?(2)表示方法——电离方程式写出下列物质的电离方程式:Na2CO3 = 2Na++CO32-
Ca(OH)2 = Ca2++2OH-
HF H++F-
H2CO3 H+ + H CO3-多元弱酸分步电离,以第一步电离为主Na2CO3
Ca(OH)2
HF
H2CO31. 定义:用实际参加反应的离子符号表示离子反应的式子。 2. 离子方程式: 有离子参加的化学反应。
(用离子方程式表示)
Ca2++CO32-=CaCO3↓二、离子反应3.离子方程式的意义:①表示某一具体化学反应的实质。②表示同一类反应的离子方程式。 CuSO4溶液与BaCl2溶液进行离子反应
的实质是:SO42- + Ba2+ == BaSO4↓反应使溶液中的某些离子浓度减小。二、离子反应4、离子反应方程式书写步骤: (硝酸银溶液与氯化钠溶液反应)
⑴写⑵拆
AgNO3+ NaCl = AgCl + NaNO3Ag+ + NO3- + Na+ +Cl- = AgCl + Na+ + NO3-⑶删Ag+ +Cl- = AgCl ⑷查:检查方程式两边是否遵守质量守恒、电荷守恒
和得失电子守恒(将易溶于水、易电离的物质拆成离子形式)5.离子反应发生的条件:(1)生成难溶性物质(见课本溶解性表)
(2)生成难电离物质(弱酸、弱碱、水等)
(3)生成挥发性物质复分解反应型 氧化—还原型强氧化剂+强还原剂=弱氧化剂+弱还原剂 离子间的氧化还原反应:取决于氧化剂和还原剂的相对强弱,氧化剂和还原剂越强,离子反应越完全。 水溶液 ,有离子参加或生成反应 1.溶液中离子不能大量共存情况:
(1)离子间发生复分解反应
生成难溶物、挥发性物质、难电离物质
(2)离子间发生氧化还原反应等
同一溶液中若离子间会发生离子反应,
离子之间便不能在溶液中大量共存。二、离子共存问题练习:判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3-
② Ca2+ Na+ SO42- NO3-
③ H+ K+ Cl- OH-
④ NH4+ K+ OH- SO42-
⑤ SO42- K+ H+ HCO3-
⑥ Na+ K+ OH- HCO3-
⑦ K+ H+ I- MnO4- ① Ca2+ Na+ CO32- NO3- 生成难溶物 CaCO3 ② Ca2+ Na+ SO42- NO3- 生成微溶物 CaSO4
③ H+ K+ Cl- OH- 生成水
⑤ SO42- K+ H+ HCO3- 生成CO2 和H2O
⑥ Na+ K+ OH- HCO3- 生成CO32-和水
⑦ K+ H+ I- MnO4- MnO4- 能把 I-氧化 ④ NH4+ K+ OH- SO42- 生成 NH3 · H2O镁的提取及应用海水提取镁的工艺流程图二、从海水中提取镁的过程及原理:海水提镁的步骤: 贝壳(CaCO3)生石灰
(CaO)
石灰乳MgCl2·6H2OMgCl2MgMg(OH)2三、镁的物理性质:银白色的金属,镁的硬度较小,熔点较低,是热和电的良导体,质地柔软。四、镁的化学性质:5. 与水反应 Mg+2H2O=Mg(OH)2+H2↑6.与盐溶液反应(置换较不活泼的金属)五.镁的用途 1、镁合金(约含镁80%)被大量用于火箭、导弹
和飞机等制造业,美名为“国防金属”。2、镁元素能维护心肌纤维正常舒缩功能和冠状
动脉弹性,有“心脏保护神”的美称,镁还可以
用来制药。 3、镁可以用来制造导弹和焰火。 4、制耐火材料(MgO)熔点高。
