无机非金属材料的主角(广东省广州市黄埔区)
文档属性
| 名称 | 无机非金属材料的主角(广东省广州市黄埔区) |

|
|
| 格式 | rar | ||
| 文件大小 | 845.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-06-01 00:00:00 | ||
图片预览








文档简介
课件39张PPT。第一 、二课时广州市第91中学化学科 袁平
第四章第一节无机非金属材料的
主角—硅(1、2)
第一课时教学目标:
1 、了解硅元素在自然界中的存在和含量
2 、通过硅元素的位置与结构认识硅及其化
合物的性质,进行结构决定性质的理论体验
3、掌握二氧化硅的结构、性质和硅酸制取
原理和性质以及硅胶的用途
4、通过元素周期律同主族性质相似性和递变
性规律,探究硅酸的酸性比碳酸弱的实验事实
通过下列图片你能总结归纳出硅元素在自然界中的存在吗?观察与思考1.自然界硅元素主要存在于:岩石、沙子和土壤2.地壳中的含量:排在第二位,氧的后面.3.自然界硅存在的形态 :硅无游离态单质状态
只有化合态:常常有硅的氧化物和硅酸盐(一)硅元素在自然界中存在和含量思考:碳和硅在自然界中存在形式有
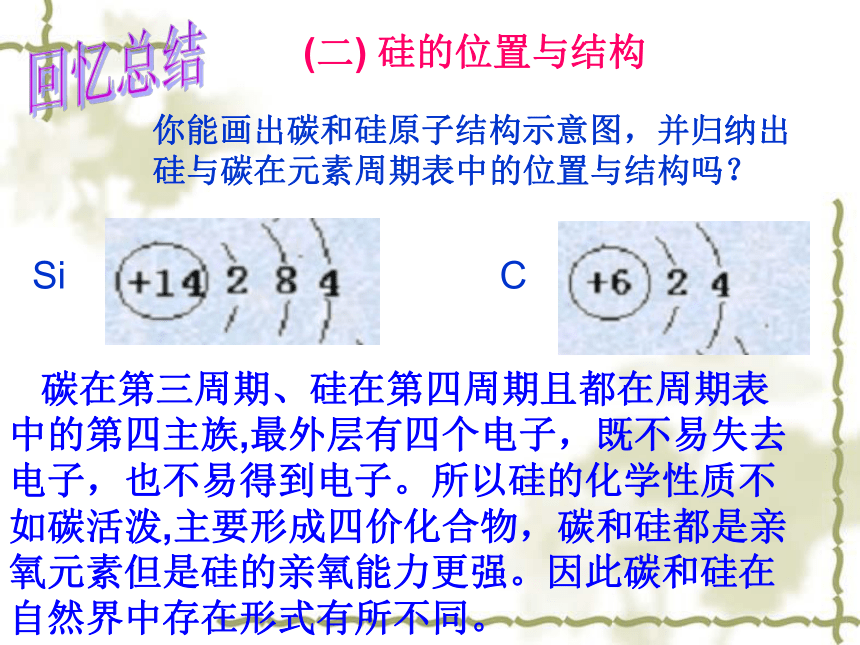
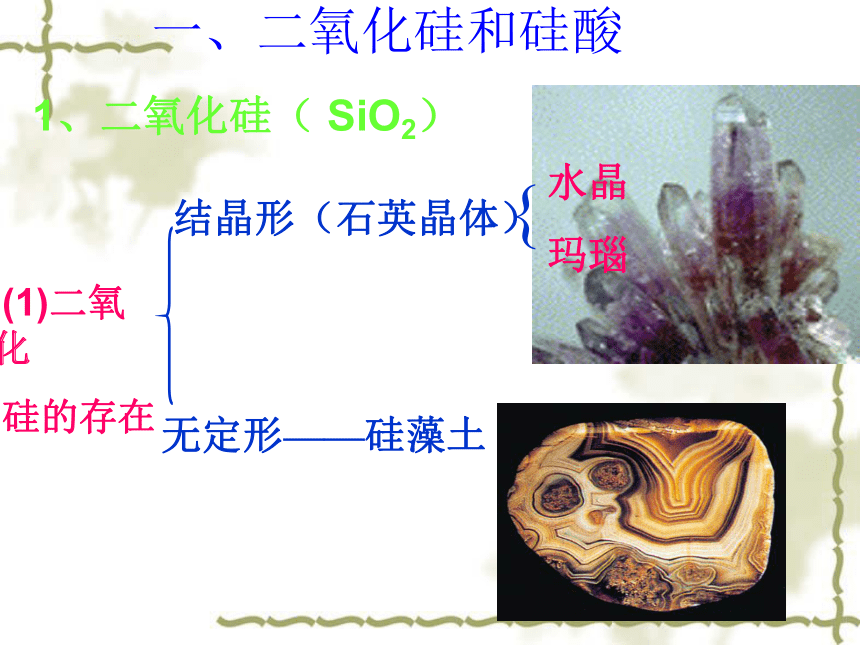
所不同的原因是什么? 你能画出碳和硅原子结构示意图,并归纳出硅与碳在元素周期表中的位置与结构吗?回忆总结(二) 硅的位置与结构 碳在第三周期、硅在第四周期且都在周期表中的第四主族,最外层有四个电子,既不易失去电子,也不易得到电子。所以硅的化学性质不如碳活泼,主要形成四价化合物,碳和硅都是亲氧元素但是硅的亲氧能力更强。因此碳和硅在自然界中存在形式有所不同。CSi一、二氧化硅和硅酸1、二氧化硅( SiO2) (1)二氧化
硅的存在 结晶形(石英晶体)
无定形——硅藻土
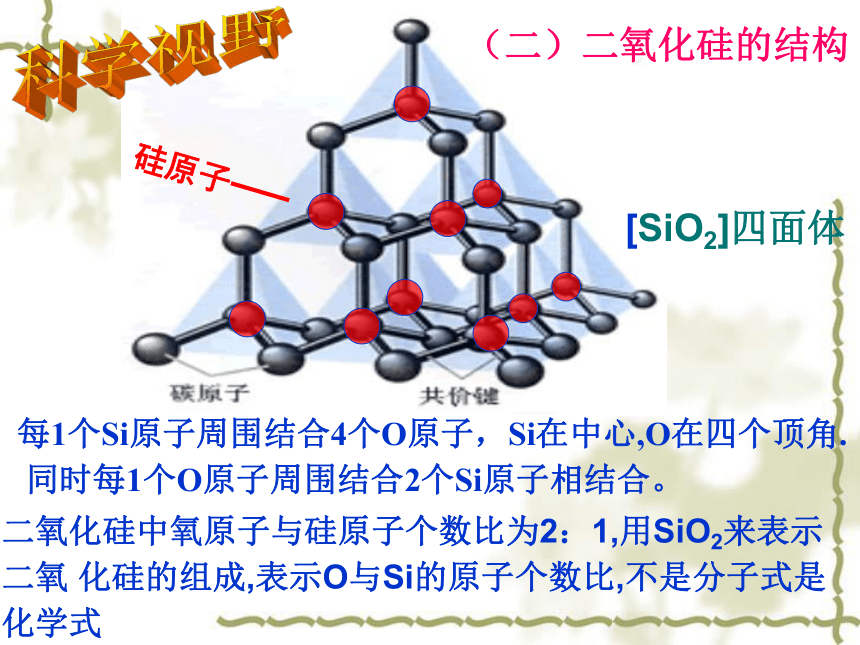
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角.
同时每1个O原子周围结合2个Si原子相结合。
硅原子——[SiO2]四面体二氧化硅中氧原子与硅原子个数比为2:1,用SiO2来表示
二氧 化硅的组成,表示O与Si的原子个数比,不是分子式是化学式科学视野(二)二氧化硅的结构猜一猜 根据上述二氧化硅的结构及学过的二氧化碳的性
质你能否判断其有何物理和化学性质及用途呢?主要用作装饰、石英坩埚、光纤、光缆现代通信用光缆光学纤维胃镜用光导纤维做
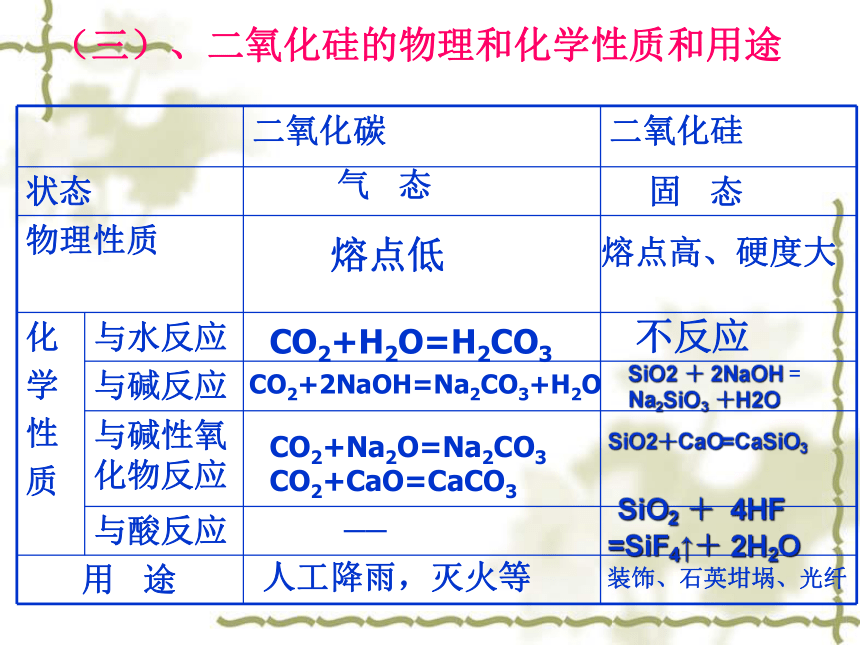
无开刀手术光导纤维手术头灯CO2+H2O=H2CO3CO2+2NaOH=Na2CO3+H2OCO2+Na2O=Na2CO3CO2+CaO=CaCO3不反应SiO2 + 2NaOH = Na2SiO3 +H2OSiO2+CaO=CaSiO3
固 态熔点低气 态熔点高、硬度大—— SiO2 + 4HF
=SiF4↑+ 2H2O 人工降雨,灭火等 装饰、石英坩埚、光纤(三)、二氧化硅的物理和化学性质和用途1、实验室盛装NaOH
溶液的试剂瓶为什么
用橡胶塞而不用玻璃塞? NaOH溶液能与玻璃中的SiO2反应生成
Na2SiO3,使瓶塞部分粘结而无法打开。因此盛装
NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O想一想图 4-6 实验室盛放
NaOH溶液的试剂瓶3、某同学根据SiO2既可与碱反应,也能与氢氟酸反
应,由此推断SiO2为两性氧化物.是否正确?动动脑筋2、实验室为什么不用玻璃瓶盛装氢氟酸? HF能腐蚀玻璃,因此,盛装氢氟酸不 能用
玻璃试剂瓶而要用塑料瓶。
SiO2 + 4HF =SiF4↑+ 2H2O 此反应常用于雕刻玻璃 不正确。因为二氧化硅只跟氢氟酸反应,不跟
其它酸反应,而是属于酸性氧化物。想一想:怎样设计实验制取H2SiO3呢? 2、硅酸 (H2SiO3) 温馨提示:CO2+H2O=H2CO3 ,但是SiO2不能与水直接
化合成H2SiO3。(1)性质: 硅酸是一种白色固体,溶解度很小,而且是一种
弱酸,酸性比H2CO3还弱。
(2)制备: 制取原理:强酸制弱酸滴入酚酞后溶液变为红色,再滴入稀盐酸,溶液红色变浅至无色,同时有白色胶状沉淀产生 a、Na2SiO3溶液呈碱性,b、可溶性硅酸盐与盐酸反应生成不溶于水的硅酸,c、先形成硅酸溶胶,后形成硅酸凝胶,d、静置则形成硅酸沉淀。阅读课本P65并
探究实验4-1Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓SiO32- + 2H+ == H2SiO3↓ 生成的硅酸逐渐聚合而形成硅酸溶胶,经干
燥脱水就形成硅酸干胶,称为“硅胶”。常常用
做干燥剂。(3)用途SiO32- + H2O + CO2== CO32- + H2SiO3↓Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓ 想一想用什么实验事实能够证明
硅酸的酸性比碳酸弱? 向可溶性硅酸盐溶液中通入二氧化碳气体,出现
白色浑浊,即用H2CO3可制得H2SiO3 ,可证明
H2SiO3 的酸性比H2CO3弱。(强酸制弱酸)课堂练习1.地壳中含量第一和第二的两种元素所形成的化
合物不具有的性质是( )
A.熔点很高 B.与水反应生成对应的酸
C.可与烧碱反应生成盐 D.坚硬
B3、下列试剂能贮存在磨口玻璃塞的试剂瓶里的是
( )
A.HF溶液 B.KOH溶液 C.盐酸 D.水玻璃C2.要除去SiO2中混有的少量CaO杂质,最适宜
的试剂是( )
A.纯碱溶液 B.盐酸 C.硫酸 D.苛性钠溶液
A 4.能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出
C.高温下SiO2与碳酸盐 反应生成CO2
D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性
硅酸盐溶液中生成硅酸沉淀B5.能将Na2SiO3、CaCO3、SiO2三种白色粉末
鉴别开来的试剂是( )
A.NaOH溶液 B.水 C.氢氟酸 D.稀盐酸C6.下列物质的变化,不能通过一步化学反应完成的
是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3
C.Na2O→Na2CO3 D.SiO2→H2SiO3
D小结:
1.介绍了硅元素在自然界中的存在和含量,从
硅元素的位置与结构推知其亲氧性存在的两种
化合物———二氧化硅和硅酸。
2.二氧化硅的结构和性质
3.硅酸制取原理和性质和硅胶的用途
4.硅酸的酸性比碳酸弱的实验事实
作业: 课本P691.2
第二课时教学目标:
1、了解硅酸盐的定义、性质和表示方法及常
见的工业产品
2、掌握硅酸钠的性质和用途并理解其水溶液
久置在空气中会出现白色浑浊的原因。
4、通过硅在元素周期表中的特殊位置了解硅
单质性质和用途工业制备
二、硅酸盐1、定义:硅酸盐是由硅、氧、金属元素组成的化合物的总称 2、性质:硅酸盐种类很多,大多数难溶于水,最常见的
可溶性硅酸盐是Na2SiO3,Ka2SiO33、表示方法:(1)化学式法: 适用于简单的硅酸盐如:Na2SiO3,K2SiO3、
CaSiO3等。活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。氧
化物前系数配置原则:除氧元素外,其他元素按配置前后
原子个数守恒原则配置系数。硅酸钠:Na2SiO3
Na2O·SiO2 硅酸钙:CaSiO3 CaO·SiO2
高岭石:Al2(Si2O5)(OH)4 Al2O3·2SiO2·2H2O
正长石:KAlSiO3不能写成 K2O· Al2O3·3SiO2,
应写成K2O·Al2O3·6SiO2(2)氧化物法:资料卡片4、硅酸盐在自然界的转化 硅酸盐矿石长期受到空气中的二氧化碳和水的
侵蚀后,逐渐风化分解,生成的可溶物质随雨水流入
江河、海洋,留下大量的黏土形成土壤胶体,因其
表面巨大且一般带负电,能吸收NH4+,K等营养
离子,从而具有保肥能力。硅酸盐是如何具有保肥能力的?思考5、硅酸钠(Na2SiO3) 硅酸钠是白色固体,易溶于水,其水溶液俗称
水玻璃,又称泡花碱,是一种无色粘稠的液体,是
一种矿物胶,黏性很强,可以作黏胶剂和木材防火
剂。 (1)、硅酸钠的物理性质水分蒸干后不燃烧水分蒸发后燃烧水不能防火硅酸钠溶液能防火阅读课本P65并
探究实验4-2问一问硅酸钠水溶液久置在空气中会出现什
么现象?为什么?
硅酸钠水溶液久置在空气中会出现白色浑浊。因
为发生下列反应:(2)、硅酸钠化学性质 硅酸钠的化学性质相对稳定,不能燃烧,
不易被腐蚀,热稳定性好。Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓(3)、用途可以作肥皂填料,还可以用做建筑、纸张的
黏合剂和木材、织物的防腐剂及防火剂②与某些盐反应①与酸反应Na2SiO3 + 2HCl =2NaCl + H2SiO3↓CaCl2+Na2SiO3=CaSiO3+2NaCl看一看你能指出常见的硅酸盐产品有哪些吗 5、硅酸盐工业产品传统硅酸盐工业三大产品有:玻璃、陶瓷、水泥。[练习]1.下列说法正确的是( )
A.陶瓷、玻璃、水泥都是硅酸盐产品
B.水晶、玛瑙、光纤、硅胶的主要成分都是SiO2
C.SiO2很稳定,与所有的酸都不反应
D.将石棉(CaMg3Si4O12)化学式改写成氧化物
的形式:3(MgO·CaO)·4SiO2
A科学视野新型陶瓷人造关节高压钠灯高温结构陶瓷 1.氧化铝陶瓷陶瓷机械零件三、硅单质(Si)2、物理性质:有金属光泽的灰黑色固体,熔点 高,硬度大。1、存在形式{晶体硅无定形硅你能根据硅的原子结构推测硅单质可能具有的化
学性质②在高温条件下,单质硅能与O2和Cl2等非金属
单质反应。①常温下化学性质不活泼,只能跟F2、HF和
NaOH溶液反应。Si+2F2=SiF4 Si+4HF=SiF4↑+2H2↑ Si+2NaOH+H2O=Na2SiO3+2H2↑Si+O2 SiO2
3、化学性质工业上,用焦炭在高温下还原石英砂可制得粗硅
SiO2+2C=Si(粗)+2CO↑ ① ,又能跟氯气反应经提纯得到 SiCl4后再用氢气还原制得纯硅:Si(粗)+2Cl2=SiCl4 ② ,SiCl4+2H2=Si(纯)+4HCl③。根据以上反应回答下列问题:
(1)反应①中焦炭做( )
A.还原剂 B.氧化剂 C.二者都不是
(2)反应 ②属于( ),反应③ 属于( )
A.化合反应 B.分解反应 C.氧化还原反应
D.非氧化还原反应 E.置换反应4、硅的工业制备做一做AAE5、用途:太阳能电池、计算机芯片以及半导体材料信息技术等材料和人造卫星、登月车、火星探测器等动力设备新能源。硅太阳能电池观看下列图片总结单质硅的用途硅芯片是各种计算机、
微电子产品的核心
小结:
1.介绍了硅酸盐的定义、性质和表示方法及工业产品.
2.硅酸钠的性质和用途
3.硅单质的存在形式、性质、工业制备和用途
4.硅酸钠水溶液久置在空气中会出现白色浑浊的原因。
作业:
课本P69 3、4
第四章第一节无机非金属材料的
主角—硅(1、2)
第一课时教学目标:
1 、了解硅元素在自然界中的存在和含量
2 、通过硅元素的位置与结构认识硅及其化
合物的性质,进行结构决定性质的理论体验
3、掌握二氧化硅的结构、性质和硅酸制取
原理和性质以及硅胶的用途
4、通过元素周期律同主族性质相似性和递变
性规律,探究硅酸的酸性比碳酸弱的实验事实
通过下列图片你能总结归纳出硅元素在自然界中的存在吗?观察与思考1.自然界硅元素主要存在于:岩石、沙子和土壤2.地壳中的含量:排在第二位,氧的后面.3.自然界硅存在的形态 :硅无游离态单质状态
只有化合态:常常有硅的氧化物和硅酸盐(一)硅元素在自然界中存在和含量思考:碳和硅在自然界中存在形式有
所不同的原因是什么? 你能画出碳和硅原子结构示意图,并归纳出硅与碳在元素周期表中的位置与结构吗?回忆总结(二) 硅的位置与结构 碳在第三周期、硅在第四周期且都在周期表中的第四主族,最外层有四个电子,既不易失去电子,也不易得到电子。所以硅的化学性质不如碳活泼,主要形成四价化合物,碳和硅都是亲氧元素但是硅的亲氧能力更强。因此碳和硅在自然界中存在形式有所不同。CSi一、二氧化硅和硅酸1、二氧化硅( SiO2) (1)二氧化
硅的存在 结晶形(石英晶体)
无定形——硅藻土
每1个Si原子周围结合4个O原子,Si在中心,O在四个顶角.
同时每1个O原子周围结合2个Si原子相结合。
硅原子——[SiO2]四面体二氧化硅中氧原子与硅原子个数比为2:1,用SiO2来表示
二氧 化硅的组成,表示O与Si的原子个数比,不是分子式是化学式科学视野(二)二氧化硅的结构猜一猜 根据上述二氧化硅的结构及学过的二氧化碳的性
质你能否判断其有何物理和化学性质及用途呢?主要用作装饰、石英坩埚、光纤、光缆现代通信用光缆光学纤维胃镜用光导纤维做
无开刀手术光导纤维手术头灯CO2+H2O=H2CO3CO2+2NaOH=Na2CO3+H2OCO2+Na2O=Na2CO3CO2+CaO=CaCO3不反应SiO2 + 2NaOH = Na2SiO3 +H2OSiO2+CaO=CaSiO3
固 态熔点低气 态熔点高、硬度大—— SiO2 + 4HF
=SiF4↑+ 2H2O 人工降雨,灭火等 装饰、石英坩埚、光纤(三)、二氧化硅的物理和化学性质和用途1、实验室盛装NaOH
溶液的试剂瓶为什么
用橡胶塞而不用玻璃塞? NaOH溶液能与玻璃中的SiO2反应生成
Na2SiO3,使瓶塞部分粘结而无法打开。因此盛装
NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O想一想图 4-6 实验室盛放
NaOH溶液的试剂瓶3、某同学根据SiO2既可与碱反应,也能与氢氟酸反
应,由此推断SiO2为两性氧化物.是否正确?动动脑筋2、实验室为什么不用玻璃瓶盛装氢氟酸? HF能腐蚀玻璃,因此,盛装氢氟酸不 能用
玻璃试剂瓶而要用塑料瓶。
SiO2 + 4HF =SiF4↑+ 2H2O 此反应常用于雕刻玻璃 不正确。因为二氧化硅只跟氢氟酸反应,不跟
其它酸反应,而是属于酸性氧化物。想一想:怎样设计实验制取H2SiO3呢? 2、硅酸 (H2SiO3) 温馨提示:CO2+H2O=H2CO3 ,但是SiO2不能与水直接
化合成H2SiO3。(1)性质: 硅酸是一种白色固体,溶解度很小,而且是一种
弱酸,酸性比H2CO3还弱。
(2)制备: 制取原理:强酸制弱酸滴入酚酞后溶液变为红色,再滴入稀盐酸,溶液红色变浅至无色,同时有白色胶状沉淀产生 a、Na2SiO3溶液呈碱性,b、可溶性硅酸盐与盐酸反应生成不溶于水的硅酸,c、先形成硅酸溶胶,后形成硅酸凝胶,d、静置则形成硅酸沉淀。阅读课本P65并
探究实验4-1Na2SiO3 + 2HCl == 2NaCl + H2SiO3↓SiO32- + 2H+ == H2SiO3↓ 生成的硅酸逐渐聚合而形成硅酸溶胶,经干
燥脱水就形成硅酸干胶,称为“硅胶”。常常用
做干燥剂。(3)用途SiO32- + H2O + CO2== CO32- + H2SiO3↓Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓ 想一想用什么实验事实能够证明
硅酸的酸性比碳酸弱? 向可溶性硅酸盐溶液中通入二氧化碳气体,出现
白色浑浊,即用H2CO3可制得H2SiO3 ,可证明
H2SiO3 的酸性比H2CO3弱。(强酸制弱酸)课堂练习1.地壳中含量第一和第二的两种元素所形成的化
合物不具有的性质是( )
A.熔点很高 B.与水反应生成对应的酸
C.可与烧碱反应生成盐 D.坚硬
B3、下列试剂能贮存在磨口玻璃塞的试剂瓶里的是
( )
A.HF溶液 B.KOH溶液 C.盐酸 D.水玻璃C2.要除去SiO2中混有的少量CaO杂质,最适宜
的试剂是( )
A.纯碱溶液 B.盐酸 C.硫酸 D.苛性钠溶液
A 4.能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出
C.高温下SiO2与碳酸盐 反应生成CO2
D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性
硅酸盐溶液中生成硅酸沉淀B5.能将Na2SiO3、CaCO3、SiO2三种白色粉末
鉴别开来的试剂是( )
A.NaOH溶液 B.水 C.氢氟酸 D.稀盐酸C6.下列物质的变化,不能通过一步化学反应完成的
是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3
C.Na2O→Na2CO3 D.SiO2→H2SiO3
D小结:
1.介绍了硅元素在自然界中的存在和含量,从
硅元素的位置与结构推知其亲氧性存在的两种
化合物———二氧化硅和硅酸。
2.二氧化硅的结构和性质
3.硅酸制取原理和性质和硅胶的用途
4.硅酸的酸性比碳酸弱的实验事实
作业: 课本P691.2
第二课时教学目标:
1、了解硅酸盐的定义、性质和表示方法及常
见的工业产品
2、掌握硅酸钠的性质和用途并理解其水溶液
久置在空气中会出现白色浑浊的原因。
4、通过硅在元素周期表中的特殊位置了解硅
单质性质和用途工业制备
二、硅酸盐1、定义:硅酸盐是由硅、氧、金属元素组成的化合物的总称 2、性质:硅酸盐种类很多,大多数难溶于水,最常见的
可溶性硅酸盐是Na2SiO3,Ka2SiO33、表示方法:(1)化学式法: 适用于简单的硅酸盐如:Na2SiO3,K2SiO3、
CaSiO3等。活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。氧
化物前系数配置原则:除氧元素外,其他元素按配置前后
原子个数守恒原则配置系数。硅酸钠:Na2SiO3
Na2O·SiO2 硅酸钙:CaSiO3 CaO·SiO2
高岭石:Al2(Si2O5)(OH)4 Al2O3·2SiO2·2H2O
正长石:KAlSiO3不能写成 K2O· Al2O3·3SiO2,
应写成K2O·Al2O3·6SiO2(2)氧化物法:资料卡片4、硅酸盐在自然界的转化 硅酸盐矿石长期受到空气中的二氧化碳和水的
侵蚀后,逐渐风化分解,生成的可溶物质随雨水流入
江河、海洋,留下大量的黏土形成土壤胶体,因其
表面巨大且一般带负电,能吸收NH4+,K等营养
离子,从而具有保肥能力。硅酸盐是如何具有保肥能力的?思考5、硅酸钠(Na2SiO3) 硅酸钠是白色固体,易溶于水,其水溶液俗称
水玻璃,又称泡花碱,是一种无色粘稠的液体,是
一种矿物胶,黏性很强,可以作黏胶剂和木材防火
剂。 (1)、硅酸钠的物理性质水分蒸干后不燃烧水分蒸发后燃烧水不能防火硅酸钠溶液能防火阅读课本P65并
探究实验4-2问一问硅酸钠水溶液久置在空气中会出现什
么现象?为什么?
硅酸钠水溶液久置在空气中会出现白色浑浊。因
为发生下列反应:(2)、硅酸钠化学性质 硅酸钠的化学性质相对稳定,不能燃烧,
不易被腐蚀,热稳定性好。Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓(3)、用途可以作肥皂填料,还可以用做建筑、纸张的
黏合剂和木材、织物的防腐剂及防火剂②与某些盐反应①与酸反应Na2SiO3 + 2HCl =2NaCl + H2SiO3↓CaCl2+Na2SiO3=CaSiO3+2NaCl看一看你能指出常见的硅酸盐产品有哪些吗 5、硅酸盐工业产品传统硅酸盐工业三大产品有:玻璃、陶瓷、水泥。[练习]1.下列说法正确的是( )
A.陶瓷、玻璃、水泥都是硅酸盐产品
B.水晶、玛瑙、光纤、硅胶的主要成分都是SiO2
C.SiO2很稳定,与所有的酸都不反应
D.将石棉(CaMg3Si4O12)化学式改写成氧化物
的形式:3(MgO·CaO)·4SiO2
A科学视野新型陶瓷人造关节高压钠灯高温结构陶瓷 1.氧化铝陶瓷陶瓷机械零件三、硅单质(Si)2、物理性质:有金属光泽的灰黑色固体,熔点 高,硬度大。1、存在形式{晶体硅无定形硅你能根据硅的原子结构推测硅单质可能具有的化
学性质②在高温条件下,单质硅能与O2和Cl2等非金属
单质反应。①常温下化学性质不活泼,只能跟F2、HF和
NaOH溶液反应。Si+2F2=SiF4 Si+4HF=SiF4↑+2H2↑ Si+2NaOH+H2O=Na2SiO3+2H2↑Si+O2 SiO2
3、化学性质工业上,用焦炭在高温下还原石英砂可制得粗硅
SiO2+2C=Si(粗)+2CO↑ ① ,又能跟氯气反应经提纯得到 SiCl4后再用氢气还原制得纯硅:Si(粗)+2Cl2=SiCl4 ② ,SiCl4+2H2=Si(纯)+4HCl③。根据以上反应回答下列问题:
(1)反应①中焦炭做( )
A.还原剂 B.氧化剂 C.二者都不是
(2)反应 ②属于( ),反应③ 属于( )
A.化合反应 B.分解反应 C.氧化还原反应
D.非氧化还原反应 E.置换反应4、硅的工业制备做一做AAE5、用途:太阳能电池、计算机芯片以及半导体材料信息技术等材料和人造卫星、登月车、火星探测器等动力设备新能源。硅太阳能电池观看下列图片总结单质硅的用途硅芯片是各种计算机、
微电子产品的核心
小结:
1.介绍了硅酸盐的定义、性质和表示方法及工业产品.
2.硅酸钠的性质和用途
3.硅单质的存在形式、性质、工业制备和用途
4.硅酸钠水溶液久置在空气中会出现白色浑浊的原因。
作业:
课本P69 3、4
