课题2 催化剂对过氧化氢分解反应速率的影响(浙江省绍兴市越城区)
文档属性
| 名称 | 课题2 催化剂对过氧化氢分解反应速率的影响(浙江省绍兴市越城区) |

|
|
| 格式 | rar | ||
| 文件大小 | 332.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-06-02 16:55:00 | ||
图片预览






文档简介
课件15张PPT。课题2 催化剂对过氧化氢分解反应速率的影响一、知识准备1、催化剂的作用
在化工生产中,常常加入催化剂以促进化学反应的进行。硫酸工业: V2O5
氨的催化氧化: Pt
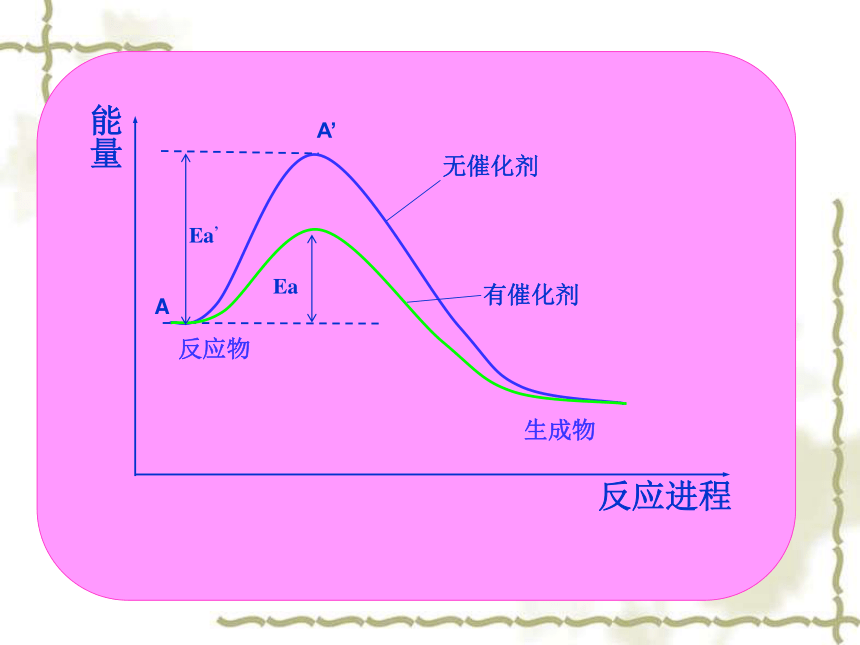
合成氨: Fe 生物体内的化学反应也与催化剂有着密切的关系,生物体内的各种酶具有催化活性,是生物催化剂。催化剂为什么可以加快化学反应速率?有效碰撞:能够引超起反应的分子(或离子间)的相互碰撞叫有效碰撞。活化分子:能够发生有效碰撞的分子叫活化分子。活化能:活化分子的平均能量与所有分子的平均能量的差称为活化能。2、催化剂与反应活化能催化剂能使反应的活化能降低,如入所示。3、催化剂对化学反应速率的影响 适当的催化剂能降低反应的活化能,增大了活化分子的百分数,增大了化学反应的速率。如何选择合适的催化剂?催化剂: 过渡金属元素及其化合物4、过氧化氢分解的影响因素(1)溶液酸碱性:碱性溶液中,分解较快。
(2)光、热、大多数金属氧化物作催化剂。如:MnO2、 CuO、Fe2O3
实验中如何判断H2O2分解速率的大小?观察比较:a、H2O2溶液中放出气泡的快慢程度
b、测定单位时间内H2O2分解放出的O2的体积。1、体会催化剂在生产、生活和科学研究领域的重要作用.
2、通过实验了解催化剂对化学反应速率的影响.
3、观察比较不同催化剂对双氧水分解的不同催化效率,尝试用比较法寻找实验的最佳方案.二、实验目的:根据上述实验目的设计相关实验方案实验 1:比较H2O2在不同催化剂作用下的分解情况:H2O2H2O2ABCD现象:A、B、C三支试管中均有气泡冒出,B试管内的反应相对剧烈.2~3滴FeCl3溶液MnO2粉末自选催化剂三、实验方案设计实验 2 : 比较H2O2在不同催化剂作用下的分解产生氧气的体积.(1)装置设计:…实验 2:以0.1g不同催化剂进行对比实验:1121354911162024实验结论:催化剂能加快化学反应速率;不同的催化剂对同一化学反应的影响是不同的。10.5203448 不同催化剂对同一化学反应催化效率不同,实验所选择的MnO2、CuO、 FeCl3均能催化双氧水分解,在同一条件下,MnO2的催化效率最好。实验结论: FeCl3 溶液能作过氧化氢分解的催化剂。某研究小组为了探究真正起催化作用的是Fe3+ 还是CI- ,设计了如下实验方案,请你帮助他们填写下表。练习:有大量气泡放出
带火星的木条复燃Cl-无催化效果,Fe3+真正起了催化作用。
HClFe2(SO4)3无明显现象2、某同学在做过氧化氢分解的实验时,不小心将过氧化氢溶液滴到地面的红砖上,发现有大量的气泡产生。他立即想到:红砖能不能作过氧化氢分解的催化剂?于是他立即查阅资料,设计实验方案进行探究。
(1)本实验的目的 。
(2)该同学直接将带火星的木条伸入装有过氧化氢溶液的试管中,发现木条不复燃,说明 。
(3)他将装有过氧化氢溶液的试管微微加热,发现有 产生, 再将带火星的木条伸入试管,发现木条复燃,说
明 。
(4)他在装有过氧化氢溶液的试管中加入少量的红砖粉,再将带大量的木条伸入试管中,可观察到 ,说
明 。于是他得出:红砖粉是过氧化氢分解的催化剂。你认为通过上述实验能否得出以上结论? ,若不能,还需进行的实验是 ,
。探究红砖粉能否作过氧化氢分解的催化剂H2O2常温下不易分解气体H2O2加热发生分解大量气体产生红砖粉使H2O2溶液在常温下就能迅速分解,产生氧气不能(1)探究红砖粉在过氧化氢溶液分解前后,其质量是否发生改变(2)探究红砖粉在过氧化氢溶液分解前后,其化学性质是否发生改变。
在化工生产中,常常加入催化剂以促进化学反应的进行。硫酸工业: V2O5
氨的催化氧化: Pt
合成氨: Fe 生物体内的化学反应也与催化剂有着密切的关系,生物体内的各种酶具有催化活性,是生物催化剂。催化剂为什么可以加快化学反应速率?有效碰撞:能够引超起反应的分子(或离子间)的相互碰撞叫有效碰撞。活化分子:能够发生有效碰撞的分子叫活化分子。活化能:活化分子的平均能量与所有分子的平均能量的差称为活化能。2、催化剂与反应活化能催化剂能使反应的活化能降低,如入所示。3、催化剂对化学反应速率的影响 适当的催化剂能降低反应的活化能,增大了活化分子的百分数,增大了化学反应的速率。如何选择合适的催化剂?催化剂: 过渡金属元素及其化合物4、过氧化氢分解的影响因素(1)溶液酸碱性:碱性溶液中,分解较快。
(2)光、热、大多数金属氧化物作催化剂。如:MnO2、 CuO、Fe2O3
实验中如何判断H2O2分解速率的大小?观察比较:a、H2O2溶液中放出气泡的快慢程度
b、测定单位时间内H2O2分解放出的O2的体积。1、体会催化剂在生产、生活和科学研究领域的重要作用.
2、通过实验了解催化剂对化学反应速率的影响.
3、观察比较不同催化剂对双氧水分解的不同催化效率,尝试用比较法寻找实验的最佳方案.二、实验目的:根据上述实验目的设计相关实验方案实验 1:比较H2O2在不同催化剂作用下的分解情况:H2O2H2O2ABCD现象:A、B、C三支试管中均有气泡冒出,B试管内的反应相对剧烈.2~3滴FeCl3溶液MnO2粉末自选催化剂三、实验方案设计实验 2 : 比较H2O2在不同催化剂作用下的分解产生氧气的体积.(1)装置设计:…实验 2:以0.1g不同催化剂进行对比实验:1121354911162024实验结论:催化剂能加快化学反应速率;不同的催化剂对同一化学反应的影响是不同的。10.5203448 不同催化剂对同一化学反应催化效率不同,实验所选择的MnO2、CuO、 FeCl3均能催化双氧水分解,在同一条件下,MnO2的催化效率最好。实验结论: FeCl3 溶液能作过氧化氢分解的催化剂。某研究小组为了探究真正起催化作用的是Fe3+ 还是CI- ,设计了如下实验方案,请你帮助他们填写下表。练习:有大量气泡放出
带火星的木条复燃Cl-无催化效果,Fe3+真正起了催化作用。
HClFe2(SO4)3无明显现象2、某同学在做过氧化氢分解的实验时,不小心将过氧化氢溶液滴到地面的红砖上,发现有大量的气泡产生。他立即想到:红砖能不能作过氧化氢分解的催化剂?于是他立即查阅资料,设计实验方案进行探究。
(1)本实验的目的 。
(2)该同学直接将带火星的木条伸入装有过氧化氢溶液的试管中,发现木条不复燃,说明 。
(3)他将装有过氧化氢溶液的试管微微加热,发现有 产生, 再将带火星的木条伸入试管,发现木条复燃,说
明 。
(4)他在装有过氧化氢溶液的试管中加入少量的红砖粉,再将带大量的木条伸入试管中,可观察到 ,说
明 。于是他得出:红砖粉是过氧化氢分解的催化剂。你认为通过上述实验能否得出以上结论? ,若不能,还需进行的实验是 ,
。探究红砖粉能否作过氧化氢分解的催化剂H2O2常温下不易分解气体H2O2加热发生分解大量气体产生红砖粉使H2O2溶液在常温下就能迅速分解,产生氧气不能(1)探究红砖粉在过氧化氢溶液分解前后,其质量是否发生改变(2)探究红砖粉在过氧化氢溶液分解前后,其化学性质是否发生改变。
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
