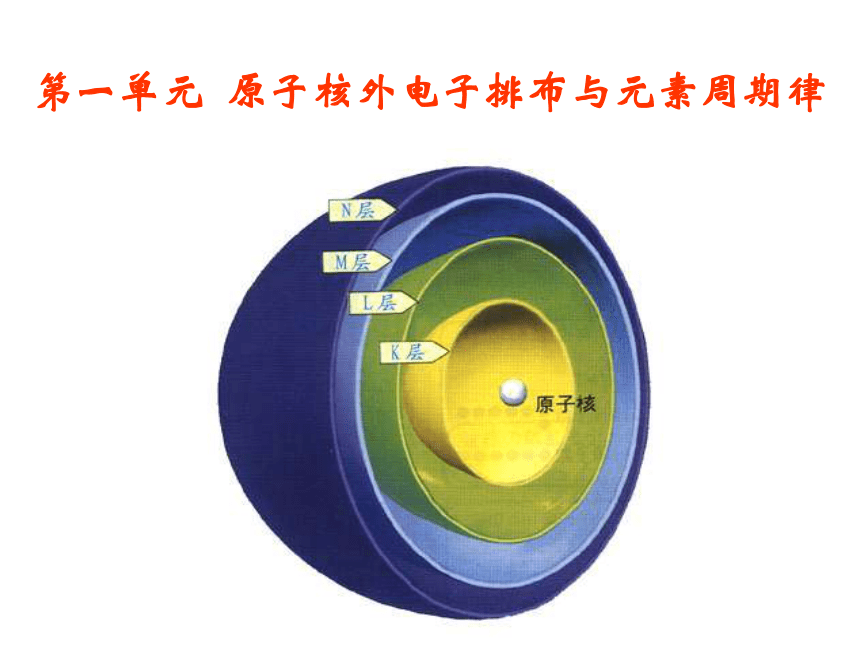
原子核外电子排布与元素周期律(浙江省金华市婺城区)
文档属性
| 名称 | 原子核外电子排布与元素周期律(浙江省金华市婺城区) |
|
|
| 格式 | rar | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-06-17 00:00:00 | ||
图片预览









文档简介
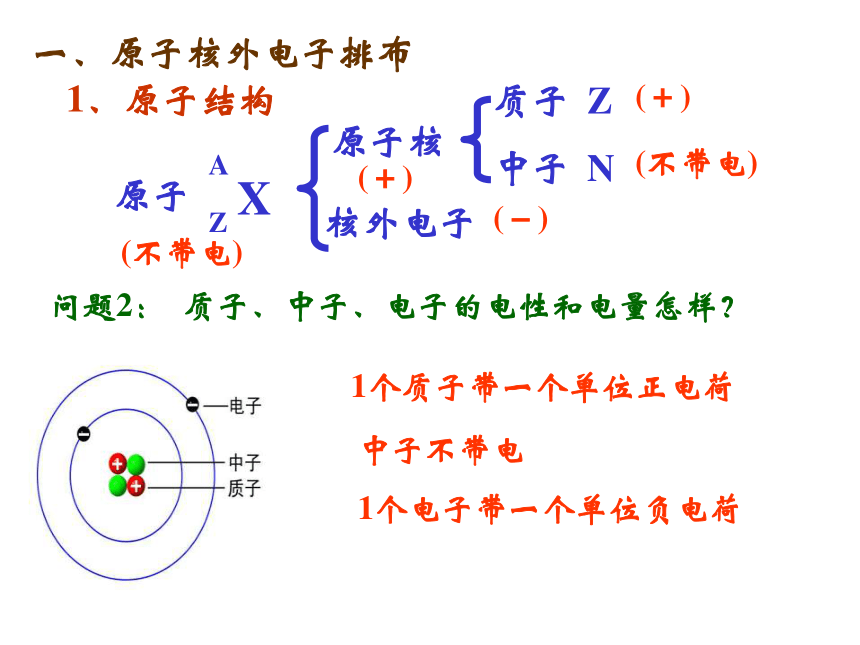
课件52张PPT。第一单元 原子核外电子排布与元素周期律1、原子结构问题1:原子是怎样构成的?一、原子核外电子排布质子:决定元素的种类,
与中子共同决定原子的相对原子质量 中子:决定同位素的种类,
与质子共同决定原子的相对原子质量电子:核外电子的排布,尤其是最外层电子数决定元素的化学性质问题2: 质子、中子、电子的电性和电量怎样?1个质子带一个单位正电荷1个电子带一个单位负电荷中子不带电1、原子结构一、原子核外电子排布(+)(不带电)(-)(+)(不带电)含义:①质量数A=质子数Z+中子数N②原子:Z=质子数=核电荷数=原子序数
=原子核外电子数1、原子结构一、原子核外电子排布阳离子ZMn+:离子:Z=质子数=核电荷数=原子序数
=原子的核外电子数±离子所带电荷数核外电子数=Z-n阴离子ZMm-:核外电子数=Z+mA:代表质量数; Z:代表核电荷数或质子数;
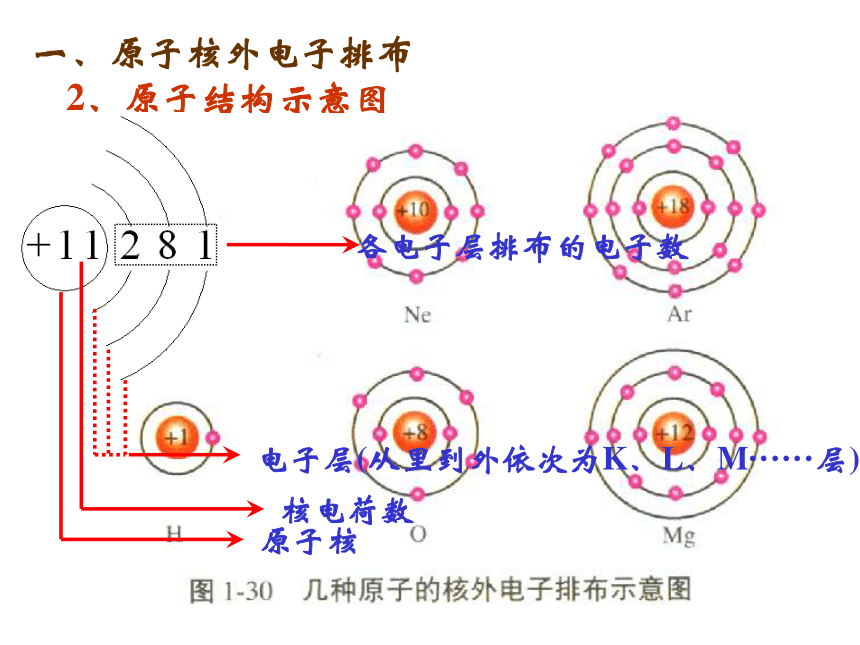
P:代表离子的价态;m:代表化合价 n:代表原子个数关系:2、原子结构示意图一、原子核外电子排布各电子层排布的电子数电子层(从里到外依次为K、L、M······层)原子核核电荷数1-18号原子结构示意图思考:你能由上述原子结构示意图总结出原子核外电子排布的规律吗?(1)核外电子按能量高低分层排布(运动)电子层数n 1 2 3 4 5 6 7电子层符号 K L M N O P Q2、原子核外电子排布一、原子核外电子排布电子层:根据电子的能量差异和通常运动区域离核的远近不同,将核外电子运动的不同区域称为电子层。n越大,电子离核越远,
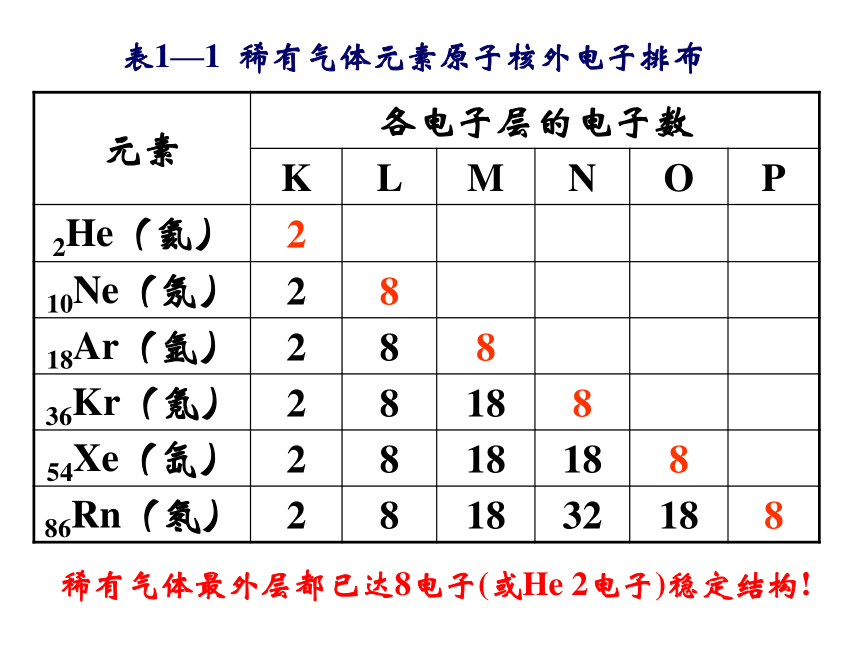
其能量也越高!小结:表1—1 稀有气体元素原子核外电子排布稀有气体最外层都已达8电子(或He 2电子)稳定结构!b.各层最多容纳2n2 个电子c. 最外层不超过8个(K层不超过2个) 次外层不超过18个,
倒数第三层不超过32个。上述规律相互制约,相互联系! (2)核外电子排布规律(一低四不超)a.能量最低原理电子一般总是尽先排布在能量最低的电子层 里,即最先排布K层;当K层排满后,再排布
L层;当L层排满后,再排布M层;……2、原子核外电子排布一、原子核外电子排布(5)最外层电子数是次外层电子数的2倍的元素:_____
是次外层3倍的是:_ _;是次外层4倍的是:___.(9)内层电子数之和是最外层电子数2倍的元素:________(8)次外层电子数是最外层电子数的2倍的元素:_______(7)电子总数为最外层电子数的2倍的是:_________(6)电子层数与最外层电子数相等的元素:___________(4)最外层电子数等于次外层电子数的元素:________ (3)最外层有2个电子的元素:_________________(2)最外层有1个电子的元素:___________(1)原子核中无中子的原子:_______前20号元素的原子结构的特殊性Li 、Na 、K 、 HBe、Mg、Ca、HeBe、ArCNeH、Be、AlBeSi、LiLi、PO随堂练习:1、根据核外电子排布规律,画出下列微粒的结构示意图。
(1)3Li、55Cs
(2)9F、53I
(3)11Na+ 16S2-2、与OH-具有相同质子数和电子数的微粒是( )
A、F- B、NH3 C、H2O D、Na+ A3、核电荷数分别为16的元素和4的元素的原子相比较,前者的下列数据是后者的4倍的是( )
A 电子数 B 最外层电子数
C 电子层数 D 次外层电子数 AD4、已知R2+核内共有N个中子,R的质量数为A,
m g R2+中含电子的物质的量为( )
A. mol B. mol
C. mol D. mol随堂练习:D5、已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,与它们对应的原子的核电荷数由大到小的顺序是 。
E>D>C>B>A〔观察思考1〕观察下表,请说出随着核电荷数的递增,核电荷数为1~18的元素原子最外层电子的排布呈现了怎样的周期性的变化?二、元素周期律结论1:随着核电荷数的递增,元素原子最外层电子数从1到8(或2)依次递增,呈周期性变化。〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表示原子半径,根据数据表作图,表示出3~9、11~17的元素的原子最外层电子数与原子半径的函数图像。提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。
(2)表中数据的单位是pm(皮米),1pm=10-12m。二、元素周期律交流与讨论:
根据图像思考随着核电荷数的递增,原子半径有什么样的变化规律?与最外层电子数和电子层数有什么关系?结论2:随着核电荷数的递增,元素原子半径呈周期性变化,每隔一定数目,元素原子半径重复由大到小的变化趋势(稀有气体元素除外)原子半径的比较方法:
从左到右,逐渐减小;
从上到下,逐渐增大。
(稀有气体元素除外)在1~18号元素原子中半径最小的原子和半径最大的原子分别是什么?1~18号元素原子中半径最小的原子是氢原子,
半径最大的原子为钠原子。原子半径的比较方法:从左到右,逐渐减小;从上到下,逐渐增大。(稀有气体元素除外)思考[练习]
比较原子半径的大小(填“>”或“<”)
K Cs,O F,Na Mg,Na Cl,Na F<>>你能否比较下列微粒半径的大小呢?
K+ Cs+,O2- F-, Na+ Mg2+ ,Na+ Cl-
Na Na+,Cl Cl-, Na+ F- <>><>><<>知识拓展〔观察思考3〕观察下表:3~9、11~17号元素的最高正化合价与最低化合价。 结论3:随着核电荷数的递增,元素的主要化合价呈周期性变化,每隔一定数目,元素的最高正化合价重复出现由+1到+7递增,最低负化合价由-4到-1递增的变化。(稀有气体元素除外) 结论:(1)元素最高正化合价=元素原子最外层电子数
(2)元素最高正化合价+|元素最低负化合价|=8 观察元素最高正化合价与最低负化合价,结合元素原子的核外电子排布,思考它们之间是否存在一定的联系? 〔观察思考3〕观察下表:3~9、11~17号元素的最高正化合价与最低化合价。 思考:O和F无最高正价!1、元素金属性强弱的判断依据:金属性越强非金属性越强单质还原性越强
与水或酸置换氢气越容易
最高价氧化物水化物碱性越强单质氧化性越强
与氢气反应越容易
气态氢化物越稳定
最高价氧化物水化物酸性越强思考:随着原子序数递增,元素的化学性质是否也会有相应的周期性变化规律呢?2、元素非金属性强弱的判断依据:11Na 12Mg 13Al 14Si 15P 16S 17Cl 与水反应的剧烈程度与酸反应的剧烈程度NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性 金属性与H2反应难易程度气态氢化物稳定性非金属性H4SiO4 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 最强酸 +1 +2 +3+4 +5 +6 +7[探究活动]11—17号元素的金属性、非金属性的变化规律:减弱最高价氧化物水化物增强减弱减弱增强容易碱性减弱最高价含氧酸酸性增强SiH4 < PH3 < H2S< HCl二、元素周期律1、概念:元素的性质随着原子序数的递增而呈现周期性的变化的规律叫做元素周期律。原子半径;元素化合价;原子核外电子排布;元素的金属性、非金属性。2、本质:元素性质的周期性变化规律是元素原子核外电子排布周期性变化的必然结果。小结:随原子序数递增均呈周期性变化1、R元素形成的化合物RH3,其中R的化合价是其最低负化合价,则R元素最高价氧化物的化学式是: ( )
A.RO2 B.RO3 C.R2O5 D.R2O7
C随堂练习:2、在下列元素中,最高正化合价数值最大的是 ( )
A.Na B.F C.S D.Ar
C3、从原子序数11依次增加到17,下列所述递变关系中,错误的是( )
A.电子层数逐渐增多
B.原子半径逐渐增大
C.最高正化合价数值逐渐增大
D.从硅到氯,最低负化合价从-4到-1AB随堂练习:4、元素X原子的最外层有3个电子,Y的最高价
氧化物的化学式为YO3,则它们形成的化合
物可能是:( )
A.XY2 B.X2Y3
C.X3Y2 D.XY
B5、X、Y、Z是1~18号元素中的三种。X元素的原
子最外层有1个电子;Y元素原子的M层电子数
只有K层和L层电子总数的一半;Z元素原子的L
层电子数比Y原子L层电子数少2个。这3种元素
组成的化合物的分子式不可能是( )
A.X3YZ4 B.XYZ2 C.XYZ3 D.X2YZ4 D随堂练习:6、用相应化学式回答原子序数1-18号元素的有关问题:
除稀有气体外,原子半径最大的是 。
最高价氧化物的水化物碱性最强的是 。
最高价氧化物的水化物呈两性的是 。
最高价氧化物的水化物酸性最强的是 。
能形成气态氢化物且最稳定的是 。
元素化合价最高的是 。
NaNaOHAl(OH)3 HClO4 HF 随堂练习:Cl 反应剧烈热水较快无明显现象剧烈较剧烈〔探究活动1〕1整合与反思 通过本课的学习,
你有什么收获? 元素
周期律②根据最外层电子数与核电荷数的关系, 尝试排出原子序数为1-18号元素化学元素表。动交流与讨论1门捷列夫( 1834-1907),俄国化学家。 元素周期律金属非金属三、元素周期表及其应用1。元素周期表是元素周期律的具体表现形式(一)元素周期表的结构2。元素周期表的编排原则横行:将电子层数相同的元素,
按核电荷数递增的顺序从左到右排列。纵行:将最外层电子数相同的元素,
按核电荷数递增的顺序从上到下排列。原子序数 =核电荷数
=质子数
=核外电子数(电中性原子) 3。周期(1)周期是指一横行,共分7个周期(3)周期序数=电子层数(2)周期的分类及所含元素特点4。族(1)族的分类及表示①主族:③0族:②副族:④Ⅷ族:由短周期和长周期共同构成的族七主:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA主族序数=最外层电子数完全由长周期元素构成的族稀有气体元素构成的族七副:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB包括8、9、10三列(2)族的分布位置小结:(1)周期数(7) :三短、四长、一不全
(2)周期序数 = 核外电子层数 。
(3)每一周期都是从 碱金属开始,
过渡到卤素,到稀有气体结束 。
(4)镧系元素:共15种。
锕系元素:共15种。(1)族数(16) :七主、七副、0和Ⅷ
(2)主族序数 = 最外层电子数
(3)族的排列顺序:
主→副→Ⅷ →主→副→0
ⅠA 、ⅡA、ⅢB、ⅣB 、ⅤB 、ⅥB 、ⅦB 、 Ⅷ
ⅠB 、ⅡB 、ⅢA、 Ⅳ A 、ⅤA 、ⅥA 、ⅦA 、0小结:1、必须熟悉周期表的结构:18纵行:7主、7副、0与VIII;
7横行 :三长、三短、一不全,
镧系、锕系排下边。2、必须掌握元素在周期表中的位置
和原子结构的关系: 周期序数=原子的电子层数 主族序数=元素原子最外层电子数=最高正价 原子序数=核电荷数=质子数=原子核外电子数[总结]5。元素周期表分区(1)金属区:周期表的左下方(2)非金属区:周期表的右上方(3)稀有气体区:周期表的最右方(二)元素在周期表中的位置与性质的关系1。同周期:11Na 12Mg 13Al 14Si 15P 16S 17Cl ●同周期元素原子核外电子层数相同,
●从左往右,
●核电荷数递增,最外层电子数逐渐增加,
●原子半径逐渐减小,
●核对核外电子的吸引能力逐渐增强,
●失去电子的能力逐渐减弱,金属性减弱,
●得到电子的能力逐渐增大,非金属性增强。(二)元素在周期表中的位置与性质的关系2。同主族:3 Li
11Na
19K
37Rb
55CsLiOH NaOH KOH RbOH CsOH最高价氧化物水化物碱性增强与水反应的剧烈程度增强解释:从上往下,电子层增多,半径增大;
失电子能力增强,金属性增强。(二)元素在周期表中的位置与性质的关系2。同主族:9 F
17Cl
35Br
53I HClO4 HBrO4 HIO4最高价氧化物水化物酸性减弱单质氧化性逐渐减弱解释:从上往下,电子层增多,半径增大;
得电子能力减弱,非金属性减弱。(二)元素在周期表中的位置与性质的关系2。同主族:F
Cl
Br
I 从上往下,电子层增多,半径增大Li
Na
K
Si
Cs得电子能力减弱,非金属性减弱。失电子能力增强,金属性增强;(二)元素在周期表中的位置与性质的关系F
Cl
Br
I 从上往下,电子层增多,半径增大Li
Na
K
Rb
Cs得电子能力减弱,非金属性减弱。失电子能力增强,金属性增强;11Na 12Mg 13Al 14Si 15P 16S 17Cl 从左往右,核电荷增大,半径减小得电子能力增强,非金属性增强。失电子能力减弱,金属性减弱;(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习[例1]下列对于铯(Cs)的性质的预测中, 正确的是 ( )
A.它只有一种氧化物Cs2O B.它与水剧烈反应
C.Cs+具有很强的氧化性 D.CsHCO3受热不易分解(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习[例2]具有相同电子结构的三种微粒Xm+、Ym-、 Z ,下列分析正确的是 ( )
A.最外层电子数:X>Y>Z B.微粒半径: Ym- > Z > Xm+
C.Z一定是一种稀有气体元素的原子 D.原子半径的关系是X>Z>Y(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习2。科学预言新元素及预测它们的原子结构和性质。
3。对工农业生产的指导方面,可在周期表中一定的区域内寻找新的物质。
4。可以借助元素周期表研究合成有特定性质的新物质。例如:在金属和非金属的分界线附近寻找半导体材料,在过渡元素中寻找各种优良的催化剂和耐高温、耐腐蚀的合金材料。 1869年 门捷列夫发表的第一张元素周期表再见!
与中子共同决定原子的相对原子质量 中子:决定同位素的种类,
与质子共同决定原子的相对原子质量电子:核外电子的排布,尤其是最外层电子数决定元素的化学性质问题2: 质子、中子、电子的电性和电量怎样?1个质子带一个单位正电荷1个电子带一个单位负电荷中子不带电1、原子结构一、原子核外电子排布(+)(不带电)(-)(+)(不带电)含义:①质量数A=质子数Z+中子数N②原子:Z=质子数=核电荷数=原子序数
=原子核外电子数1、原子结构一、原子核外电子排布阳离子ZMn+:离子:Z=质子数=核电荷数=原子序数
=原子的核外电子数±离子所带电荷数核外电子数=Z-n阴离子ZMm-:核外电子数=Z+mA:代表质量数; Z:代表核电荷数或质子数;
P:代表离子的价态;m:代表化合价 n:代表原子个数关系:2、原子结构示意图一、原子核外电子排布各电子层排布的电子数电子层(从里到外依次为K、L、M······层)原子核核电荷数1-18号原子结构示意图思考:你能由上述原子结构示意图总结出原子核外电子排布的规律吗?(1)核外电子按能量高低分层排布(运动)电子层数n 1 2 3 4 5 6 7电子层符号 K L M N O P Q2、原子核外电子排布一、原子核外电子排布电子层:根据电子的能量差异和通常运动区域离核的远近不同,将核外电子运动的不同区域称为电子层。n越大,电子离核越远,
其能量也越高!小结:表1—1 稀有气体元素原子核外电子排布稀有气体最外层都已达8电子(或He 2电子)稳定结构!b.各层最多容纳2n2 个电子c. 最外层不超过8个(K层不超过2个) 次外层不超过18个,
倒数第三层不超过32个。上述规律相互制约,相互联系! (2)核外电子排布规律(一低四不超)a.能量最低原理电子一般总是尽先排布在能量最低的电子层 里,即最先排布K层;当K层排满后,再排布
L层;当L层排满后,再排布M层;……2、原子核外电子排布一、原子核外电子排布(5)最外层电子数是次外层电子数的2倍的元素:_____
是次外层3倍的是:_ _;是次外层4倍的是:___.(9)内层电子数之和是最外层电子数2倍的元素:________(8)次外层电子数是最外层电子数的2倍的元素:_______(7)电子总数为最外层电子数的2倍的是:_________(6)电子层数与最外层电子数相等的元素:___________(4)最外层电子数等于次外层电子数的元素:________ (3)最外层有2个电子的元素:_________________(2)最外层有1个电子的元素:___________(1)原子核中无中子的原子:_______前20号元素的原子结构的特殊性Li 、Na 、K 、 HBe、Mg、Ca、HeBe、ArCNeH、Be、AlBeSi、LiLi、PO随堂练习:1、根据核外电子排布规律,画出下列微粒的结构示意图。
(1)3Li、55Cs
(2)9F、53I
(3)11Na+ 16S2-2、与OH-具有相同质子数和电子数的微粒是( )
A、F- B、NH3 C、H2O D、Na+ A3、核电荷数分别为16的元素和4的元素的原子相比较,前者的下列数据是后者的4倍的是( )
A 电子数 B 最外层电子数
C 电子层数 D 次外层电子数 AD4、已知R2+核内共有N个中子,R的质量数为A,
m g R2+中含电子的物质的量为( )
A. mol B. mol
C. mol D. mol随堂练习:D5、已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,与它们对应的原子的核电荷数由大到小的顺序是 。
E>D>C>B>A〔观察思考1〕观察下表,请说出随着核电荷数的递增,核电荷数为1~18的元素原子最外层电子的排布呈现了怎样的周期性的变化?二、元素周期律结论1:随着核电荷数的递增,元素原子最外层电子数从1到8(或2)依次递增,呈周期性变化。〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表示原子半径,根据数据表作图,表示出3~9、11~17的元素的原子最外层电子数与原子半径的函数图像。提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。
(2)表中数据的单位是pm(皮米),1pm=10-12m。二、元素周期律交流与讨论:
根据图像思考随着核电荷数的递增,原子半径有什么样的变化规律?与最外层电子数和电子层数有什么关系?结论2:随着核电荷数的递增,元素原子半径呈周期性变化,每隔一定数目,元素原子半径重复由大到小的变化趋势(稀有气体元素除外)原子半径的比较方法:
从左到右,逐渐减小;
从上到下,逐渐增大。
(稀有气体元素除外)在1~18号元素原子中半径最小的原子和半径最大的原子分别是什么?1~18号元素原子中半径最小的原子是氢原子,
半径最大的原子为钠原子。原子半径的比较方法:从左到右,逐渐减小;从上到下,逐渐增大。(稀有气体元素除外)思考[练习]
比较原子半径的大小(填“>”或“<”)
K Cs,O F,Na Mg,Na Cl,Na F<>>你能否比较下列微粒半径的大小呢?
K+ Cs+,O2- F-, Na+ Mg2+ ,Na+ Cl-
Na Na+,Cl Cl-, Na+ F- <>><>><<>知识拓展〔观察思考3〕观察下表:3~9、11~17号元素的最高正化合价与最低化合价。 结论3:随着核电荷数的递增,元素的主要化合价呈周期性变化,每隔一定数目,元素的最高正化合价重复出现由+1到+7递增,最低负化合价由-4到-1递增的变化。(稀有气体元素除外) 结论:(1)元素最高正化合价=元素原子最外层电子数
(2)元素最高正化合价+|元素最低负化合价|=8 观察元素最高正化合价与最低负化合价,结合元素原子的核外电子排布,思考它们之间是否存在一定的联系? 〔观察思考3〕观察下表:3~9、11~17号元素的最高正化合价与最低化合价。 思考:O和F无最高正价!1、元素金属性强弱的判断依据:金属性越强非金属性越强单质还原性越强
与水或酸置换氢气越容易
最高价氧化物水化物碱性越强单质氧化性越强
与氢气反应越容易
气态氢化物越稳定
最高价氧化物水化物酸性越强思考:随着原子序数递增,元素的化学性质是否也会有相应的周期性变化规律呢?2、元素非金属性强弱的判断依据:11Na 12Mg 13Al 14Si 15P 16S 17Cl 与水反应的剧烈程度与酸反应的剧烈程度NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性 金属性与H2反应难易程度气态氢化物稳定性非金属性H4SiO4 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 最强酸 +1 +2 +3+4 +5 +6 +7[探究活动]11—17号元素的金属性、非金属性的变化规律:减弱最高价氧化物水化物增强减弱减弱增强容易碱性减弱最高价含氧酸酸性增强SiH4 < PH3 < H2S< HCl二、元素周期律1、概念:元素的性质随着原子序数的递增而呈现周期性的变化的规律叫做元素周期律。原子半径;元素化合价;原子核外电子排布;元素的金属性、非金属性。2、本质:元素性质的周期性变化规律是元素原子核外电子排布周期性变化的必然结果。小结:随原子序数递增均呈周期性变化1、R元素形成的化合物RH3,其中R的化合价是其最低负化合价,则R元素最高价氧化物的化学式是: ( )
A.RO2 B.RO3 C.R2O5 D.R2O7
C随堂练习:2、在下列元素中,最高正化合价数值最大的是 ( )
A.Na B.F C.S D.Ar
C3、从原子序数11依次增加到17,下列所述递变关系中,错误的是( )
A.电子层数逐渐增多
B.原子半径逐渐增大
C.最高正化合价数值逐渐增大
D.从硅到氯,最低负化合价从-4到-1AB随堂练习:4、元素X原子的最外层有3个电子,Y的最高价
氧化物的化学式为YO3,则它们形成的化合
物可能是:( )
A.XY2 B.X2Y3
C.X3Y2 D.XY
B5、X、Y、Z是1~18号元素中的三种。X元素的原
子最外层有1个电子;Y元素原子的M层电子数
只有K层和L层电子总数的一半;Z元素原子的L
层电子数比Y原子L层电子数少2个。这3种元素
组成的化合物的分子式不可能是( )
A.X3YZ4 B.XYZ2 C.XYZ3 D.X2YZ4 D随堂练习:6、用相应化学式回答原子序数1-18号元素的有关问题:
除稀有气体外,原子半径最大的是 。
最高价氧化物的水化物碱性最强的是 。
最高价氧化物的水化物呈两性的是 。
最高价氧化物的水化物酸性最强的是 。
能形成气态氢化物且最稳定的是 。
元素化合价最高的是 。
NaNaOHAl(OH)3 HClO4 HF 随堂练习:Cl 反应剧烈热水较快无明显现象剧烈较剧烈〔探究活动1〕1整合与反思 通过本课的学习,
你有什么收获? 元素
周期律②根据最外层电子数与核电荷数的关系, 尝试排出原子序数为1-18号元素化学元素表。动交流与讨论1门捷列夫( 1834-1907),俄国化学家。 元素周期律金属非金属三、元素周期表及其应用1。元素周期表是元素周期律的具体表现形式(一)元素周期表的结构2。元素周期表的编排原则横行:将电子层数相同的元素,
按核电荷数递增的顺序从左到右排列。纵行:将最外层电子数相同的元素,
按核电荷数递增的顺序从上到下排列。原子序数 =核电荷数
=质子数
=核外电子数(电中性原子) 3。周期(1)周期是指一横行,共分7个周期(3)周期序数=电子层数(2)周期的分类及所含元素特点4。族(1)族的分类及表示①主族:③0族:②副族:④Ⅷ族:由短周期和长周期共同构成的族七主:ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA主族序数=最外层电子数完全由长周期元素构成的族稀有气体元素构成的族七副:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB包括8、9、10三列(2)族的分布位置小结:(1)周期数(7) :三短、四长、一不全
(2)周期序数 = 核外电子层数 。
(3)每一周期都是从 碱金属开始,
过渡到卤素,到稀有气体结束 。
(4)镧系元素:共15种。
锕系元素:共15种。(1)族数(16) :七主、七副、0和Ⅷ
(2)主族序数 = 最外层电子数
(3)族的排列顺序:
主→副→Ⅷ →主→副→0
ⅠA 、ⅡA、ⅢB、ⅣB 、ⅤB 、ⅥB 、ⅦB 、 Ⅷ
ⅠB 、ⅡB 、ⅢA、 Ⅳ A 、ⅤA 、ⅥA 、ⅦA 、0小结:1、必须熟悉周期表的结构:18纵行:7主、7副、0与VIII;
7横行 :三长、三短、一不全,
镧系、锕系排下边。2、必须掌握元素在周期表中的位置
和原子结构的关系: 周期序数=原子的电子层数 主族序数=元素原子最外层电子数=最高正价 原子序数=核电荷数=质子数=原子核外电子数[总结]5。元素周期表分区(1)金属区:周期表的左下方(2)非金属区:周期表的右上方(3)稀有气体区:周期表的最右方(二)元素在周期表中的位置与性质的关系1。同周期:11Na 12Mg 13Al 14Si 15P 16S 17Cl ●同周期元素原子核外电子层数相同,
●从左往右,
●核电荷数递增,最外层电子数逐渐增加,
●原子半径逐渐减小,
●核对核外电子的吸引能力逐渐增强,
●失去电子的能力逐渐减弱,金属性减弱,
●得到电子的能力逐渐增大,非金属性增强。(二)元素在周期表中的位置与性质的关系2。同主族:3 Li
11Na
19K
37Rb
55CsLiOH NaOH KOH RbOH CsOH最高价氧化物水化物碱性增强与水反应的剧烈程度增强解释:从上往下,电子层增多,半径增大;
失电子能力增强,金属性增强。(二)元素在周期表中的位置与性质的关系2。同主族:9 F
17Cl
35Br
53I HClO4 HBrO4 HIO4最高价氧化物水化物酸性减弱单质氧化性逐渐减弱解释:从上往下,电子层增多,半径增大;
得电子能力减弱,非金属性减弱。(二)元素在周期表中的位置与性质的关系2。同主族:F
Cl
Br
I 从上往下,电子层增多,半径增大Li
Na
K
Si
Cs得电子能力减弱,非金属性减弱。失电子能力增强,金属性增强;(二)元素在周期表中的位置与性质的关系F
Cl
Br
I 从上往下,电子层增多,半径增大Li
Na
K
Rb
Cs得电子能力减弱,非金属性减弱。失电子能力增强,金属性增强;11Na 12Mg 13Al 14Si 15P 16S 17Cl 从左往右,核电荷增大,半径减小得电子能力增强,非金属性增强。失电子能力减弱,金属性减弱;(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习[例1]下列对于铯(Cs)的性质的预测中, 正确的是 ( )
A.它只有一种氧化物Cs2O B.它与水剧烈反应
C.Cs+具有很强的氧化性 D.CsHCO3受热不易分解(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习[例2]具有相同电子结构的三种微粒Xm+、Ym-、 Z ,下列分析正确的是 ( )
A.最外层电子数:X>Y>Z B.微粒半径: Ym- > Z > Xm+
C.Z一定是一种稀有气体元素的原子 D.原子半径的关系是X>Z>Y(三)元素周期律和元素周期表的重要应用1。利用“构-位-性”的关系指导化学学习2。科学预言新元素及预测它们的原子结构和性质。
3。对工农业生产的指导方面,可在周期表中一定的区域内寻找新的物质。
4。可以借助元素周期表研究合成有特定性质的新物质。例如:在金属和非金属的分界线附近寻找半导体材料,在过渡元素中寻找各种优良的催化剂和耐高温、耐腐蚀的合金材料。 1869年 门捷列夫发表的第一张元素周期表再见!
