元素周期表及其应用(浙江省金华市婺城区)
文档属性
| 名称 | 元素周期表及其应用(浙江省金华市婺城区) |

|
|
| 格式 | rar | ||
| 文件大小 | 592.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-06-18 00:00:00 | ||
图片预览





文档简介
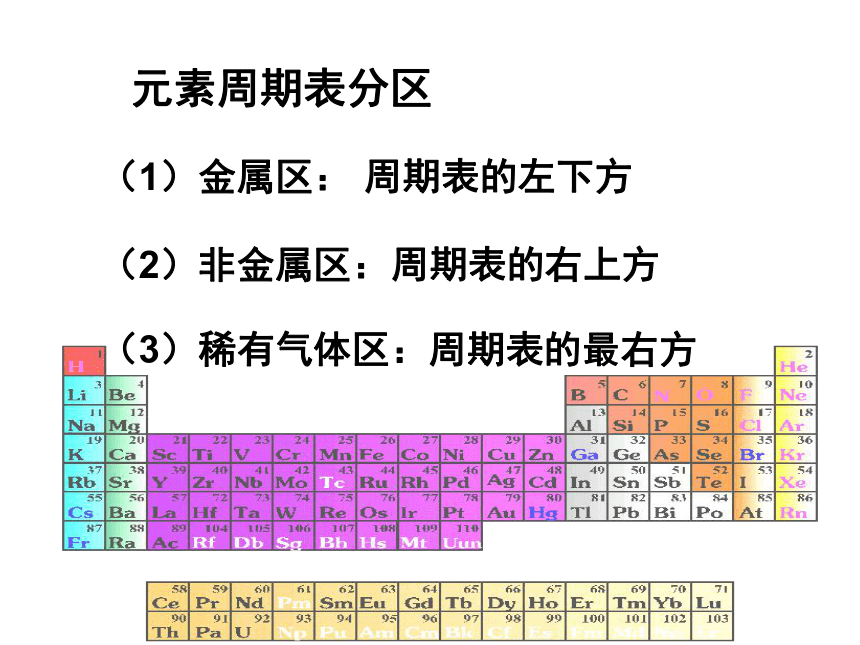
课件15张PPT。元素周期表及其应用元素周期表分区(1)金属区:周期表的左下方(2)非金属区:周期表的右上方(3)稀有气体区:周期表的最右方(二)元素在周期表中的位置与性质的关系1。同周期:11Na 12Mg 13Al 14Si 15P 16S 17Cl ●同周期元素原子核外电子层数相同,
●从左往右,
●核电荷数递增,最外层电子数逐渐增加,
●原子半径逐渐减小,
●核对核外电子的吸引能力逐渐增强,
●失去电子的能力逐渐减弱,金属性减弱,
●得到电子的能力逐渐增大,非金属性增强。(二)元素在周期表中的位置与性质的关系2。同主族:3 Li
11Na
19K
37Rb
55CsLiOH NaOH KOH RbOH CsOH最高价氧化物水化物碱性增强与水反应的剧烈程度增强解释:从上往下,电子层增多,半径增大;
失电子能力增强,金属性增强。(二)元素在周期表中的位置与性质的关系2。同主族:9 F
17Cl
35Br
53I HClO4 HBrO4 HIO4最高价氧化物水化物酸性减弱单质氧化性逐渐减弱解释:从上往下,电子层增多,半径增大;
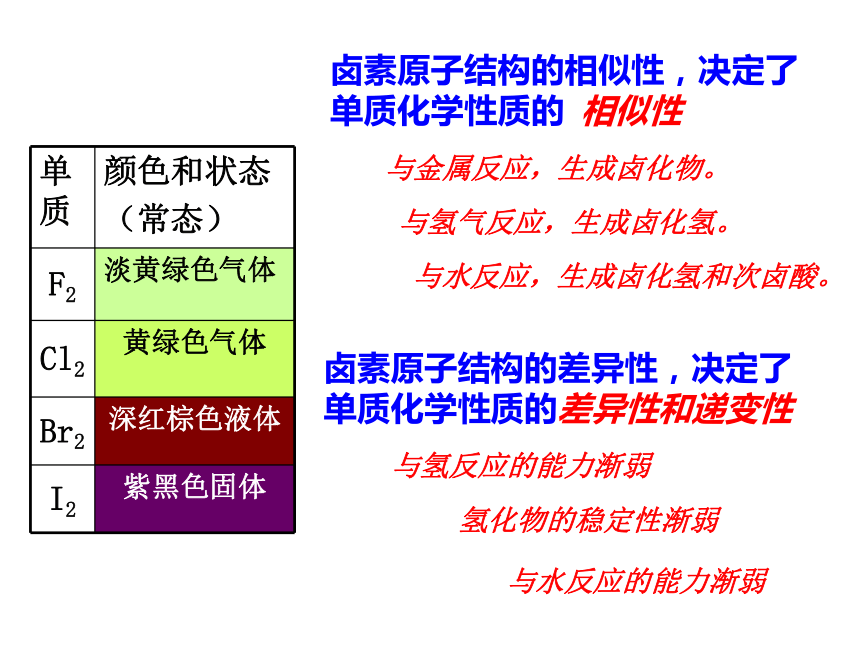
得电子能力减弱,非金属性减弱。卤素原子结构的相似性,决定了单质化学性质的 相似性与金属反应,生成卤化物。与氢气反应,生成卤化氢。与水反应,生成卤化氢和次卤酸。卤素原子结构的差异性,决定了单质化学性质的差异性和递变性与氢反应的能力渐弱氢化物的稳定性渐弱与水反应的能力渐弱1.At是卤族元素中位于碘后面的元素,推测At及它的化合物最不可能具有的性质( )
A、砹与溶于某些有机溶剂
B、砹化氢很稳定,不易分解
C、砹是有色气体
D、砹化银不溶于水或稀硝酸例:BC 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强金属元素与非金属元素渐变界线图相似性递变性1.主要化合价
2.最高价氧化物及其水化物的组成
3.氢化物组成1.金属性与非金属性
2.“水化物”的酸碱性
3.氢化物的稳定性“位”、“构”、“性”理论2.寻找半导体材料3.寻找催化剂、耐高温、耐腐蚀的合金材料1.寻找用于制取农药的元素五、元素周期表的应用元素周期表中元素性质递变规律 大→小小→大电子层数相同、最外层电子增多逐渐减小
逐渐增大逐渐增大
逐渐减小金属性减、非金属性增金属性增、非金属性减最高正价+1→+7最高正价=主族序数 碱性逐渐减弱
酸性逐渐增强碱性逐渐增强
酸性逐渐减弱形成:难→易
稳定性:弱→强 形成:易→难
稳定性:强→弱电子层增多最外层电子数相同3、(05年全国Ⅲ)同一主族的两种元素的原子序数之差不可能是( )
A、16 B、26 C、36 D、462、某周期IIA族元素的原子序数为x,则同周期的IIIA 族元素的原子序数为( )
A、只能是x+2 B、可能是x+8或x+18
C、只能是x+1 D、可能是x+1或x+11或x+25DD四ⅦA45课堂练习:1869年 门捷列夫发表的第一张元素周期表再见!
●从左往右,
●核电荷数递增,最外层电子数逐渐增加,
●原子半径逐渐减小,
●核对核外电子的吸引能力逐渐增强,
●失去电子的能力逐渐减弱,金属性减弱,
●得到电子的能力逐渐增大,非金属性增强。(二)元素在周期表中的位置与性质的关系2。同主族:3 Li
11Na
19K
37Rb
55CsLiOH NaOH KOH RbOH CsOH最高价氧化物水化物碱性增强与水反应的剧烈程度增强解释:从上往下,电子层增多,半径增大;
失电子能力增强,金属性增强。(二)元素在周期表中的位置与性质的关系2。同主族:9 F
17Cl
35Br
53I HClO4 HBrO4 HIO4最高价氧化物水化物酸性减弱单质氧化性逐渐减弱解释:从上往下,电子层增多,半径增大;
得电子能力减弱,非金属性减弱。卤素原子结构的相似性,决定了单质化学性质的 相似性与金属反应,生成卤化物。与氢气反应,生成卤化氢。与水反应,生成卤化氢和次卤酸。卤素原子结构的差异性,决定了单质化学性质的差异性和递变性与氢反应的能力渐弱氢化物的稳定性渐弱与水反应的能力渐弱1.At是卤族元素中位于碘后面的元素,推测At及它的化合物最不可能具有的性质( )
A、砹与溶于某些有机溶剂
B、砹化氢很稳定,不易分解
C、砹是有色气体
D、砹化银不溶于水或稀硝酸例:BC 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强金属元素与非金属元素渐变界线图相似性递变性1.主要化合价
2.最高价氧化物及其水化物的组成
3.氢化物组成1.金属性与非金属性
2.“水化物”的酸碱性
3.氢化物的稳定性“位”、“构”、“性”理论2.寻找半导体材料3.寻找催化剂、耐高温、耐腐蚀的合金材料1.寻找用于制取农药的元素五、元素周期表的应用元素周期表中元素性质递变规律 大→小小→大电子层数相同、最外层电子增多逐渐减小
逐渐增大逐渐增大
逐渐减小金属性减、非金属性增金属性增、非金属性减最高正价+1→+7最高正价=主族序数 碱性逐渐减弱
酸性逐渐增强碱性逐渐增强
酸性逐渐减弱形成:难→易
稳定性:弱→强 形成:易→难
稳定性:强→弱电子层增多最外层电子数相同3、(05年全国Ⅲ)同一主族的两种元素的原子序数之差不可能是( )
A、16 B、26 C、36 D、462、某周期IIA族元素的原子序数为x,则同周期的IIIA 族元素的原子序数为( )
A、只能是x+2 B、可能是x+8或x+18
C、只能是x+1 D、可能是x+1或x+11或x+25DD四ⅦA45课堂练习:1869年 门捷列夫发表的第一张元素周期表再见!
