分子晶体
图片预览







文档简介
课件32张PPT。分子间作用力 分子晶体
分子间作用力说明了物质的分子间存在着作用力这种分子间的作用力又叫做范德瓦耳斯力。 范德瓦耳斯(J.D.van der Waals,1837~1923),荷兰物理学家。他首先研究了分子间作用力,因此,这种力也称为范德瓦耳斯力。气态液态固态降温加压降温分子距离缩短分子距离缩短分子无规则运动分子有规则排列1、分子间作用力:(1)把分子聚集在一起的作用力(范德瓦耳斯力)。分子间存在作用力的事实:
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。一、分子间作用力 1.概念:
将气体分子凝聚成相应的固体或液
体的作用。 3.类型:
常见的分子间作用力:范德华力和氢键 2.实质:
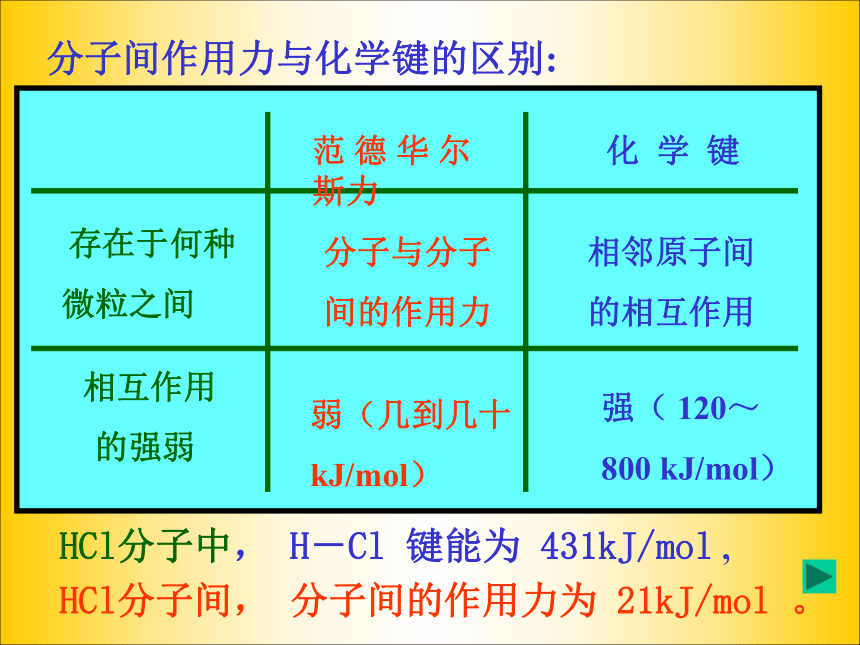
分子间作用力是一种静电作用,但
比化学键弱得多分子与分子
间的作用力相邻原子间
的相互作用弱(几到几十
kJ/mol)强( 120~
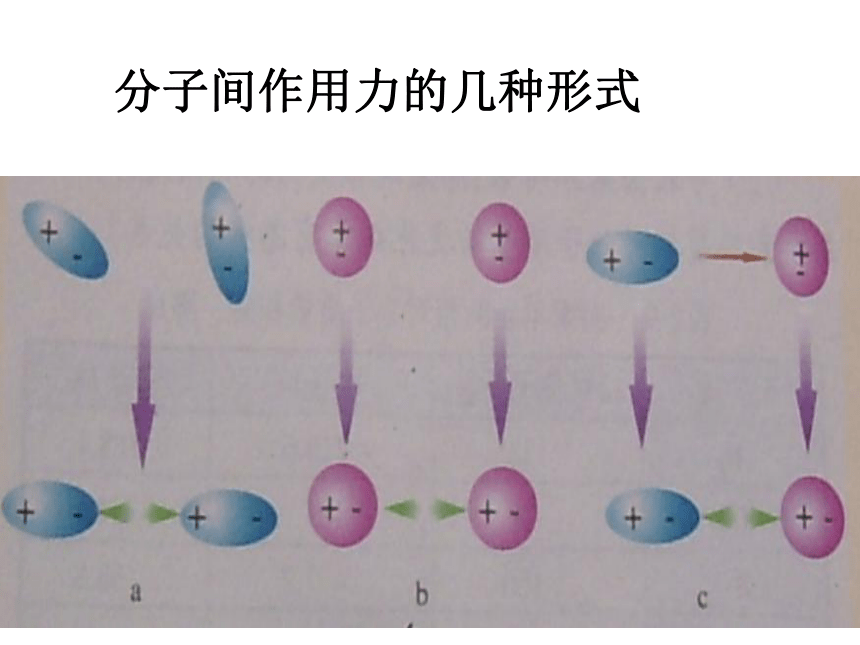
800 kJ/mol)HCl分子中, H-Cl 键能为 431kJ/mol , HCl分子间, 分子间的作用力为 21kJ/mol 。分子间作用力与化学键的区别:分子间作用力的几种形式二、范德华力1.存在:范德华力普遍存在固体、液体、和气体分子间2.方向性与饱和性:范德华力一般没有方向性、饱和性,只要分子周围空间准许,当气体分子凝聚时,它总是尽可能吸引更多的其它分子3.影响范德华力的因素 影响范德华力的因素很多:分子的大小、分子的空间构型、分子中的电荷分布情况 4.范德华力与物质性质的关系 对于分子构成的物质,范德华力影响物质的熔、沸点、溶解度例:氧气在水中的溶解度比氮气大,原因是氧分子与水分子之间的范德华力大交流与讨论:
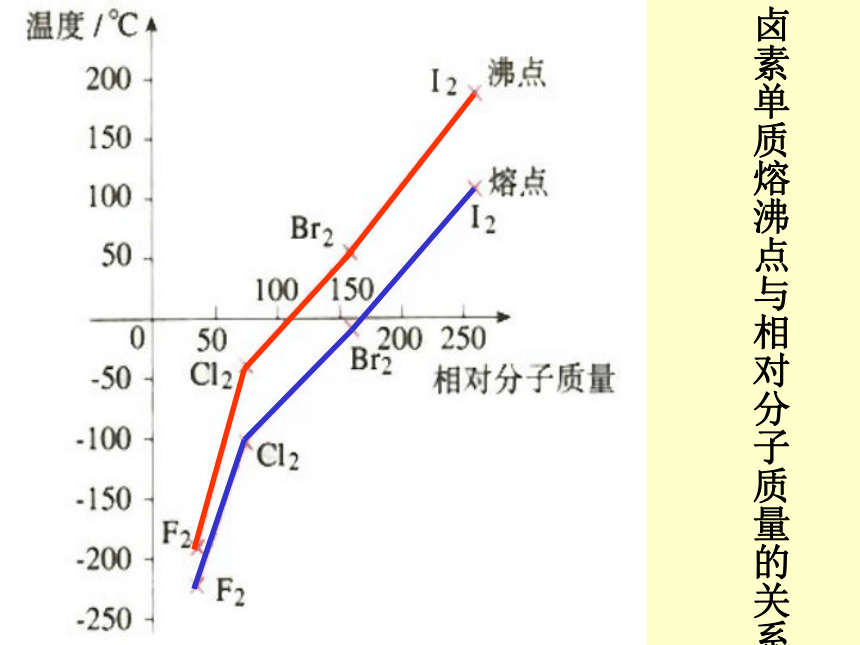
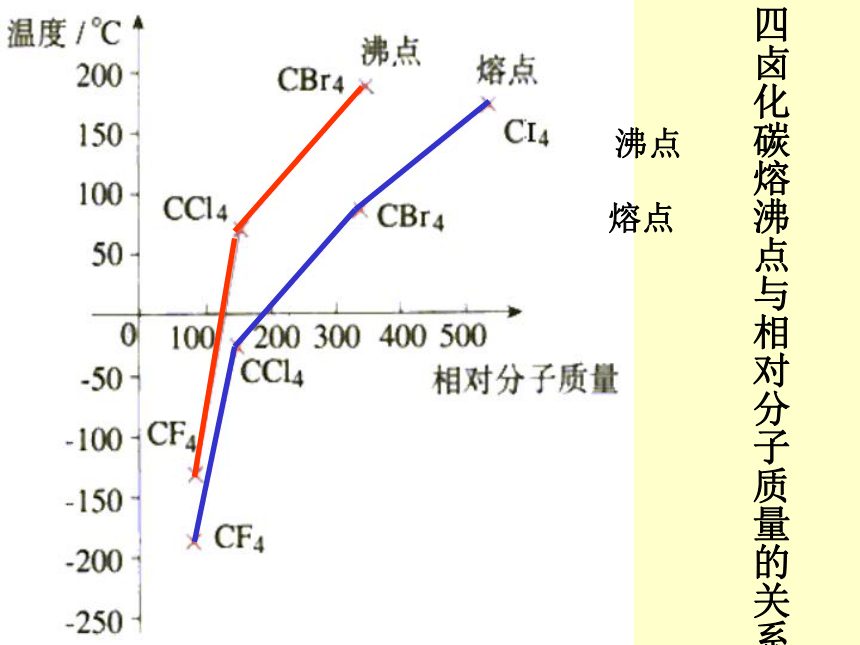
根据卤素单质的熔、沸点的变化规律,分析对物质熔、沸点的影响卤素单质熔沸点与相对分子质量的关系 分子间作用力对物质的熔点、沸点的影响 组成和结构相似的物质,相对分子质量越大,分子间作用力越大,克服分子间引力使物质熔化和气化就需要更多的能量,熔、沸点越高。沸点熔点四卤化碳熔沸点与相对分子质量的关系H2OH2SH2SeH2TeHFHClHBrHINH3PH3AsH3SbH3CH4SiH4GeH4SnH4一些氢化物的沸点三、氢键1.氢键的形成过程在水分子中的O—H中,共用电子对强烈的偏向氧原子,使得氢原子几乎成为 “裸露”的质子,其显正电性,它能与另一个水分子中氧原子的孤电子对产生静电作用,从而形成氢键。水分子间形成的氢键水分子三态与氢键的关系δ+δ- 在HF分子中,由于F原子吸引电子的能力很强,H—F键的极性很强,共用电子对强烈地偏向F原子,亦即H原子的电子云被F原子吸引,使H原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的H核,与另一个HF分子带部分负电荷的F原子相互吸引。这种静电吸引作用就是氢键。 2.氢键的形成条件:氢原子与电负性大而原子半径小的非金属元素原子,如氟、氧、氮原子3.氢键的表示方法:X —— H · · · Y化学键氢键强烈、距离近微弱、距离远X、Y两原子可以相同5.氢键的类型:(1).分子间氢键 (2).分子内氢键F —— H · · · · F —— H 4.氢键的方向性与饱和性:氢键具有方向性与饱和性6.氢键对物质性质的影响 (1).氢键对物质溶、沸点的影响 分子间氢键增大了分子间的作用力使物质的溶、沸点升高。所以对羟基苯甲酸高于邻羟基苯甲酸 (2).氢键物质溶解性的影响 分子间存在氢键使得溶质分子和溶剂分子间的作用力增大,溶质在溶剂中的溶解度增大 。例乙醇与水任意比互溶问题解决:1.氨气极易溶与水2.氟化氢的熔点高于氯化氢3.硝酸的熔点比醋酸低4.水的密度比冰的密度大拓展视野阅读教材P52页:
理解氢键在生命活动中的重要作用(氢键是地球的美容师,描绘着生命的蓝图) 分子晶体1、分子晶体:构成微粒:
微粒间的作用力:(1)定义:分子间通过分子间作用力结合而成晶体。
分子
分子间作用力 (2)、分子晶体特点:有单个分子存在,化学式就是分子式。
熔沸点较低,硬度较小。
熔融状态不导电。
相似相溶。
(4)、物质类别:
大多数共价型的非金属单质和化合物分子,可形成分子晶体。室温下所有的气态物质、易挥发的液体,在一定条件下,都可形成分子晶体。此外,易熔化、易升华的固体也都是分子晶体。如:卤素、氧气、氢气、稀有气体、非金属氢化物、多数非金属氧化物等(3)、共同的物理性质: 一般都是绝缘体,熔融状态也不导电。但极性分子的晶体溶于水可形成水合离子,形成一种导电的溶液。一般硬度较小,具有较低的熔点和沸点,并有较大的挥发性,易溶于非极性溶剂。 二氧化碳晶体结构模型一个晶胞中CO2分子的个数:8×1/8+6×1/2=4干冰的晶体结构图12晶体类型的判断 ◆从组成上判断(仅限于中学范围):
●有无金属离子?(有:离子晶体)
●是否属于“几种原子晶体”?
●以上皆否定,则多数是分子晶体。
◆从性质上判断:
●熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
●熔融状态的导电性。(导电:离子晶体)⑴不同晶体类型的熔沸点比较 一般:原子晶体>离子晶体>分子晶体(有例外) ⑵同种晶体类型物质的熔沸点比较 ①离子晶体: 组成相似的离子晶体离子半径越小、离子电荷数越多熔沸点越高 ②原子晶体: 原子半径越小→键长越短→键能越大熔沸点越高 ③分子晶体: 相对分子质量越大熔沸点越高 组成和结构相似的分子晶体 晶体熔沸点高低的判断◆下列不存在化学键的晶体是:
● A.硝酸钾 B.干冰 C.石墨 D.固体氩
◆常温常压下的分子晶体是:
● A.碘 B.水 C. 硫酸铵 D.干冰
◆下列每组物质发生变化所克服的粒子间相互作用属于同种类型的是:
● A.食盐和蔗糖熔化 B.钠和硫熔化
C.二氧化硅和氧化钠熔化 D.碘和干冰升华课堂练习题
分子间作用力说明了物质的分子间存在着作用力这种分子间的作用力又叫做范德瓦耳斯力。 范德瓦耳斯(J.D.van der Waals,1837~1923),荷兰物理学家。他首先研究了分子间作用力,因此,这种力也称为范德瓦耳斯力。气态液态固态降温加压降温分子距离缩短分子距离缩短分子无规则运动分子有规则排列1、分子间作用力:(1)把分子聚集在一起的作用力(范德瓦耳斯力)。分子间存在作用力的事实:
由分子构成的物质,在一定条件下能发生三态变化,说明分子间存在作用力。一、分子间作用力 1.概念:
将气体分子凝聚成相应的固体或液
体的作用。 3.类型:
常见的分子间作用力:范德华力和氢键 2.实质:
分子间作用力是一种静电作用,但
比化学键弱得多分子与分子
间的作用力相邻原子间
的相互作用弱(几到几十
kJ/mol)强( 120~
800 kJ/mol)HCl分子中, H-Cl 键能为 431kJ/mol , HCl分子间, 分子间的作用力为 21kJ/mol 。分子间作用力与化学键的区别:分子间作用力的几种形式二、范德华力1.存在:范德华力普遍存在固体、液体、和气体分子间2.方向性与饱和性:范德华力一般没有方向性、饱和性,只要分子周围空间准许,当气体分子凝聚时,它总是尽可能吸引更多的其它分子3.影响范德华力的因素 影响范德华力的因素很多:分子的大小、分子的空间构型、分子中的电荷分布情况 4.范德华力与物质性质的关系 对于分子构成的物质,范德华力影响物质的熔、沸点、溶解度例:氧气在水中的溶解度比氮气大,原因是氧分子与水分子之间的范德华力大交流与讨论:
根据卤素单质的熔、沸点的变化规律,分析对物质熔、沸点的影响卤素单质熔沸点与相对分子质量的关系 分子间作用力对物质的熔点、沸点的影响 组成和结构相似的物质,相对分子质量越大,分子间作用力越大,克服分子间引力使物质熔化和气化就需要更多的能量,熔、沸点越高。沸点熔点四卤化碳熔沸点与相对分子质量的关系H2OH2SH2SeH2TeHFHClHBrHINH3PH3AsH3SbH3CH4SiH4GeH4SnH4一些氢化物的沸点三、氢键1.氢键的形成过程在水分子中的O—H中,共用电子对强烈的偏向氧原子,使得氢原子几乎成为 “裸露”的质子,其显正电性,它能与另一个水分子中氧原子的孤电子对产生静电作用,从而形成氢键。水分子间形成的氢键水分子三态与氢键的关系δ+δ- 在HF分子中,由于F原子吸引电子的能力很强,H—F键的极性很强,共用电子对强烈地偏向F原子,亦即H原子的电子云被F原子吸引,使H原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的H核,与另一个HF分子带部分负电荷的F原子相互吸引。这种静电吸引作用就是氢键。 2.氢键的形成条件:氢原子与电负性大而原子半径小的非金属元素原子,如氟、氧、氮原子3.氢键的表示方法:X —— H · · · Y化学键氢键强烈、距离近微弱、距离远X、Y两原子可以相同5.氢键的类型:(1).分子间氢键 (2).分子内氢键F —— H · · · · F —— H 4.氢键的方向性与饱和性:氢键具有方向性与饱和性6.氢键对物质性质的影响 (1).氢键对物质溶、沸点的影响 分子间氢键增大了分子间的作用力使物质的溶、沸点升高。所以对羟基苯甲酸高于邻羟基苯甲酸 (2).氢键物质溶解性的影响 分子间存在氢键使得溶质分子和溶剂分子间的作用力增大,溶质在溶剂中的溶解度增大 。例乙醇与水任意比互溶问题解决:1.氨气极易溶与水2.氟化氢的熔点高于氯化氢3.硝酸的熔点比醋酸低4.水的密度比冰的密度大拓展视野阅读教材P52页:
理解氢键在生命活动中的重要作用(氢键是地球的美容师,描绘着生命的蓝图) 分子晶体1、分子晶体:构成微粒:
微粒间的作用力:(1)定义:分子间通过分子间作用力结合而成晶体。
分子
分子间作用力 (2)、分子晶体特点:有单个分子存在,化学式就是分子式。
熔沸点较低,硬度较小。
熔融状态不导电。
相似相溶。
(4)、物质类别:
大多数共价型的非金属单质和化合物分子,可形成分子晶体。室温下所有的气态物质、易挥发的液体,在一定条件下,都可形成分子晶体。此外,易熔化、易升华的固体也都是分子晶体。如:卤素、氧气、氢气、稀有气体、非金属氢化物、多数非金属氧化物等(3)、共同的物理性质: 一般都是绝缘体,熔融状态也不导电。但极性分子的晶体溶于水可形成水合离子,形成一种导电的溶液。一般硬度较小,具有较低的熔点和沸点,并有较大的挥发性,易溶于非极性溶剂。 二氧化碳晶体结构模型一个晶胞中CO2分子的个数:8×1/8+6×1/2=4干冰的晶体结构图12晶体类型的判断 ◆从组成上判断(仅限于中学范围):
●有无金属离子?(有:离子晶体)
●是否属于“几种原子晶体”?
●以上皆否定,则多数是分子晶体。
◆从性质上判断:
●熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
●熔融状态的导电性。(导电:离子晶体)⑴不同晶体类型的熔沸点比较 一般:原子晶体>离子晶体>分子晶体(有例外) ⑵同种晶体类型物质的熔沸点比较 ①离子晶体: 组成相似的离子晶体离子半径越小、离子电荷数越多熔沸点越高 ②原子晶体: 原子半径越小→键长越短→键能越大熔沸点越高 ③分子晶体: 相对分子质量越大熔沸点越高 组成和结构相似的分子晶体 晶体熔沸点高低的判断◆下列不存在化学键的晶体是:
● A.硝酸钾 B.干冰 C.石墨 D.固体氩
◆常温常压下的分子晶体是:
● A.碘 B.水 C. 硫酸铵 D.干冰
◆下列每组物质发生变化所克服的粒子间相互作用属于同种类型的是:
● A.食盐和蔗糖熔化 B.钠和硫熔化
C.二氧化硅和氧化钠熔化 D.碘和干冰升华课堂练习题
