化学:第二章《化学反应与能量》学案(新人教版必修2)
文档属性
| 名称 | 化学:第二章《化学反应与能量》学案(新人教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 83.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-04 00:00:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第二章 化学反应与能量 复习提纲
第一节 化学能与热能
西关外国语学校
[考点内容]:
1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。
4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
[思考]:
下列属于放热反应的是_②③④⑤_,属于吸热反应的是 ___①⑧⑨_
煅烧石灰石 ②木炭的不完全燃烧 ③炸药爆炸 ④酸与碱的中和反应 ⑤CaO溶于水 ⑥浓硫酸溶于水 ⑦NaOH溶于水 ⑧CO2+C====2CO ⑨Ba(OH)2·8H2O+2NH4Cl==2NH3↑+BaCl2+10H2O
[阅读提纲]:
一、化学键与化学反应中能量变化的关系
(阅读必修二28页第2、3、4段及29页图2-1;选修四 第2页第1段——第3页图1-2)
1.断开化学键吸收能量
1molH2中含有 H—H键,常温常压下使1molH2变为2molH原子断开了 H—H键,需要______ 436KJ的热量。
2.形成化学键放出能量
由2molH原子生成1molH2,有 H—H键生成,生成过程中向外界 436KJ的热量。
小结:形成1molH—H键释放的能量与断开1molH—H键吸收的能量 。
3.化学变化中能量变化的主要原因——微观方面
⑴化学键的 和 是化学反应中能量变化的主要原因。
⑵化学反应的实质是分子的 和原子的 ,用化学键理论可表述为旧化学键的_______ 和新化学键的 。
思考:为什么许多放热反应一开始要加热才能进行呢?
4.反应能量变化的判定——宏观方面 (教材P29页图)
⑴各种物质都储存有 能。
⑵反应物的总能量>生成物的总能量,反应 能量。
⑶反应物的总能量<生成物的总能量,反应 能量。
二、化学能与热能的相互转换
(阅读必修二 29页第1——31页第1段)
1.两条基本的自然定律
⑴质量守恒定律: 。
⑵能量守恒定律: 。
2.放热反应和吸热反应
⑴化学反应中的能量变化,通常主要表现为 的变化——— 或者 。
⑵放热反应(△H____0): 的化学反应 ∑E反应物 ∑E生应物
⑶吸热反应(△H____0): 的化学反应 ∑E反应物 ∑E生应物
(阅读选修四 第1页第1段)
3.吸热反应:列举:
4.放热反应:类型:
5.中和热
(阅读必修二 30页第4段;选修四5页第2段——6页第5段)
(1)定义:在稀溶液中,
(2)测定方法:
思考:(1)环形玻璃棒的作用
(2)烧杯间填满碎泡沫塑料的作用
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”)
6. 燃烧热(阅读选修四8页第2段)
(1)定义:25℃、101KPa时,1mol 物质 燃烧生成 化合物时所放出的热量,叫做该物质的燃烧热。 单位:
三、能源
1.人类利用能源的三个阶段(阅读必修二 32页第1、2、3段)
能源时期→ 能源时期→多能源结构时期
2.能源分类:(阅读必修二34页第4段;选修四 9页第1段——10页第2段)
(1)直接从自然界取得的能源称为 ,如 、 、
、 、 等。经过加工、转换得到的能源称为 ,如 、 等。
(2)化石燃料主要包括 、 、 等,属于 再生能源。
[巩固练习]:
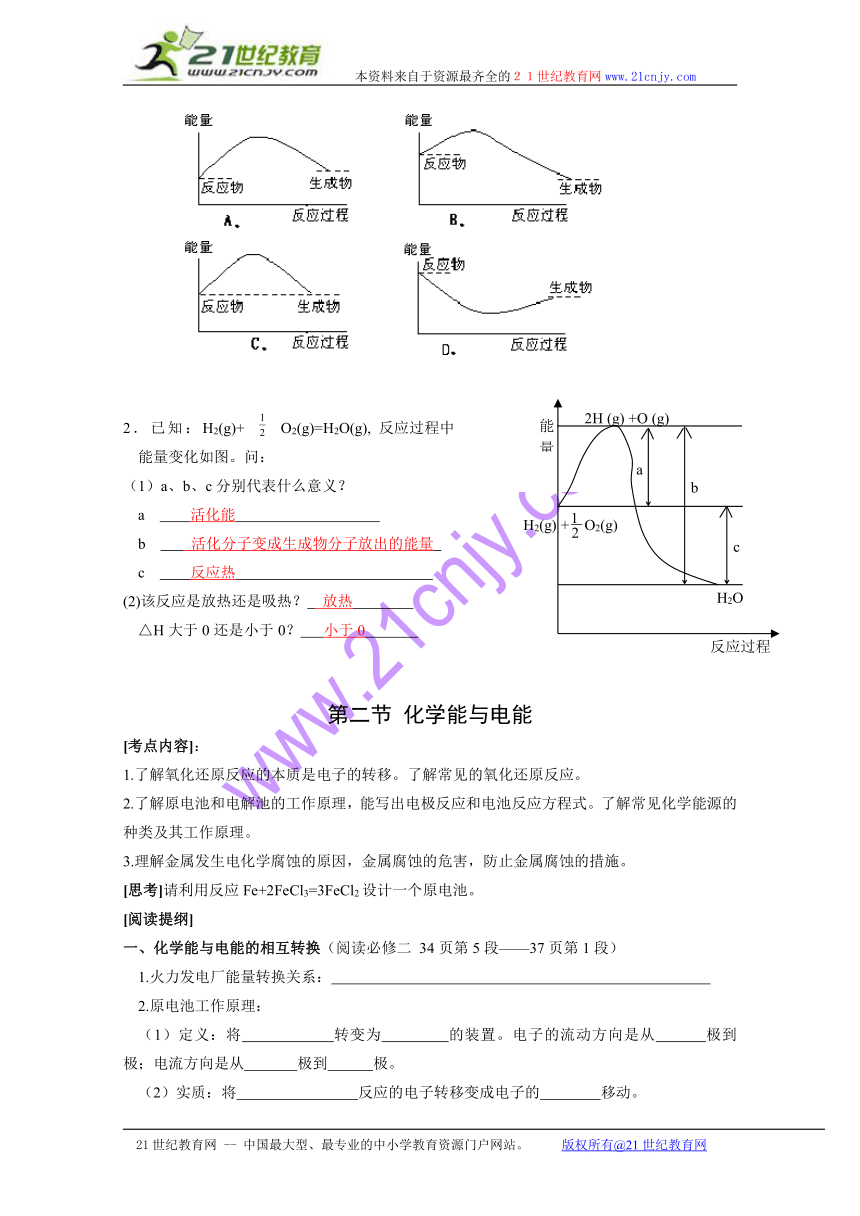
1.下列各图中,表示正反应是吸热反应的图是( A )。
2.已知:H2(g)+ O2(g)=H2O(g), 反应过程中
能量变化如图。问:
(1)a、b、c分别代表什么意义?
a 活化能
b 活化分子变成生成物分子放出的能量
c 反应热
(2)该反应是放热还是吸热? 放热
△H大于0还是小于0? 小于0
第二节 化学能与电能
[考点内容]:
1.了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。
2.了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学能源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
[思考]请利用反应Fe+2FeCl3=3FeCl2设计一个原电池。
[阅读提纲]
一、化学能与电能的相互转换(阅读必修二 34页第5段——37页第1段)
1.火力发电厂能量转换关系:
2.原电池工作原理:
(1)定义:将 转变为 的装置。电子的流动方向是从 极到 极;电流方向是从 极到 极。
(2)实质:将 反应的电子转移变成电子的 移动。
原理:较活泼的金属发生 反应,电子从较活泼的金属( 极)流向 的金属( 极)。
(3)组成原电池的条件:a 有两种 不同的金属作电极(或金属与能 的非金属或化合物)注意:燃料电池中两极可同选石墨或铂
b .有 溶液
c .构成 的回路
d .能 发生氧化还原反应
(阅读选修四76页第1段——77页第6段)
左装置中,插入盐桥时,电流计 ,即 电流通过;取出盐桥时,电流计指针 ,说明 电流通过。说明盐桥起到了使整个装置构成 的作用。该装置的优点为_______________________
二、发展中的化学电池
1. 干电池(一次电池)
(阅读必修二 37页2、3、4、5段;选修四 79页第1段——81页第2段)
(1)普通锌锰电池
人们最早使用的化学电池是 ,它是一种 电池,放完电之后不能再使用( ),正极 ,负极 ,电解质溶液: 淀粉糊
(2)碱性干电池
将普通干电池中的电解质 换成湿 ,并在 上作了改进。
如:普通锌锰电池、碱性锌锰电池、锌银电池、锂电池等。
(1)碱性锌锰电池,电解质是KOH,其电极反应:
负极(Zn):
正极(MnO2):
总反应:
(2)锌银电池的负极是Zn,正极是Ag2O,电解质是KOH,其电极总反应如下:
Zn + Ag2O = ZnO + 2Ag
则:负极( ):
正极( ):
2. 充电电池(二次电池)
(阅读必修二 37页第6段——38页第3段;选修四 81页第3段——82页第2段)
(1)最早使用的充电电池是 ,它在充放电时进行的氧化还原反应是 ,到一定周期终止。它是以 为负极, 为正极,以 为电解质。
(2)镍镉电池以 为负极, 为正极,以 为电解质,其寿命比铅蓄电池____,由于镍镉电池对健康和环境污染比较严重,人们又研制出了 。
(3)人们利用元素周期表中ⅠA族的 金属,制造了新一代可充电的绿色电池 ,其具有 、 、 、 的特点,它广泛成为笔记本电脑、移动电话等低功耗电器的主流电源。
如:铅蓄电池。反应方程式如下式:
Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l)
①其放电电极反应:
负极( ):
正极( ):
②其充电反应是上述反应的逆过程,则电极反应:
(电化学上规定:发生氧化反应的电极为阳极,发生还原反应的电极为阴极)
阴极:
阳极:
3. 燃料电池
(阅读必修二 38页第4段——39页第2段;选修四 82页第3段——83页第2段)
⑴燃料燃烧是一种剧烈的 __ 反应,利用原电池的工作原理将 _ 和 ___ (如 )反应所放出的 直接转变为 ,以提高________________。
⑵燃料电池是一种的 、 的发电装置。
⑶燃料电池如果以氢气为燃料时,产物为 ;以甲烷为燃料时,产物为 和 ,
燃料电池与干电池和蓄电池的主要差别在于反应物不是 ,而是用外加的设备,源源不断地提供_ 和 ,使反应能连续进行。
如:氢氧燃料电池。
①酸性介质时,电极反应:
负极:
正极:
总反应:
②碱性介质时,电极反应:
负极:
正极:
总反应:
除H2外,烃、肼、甲醇、氨、煤气等液体或气体,均可作燃料电池的燃料;除纯氧气外,空气中的氧气也可作氧化剂。
[巩固练习] 航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池反应总式都表示为:2H2+O2=2H2O。酸式氢氧燃料电池的电解质是酸,其负极反应可表示为:2H2-4e=4H+,则其正极反应表示为: O2+4H++4e-=2H2O ; 碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-=40H一,则其负极反应式可表示为: 2H2 + 4OH- - 4e- = 4H2O 。
第三节 化学反应的速率和限度
[考点内容]
1.了解化学反应速率的概念、反应速率的定量表示方法。
2.了解催化剂在生产、生活和科学研究领域中的重大作用。
3.了解化学反应的可逆性。
4.理解外界条件(浓度、温度、压强、催化剂等)对化学反应速率的影响,认识其一般规律。
5.了解化学反应速率和化学平衡的调控在生活、生产和科学领域中的重要作用。
[思考] 在下列事实中,什么因素影响了化学反应速率?
黄铁矿煅烧时要粉碎成细小的矿粒 ( 固体的表面积 )
熔化的KClO3放出气泡很慢,加入少量MnO2后很快产生气体( 催化剂 )
同浓度、同体积的盐酸放入同样大小的锌粒和镁块,产生气体有快有慢( 反应物的性质 )
夏天的食品易变霉,冬天就不易发生该现象( 温度 )
[阅读提纲]:
一、化学反应速率:
(阅读必修二 41页第2段——42页第1段;选修四 19页第1段——20页第4段)
1.定义:用来衡量化学反应进行的快慢程度的一个物理量。
2.表示方法:
3.数学表达式:
4.单位:
5.同一反应,同一时间内,aA+bB=cC+dD ∨A: ∨B: ∨C: ∨D=____________________
6.影响化学反应速率的因素:
(阅读必修二 42页第2段——43页第4段;选修四 22页第1段——26页第2段)
(1)内因:______________________;
(2)外因:浓度越大,反应速率越____;升高温度(任何反应,无论吸热还是放热),______反应速率; 催化剂一般加快反应速率; 有______参加的反应,增大压强,反应速率_____; 固体表面积越大,反应速率_____
;光、反应物的状态、溶剂等。
二、化学反应的限度:
(阅读必修二 44页第3段——44页第4段;选修四 28页第1段——28页第4段)
1.可逆反应进行程度的实验事实:[实验2-7]
现 象 离子方程式
加Na2CO3溶液 有
结论:(1)不少的化学反应都具有 ,即正向反应( → )和逆向反应( → )都能同时进行. 有些反应的可逆性很 ,如Ag++C1=AgCl↓,我们只是视作“ ”而已(AgCl在溶液中仍有极微量的电离:AgCl=Ag++Cl-).
(2)一个化学反应在实际进行时,反应物 按化学方程式中相应物质的计量关系完全转变为生成物.
(3)任何化学反应的进程都有一定的限度,只是不同反应的限度不同罢了.
2.化学反应的限度——化学平衡状态
当一个可逆反应进行到 速率与 速率相等时, 和 的浓度不再改变,达到表面上 的一种“平衡状态”,这就是这个反应所能达到的限度.
注:化学反应限度可以通过改变条件而改变.
3. 化学反应的限度——化学平衡状态的特征
(1)逆:化学平衡研究的对象是_____________________。
(2)动:是指 平衡.达到平衡状态时,正逆反应仍在不断进行,只是 _ 而已.
(3)等:达到平衡状态时, 相等,但不等于零.即≠0。
(4)定:平衡时,各组分的 保持一定,各组成成分的 保持一定.
三、化学反应条件的控制
(阅读必修二 46页第1段——47页第4段;选修四 22页第1段——26页第2段)
1.在生产和生活中,人们希望 有利的化学反应, 有害的化学反应.
2.燃料的燃烧
(1)提高燃料燃烧效率的措施
①尽可能使燃料 ,提高 的转化率.关键是燃料与 或 要尽可能充分地接触,且空气要适当 .
②尽可能充分地利用燃料燃烧所释放出的 ,提高热能的 .
(2)提高燃料的燃烧效率实质上是从多方面控制 (包括 )
它的意义在于_____________、______________、_______________(如煤在气化过程中可以脱硫、除去灰分等)。
3.反应条件的控制
(1)关于人类需要或对人类有利的化学反应
① 反应温度、使用催化剂等 反应速率,以提高生产或工作效率.
②增大某一种 的浓度或增大 的压强,以提高原料的利用率或转化率.
(2)关于有害或人类不需要的化学反应
① 反应温度、使用 等,降低反应速率。
② 会引发反应的物质.如在金属表面形成保护层、森林灭火时制造隔离带等 .
(3)关于特定环境或特殊需要的化学反应,如定向爆破、火箭发射等。则要对反应条件进行 的控制
[巩固练习] 下列各项中,可以说明2HI(g)H2(g)+I2(g)已经达到平衡状态的是(BDE )
A. 单位时间内,生成n mol H2的同时生成n mol HI
B. 一个H—H键断裂的同时,有2个H—I键断裂
C. 温度和体积一定时,容器内压强不再变化
D. 温度和体积一定时,某一生成物浓度不再变化
E. 温度和体积一定时,混合气体的颜色不再变化
F. 条件一定,混合气体的平均相对分子质量不再变化
w.w.w.k.s.5.u.c.o.m
www.
高温
能量
反应过程
a
b
c
2H (g) +O (g)
H2(g) +-O2(g)
1
2
H2O
沿导线
沿导线
放电
充电
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第二章 化学反应与能量 复习提纲
第一节 化学能与热能
西关外国语学校
[考点内容]:
1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算。
4.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
[思考]:
下列属于放热反应的是_②③④⑤_,属于吸热反应的是 ___①⑧⑨_
煅烧石灰石 ②木炭的不完全燃烧 ③炸药爆炸 ④酸与碱的中和反应 ⑤CaO溶于水 ⑥浓硫酸溶于水 ⑦NaOH溶于水 ⑧CO2+C====2CO ⑨Ba(OH)2·8H2O+2NH4Cl==2NH3↑+BaCl2+10H2O
[阅读提纲]:
一、化学键与化学反应中能量变化的关系
(阅读必修二28页第2、3、4段及29页图2-1;选修四 第2页第1段——第3页图1-2)
1.断开化学键吸收能量
1molH2中含有 H—H键,常温常压下使1molH2变为2molH原子断开了 H—H键,需要______ 436KJ的热量。
2.形成化学键放出能量
由2molH原子生成1molH2,有 H—H键生成,生成过程中向外界 436KJ的热量。
小结:形成1molH—H键释放的能量与断开1molH—H键吸收的能量 。
3.化学变化中能量变化的主要原因——微观方面
⑴化学键的 和 是化学反应中能量变化的主要原因。
⑵化学反应的实质是分子的 和原子的 ,用化学键理论可表述为旧化学键的_______ 和新化学键的 。
思考:为什么许多放热反应一开始要加热才能进行呢?
4.反应能量变化的判定——宏观方面 (教材P29页图)
⑴各种物质都储存有 能。
⑵反应物的总能量>生成物的总能量,反应 能量。
⑶反应物的总能量<生成物的总能量,反应 能量。
二、化学能与热能的相互转换
(阅读必修二 29页第1——31页第1段)
1.两条基本的自然定律
⑴质量守恒定律: 。
⑵能量守恒定律: 。
2.放热反应和吸热反应
⑴化学反应中的能量变化,通常主要表现为 的变化——— 或者 。
⑵放热反应(△H____0): 的化学反应 ∑E反应物 ∑E生应物
⑶吸热反应(△H____0): 的化学反应 ∑E反应物 ∑E生应物
(阅读选修四 第1页第1段)
3.吸热反应:列举:
4.放热反应:类型:
5.中和热
(阅读必修二 30页第4段;选修四5页第2段——6页第5段)
(1)定义:在稀溶液中,
(2)测定方法:
思考:(1)环形玻璃棒的作用
(2)烧杯间填满碎泡沫塑料的作用
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”)
6. 燃烧热(阅读选修四8页第2段)
(1)定义:25℃、101KPa时,1mol 物质 燃烧生成 化合物时所放出的热量,叫做该物质的燃烧热。 单位:
三、能源
1.人类利用能源的三个阶段(阅读必修二 32页第1、2、3段)
能源时期→ 能源时期→多能源结构时期
2.能源分类:(阅读必修二34页第4段;选修四 9页第1段——10页第2段)
(1)直接从自然界取得的能源称为 ,如 、 、
、 、 等。经过加工、转换得到的能源称为 ,如 、 等。
(2)化石燃料主要包括 、 、 等,属于 再生能源。
[巩固练习]:
1.下列各图中,表示正反应是吸热反应的图是( A )。
2.已知:H2(g)+ O2(g)=H2O(g), 反应过程中
能量变化如图。问:
(1)a、b、c分别代表什么意义?
a 活化能
b 活化分子变成生成物分子放出的能量
c 反应热
(2)该反应是放热还是吸热? 放热
△H大于0还是小于0? 小于0
第二节 化学能与电能
[考点内容]:
1.了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。
2.了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学能源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
[思考]请利用反应Fe+2FeCl3=3FeCl2设计一个原电池。
[阅读提纲]
一、化学能与电能的相互转换(阅读必修二 34页第5段——37页第1段)
1.火力发电厂能量转换关系:
2.原电池工作原理:
(1)定义:将 转变为 的装置。电子的流动方向是从 极到 极;电流方向是从 极到 极。
(2)实质:将 反应的电子转移变成电子的 移动。
原理:较活泼的金属发生 反应,电子从较活泼的金属( 极)流向 的金属( 极)。
(3)组成原电池的条件:a 有两种 不同的金属作电极(或金属与能 的非金属或化合物)注意:燃料电池中两极可同选石墨或铂
b .有 溶液
c .构成 的回路
d .能 发生氧化还原反应
(阅读选修四76页第1段——77页第6段)
左装置中,插入盐桥时,电流计 ,即 电流通过;取出盐桥时,电流计指针 ,说明 电流通过。说明盐桥起到了使整个装置构成 的作用。该装置的优点为_______________________
二、发展中的化学电池
1. 干电池(一次电池)
(阅读必修二 37页2、3、4、5段;选修四 79页第1段——81页第2段)
(1)普通锌锰电池
人们最早使用的化学电池是 ,它是一种 电池,放完电之后不能再使用( ),正极 ,负极 ,电解质溶液: 淀粉糊
(2)碱性干电池
将普通干电池中的电解质 换成湿 ,并在 上作了改进。
如:普通锌锰电池、碱性锌锰电池、锌银电池、锂电池等。
(1)碱性锌锰电池,电解质是KOH,其电极反应:
负极(Zn):
正极(MnO2):
总反应:
(2)锌银电池的负极是Zn,正极是Ag2O,电解质是KOH,其电极总反应如下:
Zn + Ag2O = ZnO + 2Ag
则:负极( ):
正极( ):
2. 充电电池(二次电池)
(阅读必修二 37页第6段——38页第3段;选修四 81页第3段——82页第2段)
(1)最早使用的充电电池是 ,它在充放电时进行的氧化还原反应是 ,到一定周期终止。它是以 为负极, 为正极,以 为电解质。
(2)镍镉电池以 为负极, 为正极,以 为电解质,其寿命比铅蓄电池____,由于镍镉电池对健康和环境污染比较严重,人们又研制出了 。
(3)人们利用元素周期表中ⅠA族的 金属,制造了新一代可充电的绿色电池 ,其具有 、 、 、 的特点,它广泛成为笔记本电脑、移动电话等低功耗电器的主流电源。
如:铅蓄电池。反应方程式如下式:
Pb (s)+ PbO2(s) +2H2SO4(aq) 2PbSO4(s) +2H2O(l)
①其放电电极反应:
负极( ):
正极( ):
②其充电反应是上述反应的逆过程,则电极反应:
(电化学上规定:发生氧化反应的电极为阳极,发生还原反应的电极为阴极)
阴极:
阳极:
3. 燃料电池
(阅读必修二 38页第4段——39页第2段;选修四 82页第3段——83页第2段)
⑴燃料燃烧是一种剧烈的 __ 反应,利用原电池的工作原理将 _ 和 ___ (如 )反应所放出的 直接转变为 ,以提高________________。
⑵燃料电池是一种的 、 的发电装置。
⑶燃料电池如果以氢气为燃料时,产物为 ;以甲烷为燃料时,产物为 和 ,
燃料电池与干电池和蓄电池的主要差别在于反应物不是 ,而是用外加的设备,源源不断地提供_ 和 ,使反应能连续进行。
如:氢氧燃料电池。
①酸性介质时,电极反应:
负极:
正极:
总反应:
②碱性介质时,电极反应:
负极:
正极:
总反应:
除H2外,烃、肼、甲醇、氨、煤气等液体或气体,均可作燃料电池的燃料;除纯氧气外,空气中的氧气也可作氧化剂。
[巩固练习] 航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池反应总式都表示为:2H2+O2=2H2O。酸式氢氧燃料电池的电解质是酸,其负极反应可表示为:2H2-4e=4H+,则其正极反应表示为: O2+4H++4e-=2H2O ; 碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-=40H一,则其负极反应式可表示为: 2H2 + 4OH- - 4e- = 4H2O 。
第三节 化学反应的速率和限度
[考点内容]
1.了解化学反应速率的概念、反应速率的定量表示方法。
2.了解催化剂在生产、生活和科学研究领域中的重大作用。
3.了解化学反应的可逆性。
4.理解外界条件(浓度、温度、压强、催化剂等)对化学反应速率的影响,认识其一般规律。
5.了解化学反应速率和化学平衡的调控在生活、生产和科学领域中的重要作用。
[思考] 在下列事实中,什么因素影响了化学反应速率?
黄铁矿煅烧时要粉碎成细小的矿粒 ( 固体的表面积 )
熔化的KClO3放出气泡很慢,加入少量MnO2后很快产生气体( 催化剂 )
同浓度、同体积的盐酸放入同样大小的锌粒和镁块,产生气体有快有慢( 反应物的性质 )
夏天的食品易变霉,冬天就不易发生该现象( 温度 )
[阅读提纲]:
一、化学反应速率:
(阅读必修二 41页第2段——42页第1段;选修四 19页第1段——20页第4段)
1.定义:用来衡量化学反应进行的快慢程度的一个物理量。
2.表示方法:
3.数学表达式:
4.单位:
5.同一反应,同一时间内,aA+bB=cC+dD ∨A: ∨B: ∨C: ∨D=____________________
6.影响化学反应速率的因素:
(阅读必修二 42页第2段——43页第4段;选修四 22页第1段——26页第2段)
(1)内因:______________________;
(2)外因:浓度越大,反应速率越____;升高温度(任何反应,无论吸热还是放热),______反应速率; 催化剂一般加快反应速率; 有______参加的反应,增大压强,反应速率_____; 固体表面积越大,反应速率_____
;光、反应物的状态、溶剂等。
二、化学反应的限度:
(阅读必修二 44页第3段——44页第4段;选修四 28页第1段——28页第4段)
1.可逆反应进行程度的实验事实:[实验2-7]
现 象 离子方程式
加Na2CO3溶液 有
结论:(1)不少的化学反应都具有 ,即正向反应( → )和逆向反应( → )都能同时进行. 有些反应的可逆性很 ,如Ag++C1=AgCl↓,我们只是视作“ ”而已(AgCl在溶液中仍有极微量的电离:AgCl=Ag++Cl-).
(2)一个化学反应在实际进行时,反应物 按化学方程式中相应物质的计量关系完全转变为生成物.
(3)任何化学反应的进程都有一定的限度,只是不同反应的限度不同罢了.
2.化学反应的限度——化学平衡状态
当一个可逆反应进行到 速率与 速率相等时, 和 的浓度不再改变,达到表面上 的一种“平衡状态”,这就是这个反应所能达到的限度.
注:化学反应限度可以通过改变条件而改变.
3. 化学反应的限度——化学平衡状态的特征
(1)逆:化学平衡研究的对象是_____________________。
(2)动:是指 平衡.达到平衡状态时,正逆反应仍在不断进行,只是 _ 而已.
(3)等:达到平衡状态时, 相等,但不等于零.即≠0。
(4)定:平衡时,各组分的 保持一定,各组成成分的 保持一定.
三、化学反应条件的控制
(阅读必修二 46页第1段——47页第4段;选修四 22页第1段——26页第2段)
1.在生产和生活中,人们希望 有利的化学反应, 有害的化学反应.
2.燃料的燃烧
(1)提高燃料燃烧效率的措施
①尽可能使燃料 ,提高 的转化率.关键是燃料与 或 要尽可能充分地接触,且空气要适当 .
②尽可能充分地利用燃料燃烧所释放出的 ,提高热能的 .
(2)提高燃料的燃烧效率实质上是从多方面控制 (包括 )
它的意义在于_____________、______________、_______________(如煤在气化过程中可以脱硫、除去灰分等)。
3.反应条件的控制
(1)关于人类需要或对人类有利的化学反应
① 反应温度、使用催化剂等 反应速率,以提高生产或工作效率.
②增大某一种 的浓度或增大 的压强,以提高原料的利用率或转化率.
(2)关于有害或人类不需要的化学反应
① 反应温度、使用 等,降低反应速率。
② 会引发反应的物质.如在金属表面形成保护层、森林灭火时制造隔离带等 .
(3)关于特定环境或特殊需要的化学反应,如定向爆破、火箭发射等。则要对反应条件进行 的控制
[巩固练习] 下列各项中,可以说明2HI(g)H2(g)+I2(g)已经达到平衡状态的是(BDE )
A. 单位时间内,生成n mol H2的同时生成n mol HI
B. 一个H—H键断裂的同时,有2个H—I键断裂
C. 温度和体积一定时,容器内压强不再变化
D. 温度和体积一定时,某一生成物浓度不再变化
E. 温度和体积一定时,混合气体的颜色不再变化
F. 条件一定,混合气体的平均相对分子质量不再变化
w.w.w.k.s.5.u.c.o.m
www.
高温
能量
反应过程
a
b
c
2H (g) +O (g)
H2(g) +-O2(g)
1
2
H2O
沿导线
沿导线
放电
充电
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
