化学:2.1《共价键模型》学案(鲁科版选修3)
文档属性
| 名称 | 化学:2.1《共价键模型》学案(鲁科版选修3) |

|
|
| 格式 | rar | ||
| 文件大小 | 276.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-05 00:00:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第2章 微粒之间的相互作用
第1节 共价键模型
【学习目标】
1、知识与技能目标
使学生理解共价键的概念,初步掌握共价键的形成,加深对电子配对法的理解;能较为熟练地用电子式表示共价分子的形成过程和分子结构;正确判断非极性键和极性键;初步了解键能、键长、键角的概念,能根据其数据认识共价键的强弱。
2、过程与方法目标
(1)通过学生对离子键和共价键的认识与理解,培养学生的抽象思维能力;通过电子式的书写,培养学生的归纳比较能力。
(2)在学习过程中,激发学生的学习兴趣和求知欲。
(3)培养学生从宏观到微观,从现象到本质的认识事物的科学方法。
3、情感态度·价值观目标
(1)通过对共价键形成过程的分析,培养学生怀疑、求实、创新的精神。
(2) 通过观察模拟微观结构的三维动画,增强空间想象能力。
学习重点:
掌握共价键的形成,并能较为熟练地用电子式表示简单共价分子的形成过程。
学习难点:
1、 较复杂的物质电子式和结构式分析。
2、 从微观的角度和三维空间上想象物质的结构。
第1课时
【自主预习提纲】
一、共价键:
(一)定义:原子通过 用电子对 而形成的化学键称为共价键;
(二)共价键的形成及本质:
NaCl、HCl的形成过程
1、共价键的本质是 ;
2、规律:通常,电负性 或 的非金属元素的原子形成的化学键为共价键。
3、表示方法:电子式:是指在符号周围用小点(或×)来描述分子中原子__ __ _ 以及原子中________________________的情况的式子。
(三)共价键分类
1、 按共用电子对的数目分类: 、 、
2、 按共用电子对是否偏移分类: 、
3、按轨道重叠方式不同可分为 键、 键。
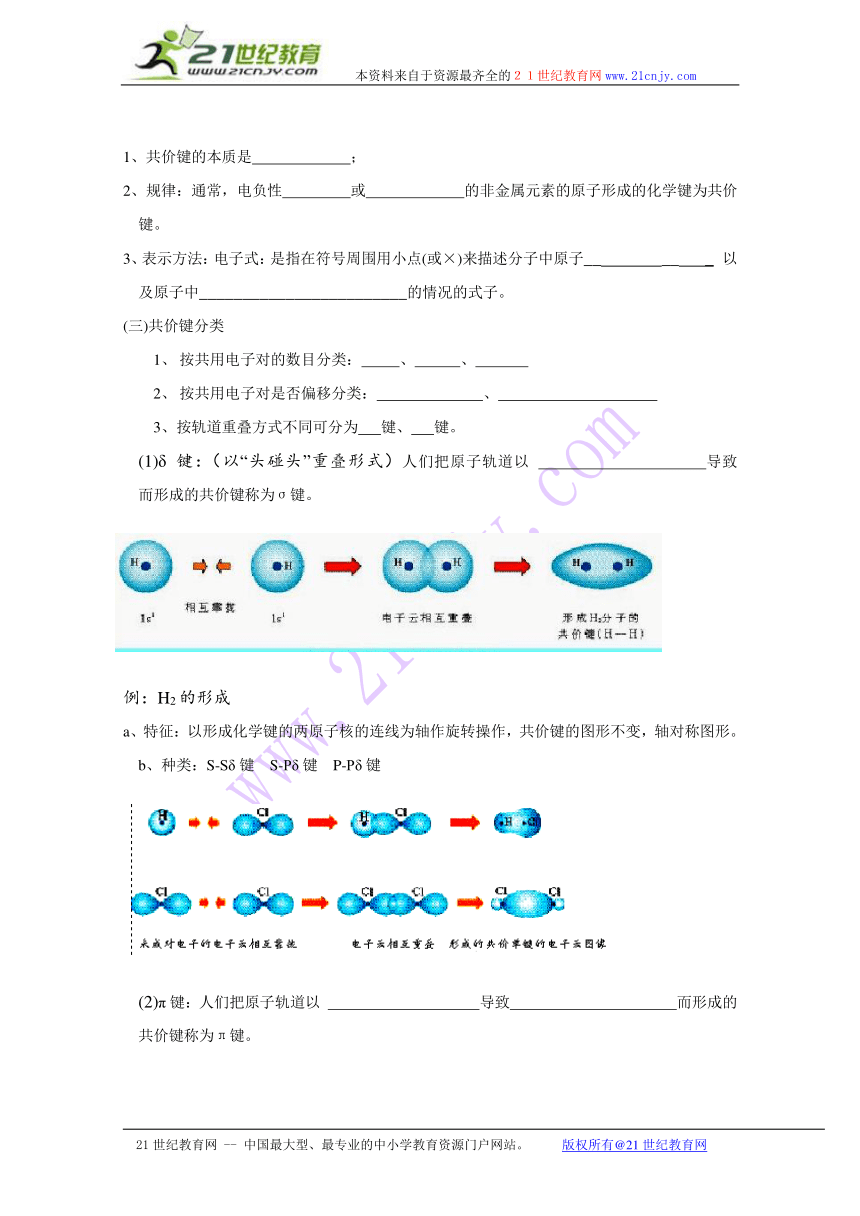
(1)δ键:(以“头碰头”重叠形式)人们把原子轨道以 导致 而形成的共价键称为σ键。
例:H2的形成
a、特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键的图形不变,轴对称图形。
b、种类:S-Sδ键 S-Pδ键 P-Pδ键
(2)π键:人们把原子轨道以 导致 而形成的共价键称为π键。
a.特征:每个π键的电子云有两块组成,分别位于有两原子核构成平面的两侧,如果以它们之间包含原子核的平面镜面,它们互为镜像,这种特征称为镜像对称。
(3)δ键和π键比较
①重叠方式 δ键:头碰头 π键:肩并肩
②δ键比π键的强度较大
③成键电子: δ键 S-S S-P P-P π键 P-P
④δ键成单键 π键成双键、叁键(双键中含有一个δ键和一个π键,叁键中含有一个δ键和两个π键)
⑤在由两个原子形成的多个共价键中,只能有一个 键,而 键可以是一个或多个。
【例题】下列分子中存在π键的是
A.H2 B.Cl2 C.N2 D.HCl
【当堂达标训练】
1.下列关于化学键的说法不正确的是
A.化学键是一种作用力
B.化学键可以是原子间作用力,也可以是离子间作用力
C.化学键存在于分子内部
D.化学键存在于分子之间
2.对δ键的认识不正确的是
A.δ键不属于共价键,是另一种化学键
B.S-Sδ键与S-Pδ键的对称性相同
C.分子中含有共价键,则至少含有一个δ键
D.含有π键的化合物与只含δ键的化合物的化学性质不同
3.下列物质中,属于共价化合物的是
A.I2 B.BaCl2 C.H2SO4 D.NaOH
4.下列化合物中,属于离子化合物的是
A.KNO3 B.BeCl C.KO2 D.H2O2
5.写出下列物质的电子式。
H2、N2、HCl、H2O
6.用电子式表示下列化合物的形成过程
HCl、NaBr、MgF2、Na2S、CO2
第二课时
【自主预习提纲】
一、共价键:
(四).共价键的特征
1、饱和性:因为每个原子所提供的 的数目是一定的,所以在共价键的形成过程中,一个原子的未成对电子与另一个原子中未成对电子配对成键后,,一般不能与其它原子的未成对电子配对成键了,就即每个原子所能 ,这称为共价键的饱和性。显然,共价键的饱和性决定了各种原子形成分子时相结合的 关系。
2、方向性:在形成共价键时, 愈多,电子 愈大,所形成的共价键愈 ,因此共价键尽可能沿着 ,这就是共价键的方向性。共价键的方向性决定了分子的立体空间构型。
二、键参数
1、键能
①概念:气态基态原子形成1mol化学键所释放出的最低能量。
②单位:kJ/mol
③键能越大,形成化学键放出的能量越大,化学键越稳定,越不易断裂。
2、键长21世纪教育网
①概念:形成共价键的两原子间的核间距
②单位:1pm(1pm=10-12m)
③键长越短,共价键越牢固,形成的物质越稳定
几种共价键的键长
H-H 0.74×10-10m C-C 1.54×10-10m
Cl-Cl 1.98×10-10m N-N 1.15×10-10m
3、键角:多原子分子中的两个共价键之间的夹角。
例如:CO2 结构为O=C=O,键角为180°,为直线形分子。
H2O 键角105°V形 CH4 键角109°28′
正四面体
规律总结:在三个键参数中,键能 ,分子越 ;键长越 ,化学键越 。
【当堂达标训练】21世纪教育网
1、下列说法中,错误的是
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越多,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫共价键
2、能够用键能解释的是
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
3、与NO3-互为等电子体的是
A.SO3 B.BF3 C.CH4 D.NO2
4、根据等电子原理,下列分子或离子与SO42-有相似结构的是
A.PCl5 B.CCl4 C.NF3 D.N2
5、根据课本中有关键能的数据,计算下列反应中的能量变化:
N2(g)+3H2(g)====2NH3(g);△H=
2H2(g)+O2(g)===2H2O(g);△H=
21世纪教育网
第二章 第1节 共价键模型习题训练
1.下列各说法中正确的是 ( )
A.分子中键能越高,键长越大,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463KJ/mol,即18克H2O分解成H2和O2时,消耗能量为2×463KJ
2.下列各组指定原子序数的元素,不能形成AB2型共价化合物是 ( )
A.6和8 B.16和8 C.14和8 D.19和17
3.下列过程中,共价键被破坏的是:( )
A.碘晶体升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水
4.下列事实中,能够证明HCl是共价化合物的是 ( )
A.HCl易溶于水 B.液态的HCl不导电
C.HCl不易分解 D.HCl溶于水能电离,呈酸性
5.下列化合物中没有共价键的是( )
A.PBr3 B.IBr C.HBr D.NaBr
6.下列说法中,正确的是 ( )21世纪教育网
A.在N2分子中,两个原子的总键能是单个键能的三倍。
B.N2分子中有一个σ键、两个π键
C.N2分子中有两个个σ键、一个π键
D.N2分子中存在一个σ键、一个π键
7.下列分子中,含有非极性键的化合物的是( )
A.H2 B.CO2 C.H2O D.C2H4
8.下列化合物中价键极性最小是( )
A.MgCl2 B.AlCl3 C.SiCl4 D.PCl5
9.根据化学反应的实质是原化学键的断裂和新化学键的形成这一观点,下列变化不属于化学反应的是 ( )
A.白磷在260℃时可转化成红磷
B.石墨在高温高压下转化成金刚石
C.单质碘发生升华现象
D.硫晶体(S8)加热到一定温度可转变成硫蒸气(S2)
10.下列分子中键能最大的是( )
A.HF B.HCl C.HBr D.HI
11.下列说法中正确的是 ( )
A.双原子分子中化学键键能越大,分子越牢固
B.双原子分子中化学键键长越长,分子越牢固
C.双原子分子中化学键键角越大,分子越牢固
D.在同一分子中,σ键要比π键的分子轨道重叠程度一样多,只是重叠的方向不同
12.CH4、NH3、H2O、HF分子中,共价键的极性由强到弱的顺序是 ( )
A.CH4、NH3、H2O、HF B.HF、H2O、NH3、CH4
C.H2O、HF、CH4、NH3 D.HF、H2O、CH4、NH3
13.下列物质中,含有极性键和非极性键的是 ( )
A.CO2 B.H2O C.Br2 D.H2O2
14.下列单质分子中,键长最长,键能最小的是 ( )
A.H2 B.Cl2 C.Br2 D.I2
15.下列分子中键角最大的是( )
A.CH4 B.NH3 C.H2O D.CO2
16.写出下列物质的电子式:
(1)Cl2 (2)N2 (3)H2O
(4)NH3 (5)CH4 (6)CCl4
17.水分子是H2O而不是H3O,是因为共价键具有 性;水分子的键角接近900是因为共价键具有 性。
18.80年代,科学研制得一种新分子,它具有空心的类似足球状的结构,分子式为C60。下列说法正确的是 ( )
A.C60是一种新型的化合物 B.C60含有极性键
C.C60和金刚石都是碳元素组成的单质 D.C60的相对分子质量是700
19.乙烯分子中C-C之间有 个σ键, 个π键。乙烯易发生加成反应是因为 分子中C-C之间的一个 键易断裂。
20.在HCl分子中,由H原子的一个 轨道与Cl原子的一个 轨道形成一个 键; 在Cl2分子中两个Cl原子以 轨道形成一个 键。
21.在一定条件下,某元素的氢化物X可完全分解为两种单质:Y和Z。若已知:
①反应前的X与反应后生成的Z的物质的量之比
②单质Y的分子为正四面体构型。
请填写下列空白。
(1)单质Y是___________,单质Z是___________(填写名称或分子式)。
(2)Y分子中共含___________个共价键。
(3)X分解为Y和Z的化学方程式为:_____________________ 。
www.
21世纪教育网
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第2章 微粒之间的相互作用
第1节 共价键模型
【学习目标】
1、知识与技能目标
使学生理解共价键的概念,初步掌握共价键的形成,加深对电子配对法的理解;能较为熟练地用电子式表示共价分子的形成过程和分子结构;正确判断非极性键和极性键;初步了解键能、键长、键角的概念,能根据其数据认识共价键的强弱。
2、过程与方法目标
(1)通过学生对离子键和共价键的认识与理解,培养学生的抽象思维能力;通过电子式的书写,培养学生的归纳比较能力。
(2)在学习过程中,激发学生的学习兴趣和求知欲。
(3)培养学生从宏观到微观,从现象到本质的认识事物的科学方法。
3、情感态度·价值观目标
(1)通过对共价键形成过程的分析,培养学生怀疑、求实、创新的精神。
(2) 通过观察模拟微观结构的三维动画,增强空间想象能力。
学习重点:
掌握共价键的形成,并能较为熟练地用电子式表示简单共价分子的形成过程。
学习难点:
1、 较复杂的物质电子式和结构式分析。
2、 从微观的角度和三维空间上想象物质的结构。
第1课时
【自主预习提纲】
一、共价键:
(一)定义:原子通过 用电子对 而形成的化学键称为共价键;
(二)共价键的形成及本质:
NaCl、HCl的形成过程
1、共价键的本质是 ;
2、规律:通常,电负性 或 的非金属元素的原子形成的化学键为共价键。
3、表示方法:电子式:是指在符号周围用小点(或×)来描述分子中原子__ __ _ 以及原子中________________________的情况的式子。
(三)共价键分类
1、 按共用电子对的数目分类: 、 、
2、 按共用电子对是否偏移分类: 、
3、按轨道重叠方式不同可分为 键、 键。
(1)δ键:(以“头碰头”重叠形式)人们把原子轨道以 导致 而形成的共价键称为σ键。
例:H2的形成
a、特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键的图形不变,轴对称图形。
b、种类:S-Sδ键 S-Pδ键 P-Pδ键
(2)π键:人们把原子轨道以 导致 而形成的共价键称为π键。
a.特征:每个π键的电子云有两块组成,分别位于有两原子核构成平面的两侧,如果以它们之间包含原子核的平面镜面,它们互为镜像,这种特征称为镜像对称。
(3)δ键和π键比较
①重叠方式 δ键:头碰头 π键:肩并肩
②δ键比π键的强度较大
③成键电子: δ键 S-S S-P P-P π键 P-P
④δ键成单键 π键成双键、叁键(双键中含有一个δ键和一个π键,叁键中含有一个δ键和两个π键)
⑤在由两个原子形成的多个共价键中,只能有一个 键,而 键可以是一个或多个。
【例题】下列分子中存在π键的是
A.H2 B.Cl2 C.N2 D.HCl
【当堂达标训练】
1.下列关于化学键的说法不正确的是
A.化学键是一种作用力
B.化学键可以是原子间作用力,也可以是离子间作用力
C.化学键存在于分子内部
D.化学键存在于分子之间
2.对δ键的认识不正确的是
A.δ键不属于共价键,是另一种化学键
B.S-Sδ键与S-Pδ键的对称性相同
C.分子中含有共价键,则至少含有一个δ键
D.含有π键的化合物与只含δ键的化合物的化学性质不同
3.下列物质中,属于共价化合物的是
A.I2 B.BaCl2 C.H2SO4 D.NaOH
4.下列化合物中,属于离子化合物的是
A.KNO3 B.BeCl C.KO2 D.H2O2
5.写出下列物质的电子式。
H2、N2、HCl、H2O
6.用电子式表示下列化合物的形成过程
HCl、NaBr、MgF2、Na2S、CO2
第二课时
【自主预习提纲】
一、共价键:
(四).共价键的特征
1、饱和性:因为每个原子所提供的 的数目是一定的,所以在共价键的形成过程中,一个原子的未成对电子与另一个原子中未成对电子配对成键后,,一般不能与其它原子的未成对电子配对成键了,就即每个原子所能 ,这称为共价键的饱和性。显然,共价键的饱和性决定了各种原子形成分子时相结合的 关系。
2、方向性:在形成共价键时, 愈多,电子 愈大,所形成的共价键愈 ,因此共价键尽可能沿着 ,这就是共价键的方向性。共价键的方向性决定了分子的立体空间构型。
二、键参数
1、键能
①概念:气态基态原子形成1mol化学键所释放出的最低能量。
②单位:kJ/mol
③键能越大,形成化学键放出的能量越大,化学键越稳定,越不易断裂。
2、键长21世纪教育网
①概念:形成共价键的两原子间的核间距
②单位:1pm(1pm=10-12m)
③键长越短,共价键越牢固,形成的物质越稳定
几种共价键的键长
H-H 0.74×10-10m C-C 1.54×10-10m
Cl-Cl 1.98×10-10m N-N 1.15×10-10m
3、键角:多原子分子中的两个共价键之间的夹角。
例如:CO2 结构为O=C=O,键角为180°,为直线形分子。
H2O 键角105°V形 CH4 键角109°28′
正四面体
规律总结:在三个键参数中,键能 ,分子越 ;键长越 ,化学键越 。
【当堂达标训练】21世纪教育网
1、下列说法中,错误的是
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越多,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫共价键
2、能够用键能解释的是
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
3、与NO3-互为等电子体的是
A.SO3 B.BF3 C.CH4 D.NO2
4、根据等电子原理,下列分子或离子与SO42-有相似结构的是
A.PCl5 B.CCl4 C.NF3 D.N2
5、根据课本中有关键能的数据,计算下列反应中的能量变化:
N2(g)+3H2(g)====2NH3(g);△H=
2H2(g)+O2(g)===2H2O(g);△H=
21世纪教育网
第二章 第1节 共价键模型习题训练
1.下列各说法中正确的是 ( )
A.分子中键能越高,键长越大,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463KJ/mol,即18克H2O分解成H2和O2时,消耗能量为2×463KJ
2.下列各组指定原子序数的元素,不能形成AB2型共价化合物是 ( )
A.6和8 B.16和8 C.14和8 D.19和17
3.下列过程中,共价键被破坏的是:( )
A.碘晶体升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水
4.下列事实中,能够证明HCl是共价化合物的是 ( )
A.HCl易溶于水 B.液态的HCl不导电
C.HCl不易分解 D.HCl溶于水能电离,呈酸性
5.下列化合物中没有共价键的是( )
A.PBr3 B.IBr C.HBr D.NaBr
6.下列说法中,正确的是 ( )21世纪教育网
A.在N2分子中,两个原子的总键能是单个键能的三倍。
B.N2分子中有一个σ键、两个π键
C.N2分子中有两个个σ键、一个π键
D.N2分子中存在一个σ键、一个π键
7.下列分子中,含有非极性键的化合物的是( )
A.H2 B.CO2 C.H2O D.C2H4
8.下列化合物中价键极性最小是( )
A.MgCl2 B.AlCl3 C.SiCl4 D.PCl5
9.根据化学反应的实质是原化学键的断裂和新化学键的形成这一观点,下列变化不属于化学反应的是 ( )
A.白磷在260℃时可转化成红磷
B.石墨在高温高压下转化成金刚石
C.单质碘发生升华现象
D.硫晶体(S8)加热到一定温度可转变成硫蒸气(S2)
10.下列分子中键能最大的是( )
A.HF B.HCl C.HBr D.HI
11.下列说法中正确的是 ( )
A.双原子分子中化学键键能越大,分子越牢固
B.双原子分子中化学键键长越长,分子越牢固
C.双原子分子中化学键键角越大,分子越牢固
D.在同一分子中,σ键要比π键的分子轨道重叠程度一样多,只是重叠的方向不同
12.CH4、NH3、H2O、HF分子中,共价键的极性由强到弱的顺序是 ( )
A.CH4、NH3、H2O、HF B.HF、H2O、NH3、CH4
C.H2O、HF、CH4、NH3 D.HF、H2O、CH4、NH3
13.下列物质中,含有极性键和非极性键的是 ( )
A.CO2 B.H2O C.Br2 D.H2O2
14.下列单质分子中,键长最长,键能最小的是 ( )
A.H2 B.Cl2 C.Br2 D.I2
15.下列分子中键角最大的是( )
A.CH4 B.NH3 C.H2O D.CO2
16.写出下列物质的电子式:
(1)Cl2 (2)N2 (3)H2O
(4)NH3 (5)CH4 (6)CCl4
17.水分子是H2O而不是H3O,是因为共价键具有 性;水分子的键角接近900是因为共价键具有 性。
18.80年代,科学研制得一种新分子,它具有空心的类似足球状的结构,分子式为C60。下列说法正确的是 ( )
A.C60是一种新型的化合物 B.C60含有极性键
C.C60和金刚石都是碳元素组成的单质 D.C60的相对分子质量是700
19.乙烯分子中C-C之间有 个σ键, 个π键。乙烯易发生加成反应是因为 分子中C-C之间的一个 键易断裂。
20.在HCl分子中,由H原子的一个 轨道与Cl原子的一个 轨道形成一个 键; 在Cl2分子中两个Cl原子以 轨道形成一个 键。
21.在一定条件下,某元素的氢化物X可完全分解为两种单质:Y和Z。若已知:
①反应前的X与反应后生成的Z的物质的量之比
②单质Y的分子为正四面体构型。
请填写下列空白。
(1)单质Y是___________,单质Z是___________(填写名称或分子式)。
(2)Y分子中共含___________个共价键。
(3)X分解为Y和Z的化学方程式为:_____________________ 。
www.
21世纪教育网
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
