化学:1.2《原子结构与元素周期表》学案(鲁科版选修3)
文档属性
| 名称 | 化学:1.2《原子结构与元素周期表》学案(鲁科版选修3) |

|
|
| 格式 | rar | ||
| 文件大小 | 36.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-05 00:00:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第2节 原子结构与元素周期表
【学习目标】
(一)知识与技能:
1、进一步认识周期表中原子结构和位置、价态、元素数目等之间的关系
2、知道外围电子排布和价电子层的涵义
3、认识周期表中各区、周期、族元素的原子核外电子排布的规律
4、知道周期表中各区、周期、族元素的原子结构和位置间的关系
5、掌握原子半径的变化规律
6、进一步认识物质结构与性质之间的关系,提高分析问题和解决问题的能力
(二)过程与方法:
5、理解元素性质的周期性变化与核外电子排布周期性变化的关系
6、复习法、延伸归纳法、讨论法、引导分析法
(三)情感和价值观:了解元素周期表的意义,培养激发学生对化学的兴趣
【学习重点】
1、原子核外电子排布的周期性变化
2、原子结构与元素周期表的关系
3、元素周期表的5个区与族的关系
4、元素的原子半径周期性变化
【学习难点】元素周期表的结构与原子结构的关系
第1课时
【自主预习提纲】
一、基态原子的电子排布
1.基态原子核外电子排布要遵循的三个原则是 、 、 。
2.根据能量最底原理可知:基态原子的核外电子在原子轨道上的排布顺序是1s, , ,3s, , ,3d, , , ,5p, , ,5d, , ,5f,6d,7p,┉。
3.角量子数l相同的能级,其能量次序由主量子数n决定,n值越 ,其能量越 。如E2p E3p E4p E5p。主量子数n相同,角量子数不同的能级,其能量随l的增大而 ,即发生“能级分裂”现象。如E4s E4p E4d E4f。主量子数和角量子数同时变化时,情况较复杂。如E4s E3d E4p,这种现象称为“能级交错”。
4.洪特规则的特例:能级相同的原子轨道中,电子处于 、
或 状态时,体系的能量较低,原子较稳定。
5.泡利不相容原理可简单描述为:一个原子轨道中最多只能容纳______个电子,并且这_____个电子 的自旋方向相_____。
二、19~36号元素的基态原子的核外电子排布
1、熟练写出元素周期表中前36号元素的名称、元素符号和用电子排布式表示1~36号元素原子核外电子的排布。
填表
元素名称 元素符号 原子序数 电子排布式 价电子排布
7
S
氯
铜
Cr
3d64s2
35
2.价电子层:能级上的电子数可在化学反应中发生变化的能层。价电子指的是 ,元素的化学性质与 的性质和数目密切相关。基态铁原子的价电子排布为 。
三、核外电子排布与元素周期表
1、元素周期表共有7个周期,其中有三个短周期,三个长周期和一个不完全周期。根据鲍林看似能级图可以看出一个能级组最多所容纳的电子数等于 ,1-6周期所包含的元素种数分别是 ,第7周期为不完全周期。周期与 有关,即周期数 = 。每周期具有元素的数目分别为2、8、8、18、18、32、26种。
各能级组价电子排布规律为:
一、1s1——1s2 二、2s1——2s22p6 三、3s1——3s23p6
四、4s1 ——4s24p6 五、5s1 ——5s25p6 六、6s1——6s26p6
七、7s1——?
2、元素周期表共有18个纵列,
元素周期表可分为主族、副族和0族:族的划分与原子的 和 密切相关,同族元素的价电子数目 。主族元素的价电子 全部排布在最外层的___或______轨道上,主族元素所在族的序数等于该元素的 数。0族即稀有气体元素(除氦元素外) 原子的最外层电子排布均为___________。副族元素(包括d区和ds区的元素)介于s区元素(主要是金属元素)和p区(主要是非金属元素)之间, 处于由金属元素向非金属元素过渡的区域,因此把副族元素又称为过渡元素。
四、核外电子排布与元素周期表的分区:
1、s区有2个纵列,d区有8个纵列,P区有6个纵列;从元素的价电子层结构可以看出,s区、d区、ds区的元素在发生化学反应时容易失去最外层电子及倒数第二层的d电子,呈现金属性,所以s区、d区、ds区都是金属。
2、S区元素价电子特征排布为nS1~2,价电子数等于族序数。d区元素价电子排布特征为(n-1)d1~10ns1~2;价电子总数等于副族序数;ds区元素特征电子排布为(n-1)d10ns1~2,价电子总数等于所在的列序数;p区元素特征电子排布为ns2np1~6;价电子总数等于主族序数。
【当堂达标训练】
1、元素的分区和族
1) s 区: , 最后的电子填在 上, 包括 , 属于活泼金属, 为碱金属和碱土金属;
2) p区:, 最后的电子填在 上, 包括 族元素, 为非金属和少数金属;
3) d区: , 最后的电子填在 上, 包括 族元素, 为过渡金属;
4) ds区: , (n-1)d全充满, 最后的电子填在 上, 包括 , 过渡金属(d和ds区金属合起来,为过渡金属);
5) f区: HYPERLINK "http://www./" INCLUDEPICTURE "http://chem.jlu./eclass/zyjck/inorchem/class/chpt09/9-83.GIF" \* MERGEFORMATINET , 包括 元素, 称为内过渡元素或内过渡系.
2、外围电子构型为4f75d16s2元素在周期表中的位置是 ( )
A、第四周期ⅦB族 B、第五周期ⅢB族
C、 第六周期ⅦB族 D、 第六周期ⅢB族
3、镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是( )
A、 在化合物中呈+2价 B、单质使水分解、放出氢气
C、 氢氧化物呈两性 D、 碳酸盐难溶于水
4、若将6C原子的电子排布写成1 s22s22p6x它违背了 ( )
A、能量守恒原理 B、能量最低原理
C、泡利不相容原理 D、洪特规则
5、下列叙述中,正确的是 ( )
A、在一个基态多电子原子中,不可能有两个运动状态完全相同的电子
B、在一个基态多电子原子中,不可能有两个能量相同的电子
C、在一个中,M层上的电子能量肯定比L层上的电子能量高
D、某一基态多电子原子的3p亚层上仅有两个电子,它们必然自旋相反
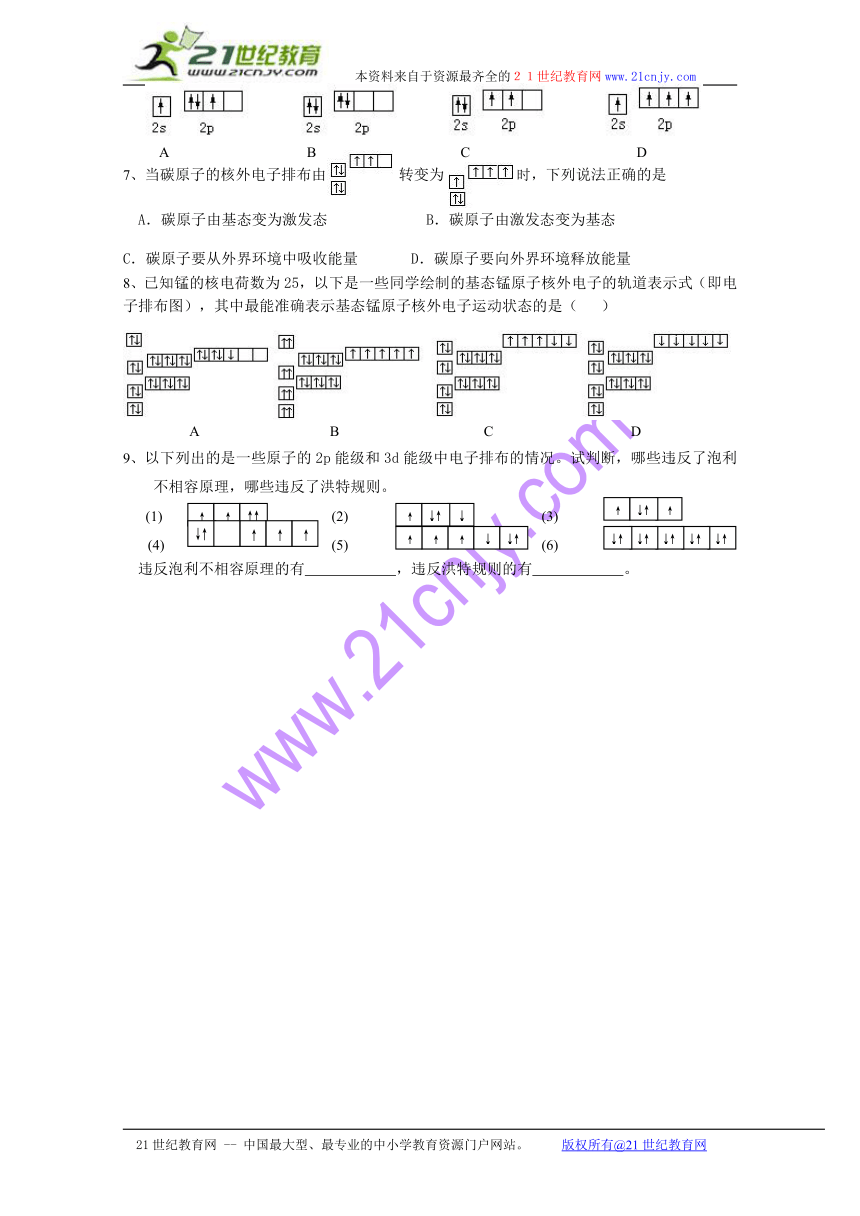
6.基态碳原子的最外能层的各能级中,电子排布的方式正确的是( )
A B C D
7、当碳原子的核外电子排布由 转变为 时,下列说法正确的是
A.碳原子由基态变为激发态 B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量 D.碳原子要向外界环境释放能量
8、已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是( )
A B C D
9、以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
(1) (2) (3)
(4) (5) (6)
违反泡利不相容原理的有 ,违反洪特规则的有 。
第2节 原子结构与元素周期表
第2课时
【自主预习提纲】w.w.w.k.s.5.u.c.o.m
二、核外电子排布与原子半径
1、定义: 。包括共价半径,金属半径,范氏(范德华)半径。
共价半径: 叫该原子的共价半径。
金属半径: 叫做原子的金属半径。
范氏(范德华)半径: 。(稀有气体的原子半径)
在一般的资料里,金属元素有金属半径和共价半径的数据,非金属元素则有共价半径和范氏半径的数据,稀有气体只有范氏半径的数据。
2、原子半径递变规律
(1)同周期主族元素从左到右,原子半径逐渐 。其主要原因是由于核电荷数的增加使原子核对电子的引力增加而带来原子半径 的趋势 于增加电子后电子间斥力增大带来原子半径 的趋势。
(2)同主族元素从上到下,原子半径逐渐 。其主要原因是由于电子层数 ,电子间的斥力使原子半径 。
(5)同一周期的过渡元素,自左到右原子半径的减小幅度越来越小,因为增加的电子都分布在内层d轨道上,它对 与 大致相当,使 的变化幅度不大。
(6)由于元素的金属性和非金属性之间并没有严格的界线,处于非金属三角区边缘的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此,这些元素常被称为半金属或准金属。
【典例分析】w.w.w.k.s.5.u.c.o.m
【例题1】某元素原子共有3个价电子,其中一个价电子的四个量子数为n=3, l=2, m=2, ms=+1/2。试回答:
(1)写出该元素原子核外电子排布式。
(2)指出该元素的原子序数,在周期表中所处的分区、周期数和族序数,是金属还是非金属以及最高正化合价。
【例题2】现有A、B、C、D四种元素,A是第5周期ⅠA族元素,B是第3周期元素。B、C、D的价电子分别为2、2和7个。四种元素原子序数从小到大的顺序是B、C、D、A。已知C和D的次外层电子均为18个。
(1)判断A、B、C、D是什么元素?
(2)写出B、C的核外电子排布及A、D的价电子排布。
(3)写出碱性最强的最高价氧化物的水化物的化学式。
(4)写出酸性最强的最高价氧化物的水化物的化学式。
21世纪教育网
【当堂达标训练】21世纪教育网
1.下列四种元素中,其单质氧化性最强的是 ( )
A.原子含有未成对电子最多的第二周期元素
B.位于周期表中第三周期ⅢA族的元素
C.原子最外电子层排布为2s22p6的元素
D.原子最外电子层排布为3s23P5的元素
2.某元素有6个电子处于n=3,l=2的能级上,根据洪特规则推测它在d轨道上未成对电子数为 ( )
A.3 B.4 C.5 D.2
3.在多电子原子中,各电子具有下列量子数,其中能量最高的电子是 ( )
A. B. C. D.
4.在多电子原子中,轨道能量是由谁决定。 ( )
A. n B. n和m C. n和l D. n、l、m
5.以下元素的原子半径递变规律正确的是( )
A. Be<B<Na<Mg B. B<Be<Mg<Na
C. Be<B<Mg<Na D. B<Be<Na<Mg
6.价电子满足4s和3d为半满的元素是( )
A. Ca B. V C. Cr D.Cu
7.写出下列基态原子的核外电子排布
⑴ 17Cl ;⑵ 24Cr ;
⑶ 34Se ;⑷ 81Tl 。
8.指出下列元素是主族元素还是副族元素?位于周期表中第几周期?第几族?
⑴ 1s22s22p63s23p4 ;(2) [Kr] 4d105s25p2 ;
(3) [Ar] 3d34s2 ; (4) [Ar] 3d104s1 。
9.填写下表w.w.w.k.s.5.u.c.o.m
原子序数 元素符号 电子层排布 周期 族 最高正价 未成对电子数 金属或非金属
9
3 ⅤA
24
5d106s2
10.某元素原子序数为33,则⑴ 此元素原子的电子总数是 ,有 个未成对电子。⑵ 有 个电子层, 个能级, 个原子轨道⑶ 它的价电子排布为 。
11.满足下列条件之一的是哪一族或哪一种元素?21世纪教育网
⑴ 最外层具有6个p电子: 。
⑵ 价电子数是n=4、l=0的轨道上有2个电子和n=3、l=2的轨道上有5个电子: 。
⑶次外层d轨道全满,最外层有一个s电子: 。
⑷ 某元素+3价离子和氩原子的电子排布相同: 。
⑸ 某元素+3价离子的3d轨道半充满: 。
12.设X、Y、Z代表3种元素。已知:①X+和Y-两种离子具有相同的电子层结构; ②Z元素原子核内质子数比Y元素原子核内质子数少9个;
③Y和Z两元素可以形成四核42个电子的负一价阴离子。据此,请填空:
⑴Y元素是 ,Z元素是 。
⑵由X、Y、Z三元素所形成的含68个电子的盐类化合物之化学式是
13.短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:21世纪教育网
(1)A的元素符号 ;D的原子结构示意图 。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是 。
(3)A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中,各原子都满足最外层8电子结构的是 (请填写具体的化学式)
(4)CA2与D元素的单质在水溶液中反应的化学方程式是 。
21世纪教育网
www.
↑
↑
↑
↓↑
↑
↑
↑↑
↑
↑
↓↑
↑
↓
↓↑
↑
↑
↑
↓
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第2节 原子结构与元素周期表
【学习目标】
(一)知识与技能:
1、进一步认识周期表中原子结构和位置、价态、元素数目等之间的关系
2、知道外围电子排布和价电子层的涵义
3、认识周期表中各区、周期、族元素的原子核外电子排布的规律
4、知道周期表中各区、周期、族元素的原子结构和位置间的关系
5、掌握原子半径的变化规律
6、进一步认识物质结构与性质之间的关系,提高分析问题和解决问题的能力
(二)过程与方法:
5、理解元素性质的周期性变化与核外电子排布周期性变化的关系
6、复习法、延伸归纳法、讨论法、引导分析法
(三)情感和价值观:了解元素周期表的意义,培养激发学生对化学的兴趣
【学习重点】
1、原子核外电子排布的周期性变化
2、原子结构与元素周期表的关系
3、元素周期表的5个区与族的关系
4、元素的原子半径周期性变化
【学习难点】元素周期表的结构与原子结构的关系
第1课时
【自主预习提纲】
一、基态原子的电子排布
1.基态原子核外电子排布要遵循的三个原则是 、 、 。
2.根据能量最底原理可知:基态原子的核外电子在原子轨道上的排布顺序是1s, , ,3s, , ,3d, , , ,5p, , ,5d, , ,5f,6d,7p,┉。
3.角量子数l相同的能级,其能量次序由主量子数n决定,n值越 ,其能量越 。如E2p E3p E4p E5p。主量子数n相同,角量子数不同的能级,其能量随l的增大而 ,即发生“能级分裂”现象。如E4s E4p E4d E4f。主量子数和角量子数同时变化时,情况较复杂。如E4s E3d E4p,这种现象称为“能级交错”。
4.洪特规则的特例:能级相同的原子轨道中,电子处于 、
或 状态时,体系的能量较低,原子较稳定。
5.泡利不相容原理可简单描述为:一个原子轨道中最多只能容纳______个电子,并且这_____个电子 的自旋方向相_____。
二、19~36号元素的基态原子的核外电子排布
1、熟练写出元素周期表中前36号元素的名称、元素符号和用电子排布式表示1~36号元素原子核外电子的排布。
填表
元素名称 元素符号 原子序数 电子排布式 价电子排布
7
S
氯
铜
Cr
3d64s2
35
2.价电子层:能级上的电子数可在化学反应中发生变化的能层。价电子指的是 ,元素的化学性质与 的性质和数目密切相关。基态铁原子的价电子排布为 。
三、核外电子排布与元素周期表
1、元素周期表共有7个周期,其中有三个短周期,三个长周期和一个不完全周期。根据鲍林看似能级图可以看出一个能级组最多所容纳的电子数等于 ,1-6周期所包含的元素种数分别是 ,第7周期为不完全周期。周期与 有关,即周期数 = 。每周期具有元素的数目分别为2、8、8、18、18、32、26种。
各能级组价电子排布规律为:
一、1s1——1s2 二、2s1——2s22p6 三、3s1——3s23p6
四、4s1 ——4s24p6 五、5s1 ——5s25p6 六、6s1——6s26p6
七、7s1——?
2、元素周期表共有18个纵列,
元素周期表可分为主族、副族和0族:族的划分与原子的 和 密切相关,同族元素的价电子数目 。主族元素的价电子 全部排布在最外层的___或______轨道上,主族元素所在族的序数等于该元素的 数。0族即稀有气体元素(除氦元素外) 原子的最外层电子排布均为___________。副族元素(包括d区和ds区的元素)介于s区元素(主要是金属元素)和p区(主要是非金属元素)之间, 处于由金属元素向非金属元素过渡的区域,因此把副族元素又称为过渡元素。
四、核外电子排布与元素周期表的分区:
1、s区有2个纵列,d区有8个纵列,P区有6个纵列;从元素的价电子层结构可以看出,s区、d区、ds区的元素在发生化学反应时容易失去最外层电子及倒数第二层的d电子,呈现金属性,所以s区、d区、ds区都是金属。
2、S区元素价电子特征排布为nS1~2,价电子数等于族序数。d区元素价电子排布特征为(n-1)d1~10ns1~2;价电子总数等于副族序数;ds区元素特征电子排布为(n-1)d10ns1~2,价电子总数等于所在的列序数;p区元素特征电子排布为ns2np1~6;价电子总数等于主族序数。
【当堂达标训练】
1、元素的分区和族
1) s 区: , 最后的电子填在 上, 包括 , 属于活泼金属, 为碱金属和碱土金属;
2) p区:, 最后的电子填在 上, 包括 族元素, 为非金属和少数金属;
3) d区: , 最后的电子填在 上, 包括 族元素, 为过渡金属;
4) ds区: , (n-1)d全充满, 最后的电子填在 上, 包括 , 过渡金属(d和ds区金属合起来,为过渡金属);
5) f区: HYPERLINK "http://www./" INCLUDEPICTURE "http://chem.jlu./eclass/zyjck/inorchem/class/chpt09/9-83.GIF" \* MERGEFORMATINET , 包括 元素, 称为内过渡元素或内过渡系.
2、外围电子构型为4f75d16s2元素在周期表中的位置是 ( )
A、第四周期ⅦB族 B、第五周期ⅢB族
C、 第六周期ⅦB族 D、 第六周期ⅢB族
3、镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是( )
A、 在化合物中呈+2价 B、单质使水分解、放出氢气
C、 氢氧化物呈两性 D、 碳酸盐难溶于水
4、若将6C原子的电子排布写成1 s22s22p6x它违背了 ( )
A、能量守恒原理 B、能量最低原理
C、泡利不相容原理 D、洪特规则
5、下列叙述中,正确的是 ( )
A、在一个基态多电子原子中,不可能有两个运动状态完全相同的电子
B、在一个基态多电子原子中,不可能有两个能量相同的电子
C、在一个中,M层上的电子能量肯定比L层上的电子能量高
D、某一基态多电子原子的3p亚层上仅有两个电子,它们必然自旋相反
6.基态碳原子的最外能层的各能级中,电子排布的方式正确的是( )
A B C D
7、当碳原子的核外电子排布由 转变为 时,下列说法正确的是
A.碳原子由基态变为激发态 B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量 D.碳原子要向外界环境释放能量
8、已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的轨道表示式(即电子排布图),其中最能准确表示基态锰原子核外电子运动状态的是( )
A B C D
9、以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
(1) (2) (3)
(4) (5) (6)
违反泡利不相容原理的有 ,违反洪特规则的有 。
第2节 原子结构与元素周期表
第2课时
【自主预习提纲】w.w.w.k.s.5.u.c.o.m
二、核外电子排布与原子半径
1、定义: 。包括共价半径,金属半径,范氏(范德华)半径。
共价半径: 叫该原子的共价半径。
金属半径: 叫做原子的金属半径。
范氏(范德华)半径: 。(稀有气体的原子半径)
在一般的资料里,金属元素有金属半径和共价半径的数据,非金属元素则有共价半径和范氏半径的数据,稀有气体只有范氏半径的数据。
2、原子半径递变规律
(1)同周期主族元素从左到右,原子半径逐渐 。其主要原因是由于核电荷数的增加使原子核对电子的引力增加而带来原子半径 的趋势 于增加电子后电子间斥力增大带来原子半径 的趋势。
(2)同主族元素从上到下,原子半径逐渐 。其主要原因是由于电子层数 ,电子间的斥力使原子半径 。
(5)同一周期的过渡元素,自左到右原子半径的减小幅度越来越小,因为增加的电子都分布在内层d轨道上,它对 与 大致相当,使 的变化幅度不大。
(6)由于元素的金属性和非金属性之间并没有严格的界线,处于非金属三角区边缘的元素既能表现出一定的非金属性,又能表现出一定的金属性,因此,这些元素常被称为半金属或准金属。
【典例分析】w.w.w.k.s.5.u.c.o.m
【例题1】某元素原子共有3个价电子,其中一个价电子的四个量子数为n=3, l=2, m=2, ms=+1/2。试回答:
(1)写出该元素原子核外电子排布式。
(2)指出该元素的原子序数,在周期表中所处的分区、周期数和族序数,是金属还是非金属以及最高正化合价。
【例题2】现有A、B、C、D四种元素,A是第5周期ⅠA族元素,B是第3周期元素。B、C、D的价电子分别为2、2和7个。四种元素原子序数从小到大的顺序是B、C、D、A。已知C和D的次外层电子均为18个。
(1)判断A、B、C、D是什么元素?
(2)写出B、C的核外电子排布及A、D的价电子排布。
(3)写出碱性最强的最高价氧化物的水化物的化学式。
(4)写出酸性最强的最高价氧化物的水化物的化学式。
21世纪教育网
【当堂达标训练】21世纪教育网
1.下列四种元素中,其单质氧化性最强的是 ( )
A.原子含有未成对电子最多的第二周期元素
B.位于周期表中第三周期ⅢA族的元素
C.原子最外电子层排布为2s22p6的元素
D.原子最外电子层排布为3s23P5的元素
2.某元素有6个电子处于n=3,l=2的能级上,根据洪特规则推测它在d轨道上未成对电子数为 ( )
A.3 B.4 C.5 D.2
3.在多电子原子中,各电子具有下列量子数,其中能量最高的电子是 ( )
A. B. C. D.
4.在多电子原子中,轨道能量是由谁决定。 ( )
A. n B. n和m C. n和l D. n、l、m
5.以下元素的原子半径递变规律正确的是( )
A. Be<B<Na<Mg B. B<Be<Mg<Na
C. Be<B<Mg<Na D. B<Be<Na<Mg
6.价电子满足4s和3d为半满的元素是( )
A. Ca B. V C. Cr D.Cu
7.写出下列基态原子的核外电子排布
⑴ 17Cl ;⑵ 24Cr ;
⑶ 34Se ;⑷ 81Tl 。
8.指出下列元素是主族元素还是副族元素?位于周期表中第几周期?第几族?
⑴ 1s22s22p63s23p4 ;(2) [Kr] 4d105s25p2 ;
(3) [Ar] 3d34s2 ; (4) [Ar] 3d104s1 。
9.填写下表w.w.w.k.s.5.u.c.o.m
原子序数 元素符号 电子层排布 周期 族 最高正价 未成对电子数 金属或非金属
9
3 ⅤA
24
5d106s2
10.某元素原子序数为33,则⑴ 此元素原子的电子总数是 ,有 个未成对电子。⑵ 有 个电子层, 个能级, 个原子轨道⑶ 它的价电子排布为 。
11.满足下列条件之一的是哪一族或哪一种元素?21世纪教育网
⑴ 最外层具有6个p电子: 。
⑵ 价电子数是n=4、l=0的轨道上有2个电子和n=3、l=2的轨道上有5个电子: 。
⑶次外层d轨道全满,最外层有一个s电子: 。
⑷ 某元素+3价离子和氩原子的电子排布相同: 。
⑸ 某元素+3价离子的3d轨道半充满: 。
12.设X、Y、Z代表3种元素。已知:①X+和Y-两种离子具有相同的电子层结构; ②Z元素原子核内质子数比Y元素原子核内质子数少9个;
③Y和Z两元素可以形成四核42个电子的负一价阴离子。据此,请填空:
⑴Y元素是 ,Z元素是 。
⑵由X、Y、Z三元素所形成的含68个电子的盐类化合物之化学式是
13.短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:21世纪教育网
(1)A的元素符号 ;D的原子结构示意图 。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是 。
(3)A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中,各原子都满足最外层8电子结构的是 (请填写具体的化学式)
(4)CA2与D元素的单质在水溶液中反应的化学方程式是 。
21世纪教育网
www.
↑
↑
↑
↓↑
↑
↑
↑↑
↑
↑
↓↑
↑
↓
↓↑
↑
↑
↑
↓
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
