化学:第一单元《核外电子排布与周期律》学案(苏教版必修2)
文档属性
| 名称 | 化学:第一单元《核外电子排布与周期律》学案(苏教版必修2) |
|
|
| 格式 | rar | ||
| 文件大小 | 528.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-07 00:00:00 | ||
图片预览




文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
专题1 微观结构与物质的多样性
第一单元 核外电子排布与周期律?
第一课时 核外电子排布
导学园地?
1.原子的构成及核外电子排布
2.原子的表示?
巩固练习
一、选择题
1.请比较题中前后两数值的相对大小。选择A、B、C、D表示前者和后者的关系。原子核外的M电子层和L电子层最多可容纳的电子数( )
A.大于 B.小于 C.等于 D.不能肯定
2.下列粒子中,核外电子数相同的是( )
HYPERLINK "http://www./" EMBED PBrush
A.①②③⑤ B.①②④⑤
C.①②③④ D.②③④⑤
3.下列离子中,所带电荷数与该离子的核外电子层数相等的是( )
A. B.
C. D.
4.下列原子结构示意图中,正确的是( )21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
5.某元素的原子核外有3个电子层,最外层有4个电子,该原子核内的质子数为( )
A.14 B.15
C.16 D.17
6.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A.57
B.47
C.61
D.293
7.下列说法中肯定错误的是( )w.w.w.k.s.5.u.c.o.m
A.某原子K层上只有1个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某离子M层和L层的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
8.核电荷数为1~18的元素中,电子层数和最外层电子数相等的原子( )
A.只有3种 B.只有4种
C.只有1种 D.只有2种
9.有a和b两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
A.b-a=n+m B. a+b=n+m
C.核电荷数YX
10.某元素原子的最外层电子数是次外层电子数的a倍(a>1),则该原子核中的质子数为( )
A.2 a B. a +2
C.2 a +10 D.2 a+2
11.下列微粒结构示意图表示微粒正确的是( )21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
二、非选择题
12.写出下列原子的元素符号:
(1) 某元素原子的最外层电子数是次外层电子数的2倍,该元素是 。
(2) 某元素原子的次外层电子数是最外层电子数的2倍,该元素是 。
(3)某元素原子的最外层电子数与次外层电子数相同,该元素是 。
(4)某元素原子的K层与M层的电子数相同,该元素是 。
13.某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,则该元素的原子结构示意图是 。
14.A元素原子的M层上有6个电子。B元素与A元素的原子核外电子层数相同,B元素原子的最外层上只有1个电子。
(1)A、B两元素形成的化合物的名称是 。21世纪教育网
(2)B离子的结构示意图为 。
15.用A.质子数,B.中子数,C.核外电子数填写下列空格(填序号)。
(1)同位素种类由 决定。
(2)元素种类由 决定。
(3)某元素有无同位素由 决定。
(4)核电荷数由 决定。
16.有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中只有X、Z是金属元素;V和Z元素原子的最外层都只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此推知(填元素符号):
V是 ;W是 ;X是 ;Y是 ;Z是 。
资料卡片
轻松一题: 认识不同电子层与原子核的距离关系,并按能量由低到高的顺序排列各电子层。?
答案: K<L<M<N
自我反馈 ?
导学园地 w.w.w.k.s.5.u.c.o.m
HYPERLINK "http://www./" EMBED PBrush ?
第二课时 元素周期律
导学园地
1.素周期律 ?
(1)随着元素核电荷数的递增,元素原子最外层电子排布呈现[1] 变化。除H、He元素外,最外电子层上的电子数重复出现从[2] 递增到[3] 的变化。
(2)随着元素核电荷数的递增,元素原子半径呈[4] 变化,并且电子层数相同的元素的原子随原子序数的递增,原子半径逐渐[5] 。?
(3)随着元素核电荷数的递增,元素的主要化合价呈现[6] 变化,且一般情况下,重复着最低价从[7] 价逐渐升高到[8] 价,最高价从[9] 价逐渐升高到[10] 价,元素的最高化合价和最低化合价的数值与原子最外层电子数的关系是:最高正价+|最低负价|=[11] 。
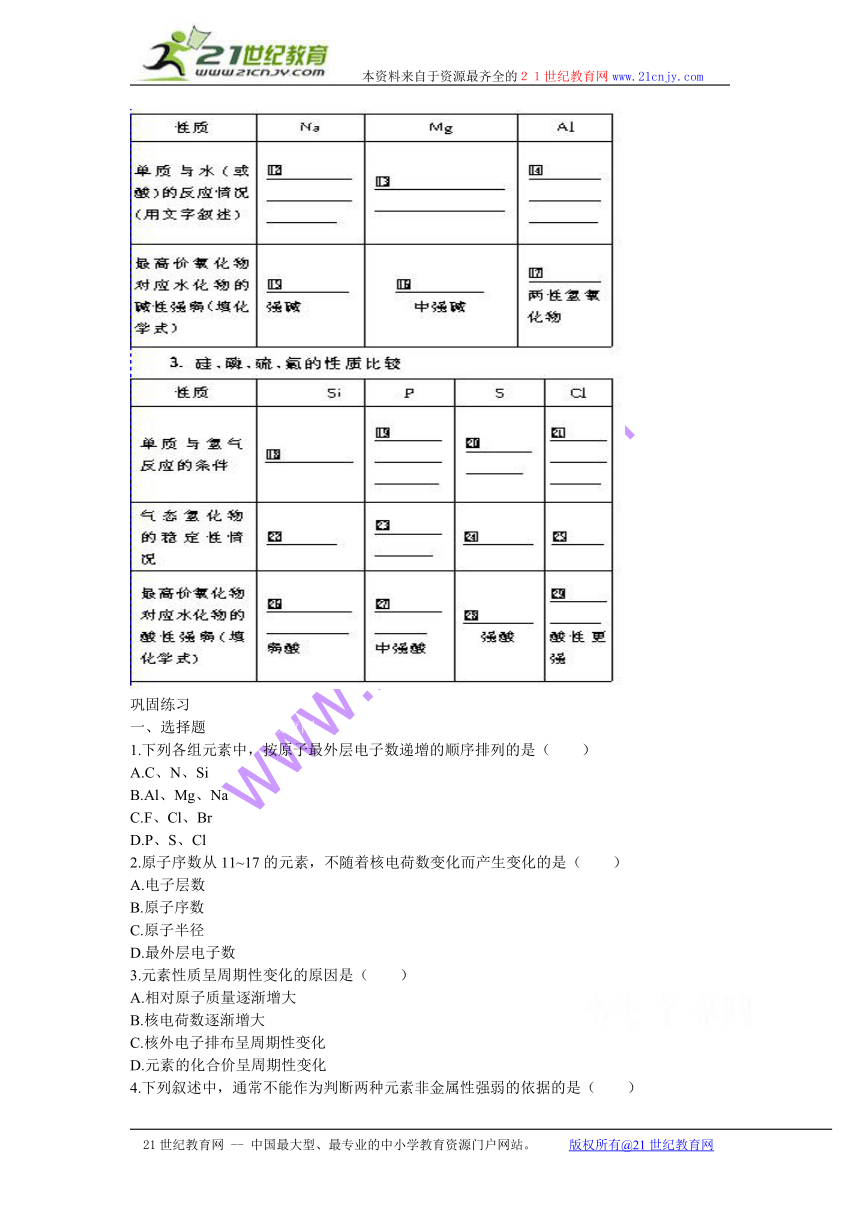
2.钠、镁、铝的性质比较?
HYPERLINK "http://www./" EMBED PBrush
巩固练习
一、选择题 21世纪教育网
1.下列各组元素中,按原子最外层电子数递增的顺序排列的是( )
A.C、N、Si
B.Al、Mg、Na
C.F、Cl、Br
D.P、S、Cl
2.原子序数从11~17的元素,不随着核电荷数变化而产生变化的是( )
A.电子层数
B.原子序数
C.原子半径
D.最外层电子数
3.元素性质呈周期性变化的原因是( )
A.相对原子质量逐渐增大
B.核电荷数逐渐增大
C.核外电子排布呈周期性变化
D.元素的化合价呈周期性变化
4.下列叙述中,通常不能作为判断两种元素非金属性强弱的依据的是( )
A.其气态氢化物稳定性的强弱
B.单质氧化性的强弱
C.其最高价氧化物的水化物的酸性强弱
D.单质熔点的高低
5.气态氢化物按稳定性递增顺序排列的一组是( )21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
6.有三种金属元素a、b、c,在相同条件下,b的最高价氧化物的水化物的碱性比a的最高价氧化物的水化物的碱性强;a可以从c的盐溶液中置换出c。则这三种金属元素的金属性由强到弱的顺序是( ) 21世纪教育网
A.a>b>c
B.b>a>c
C.b>c>a
D.c>b>a
7.下列氧化物按其形成的含氧酸酸性递增的顺序排列正确的是( )
HYPERLINK "http://www./" EMBED PBrush
8.某元素R的原子核外最外层上有5个电子,其最高价含氧酸盐的分子式可以表示为
( )
HYPERLINK "http://www./" EMBED PBrush
9.下列各组中,性质比较正确的是( )
①酸性:
②碱性:
③稳定性:HCl>
④还原性:
A.①②④ B.②③④
C.①②③ D.都正确
10.某主族元素R的最高价氧化物组成是RO x,它的气态氢化物组成是( )
A. B.
C. D.
11.某元素的气态氢化物化学式为RH4,且氢元素的质量分数是25%,则R的最高价氧化物的化学式是( ) w.w.w.k.s.5.u.c.o.m
A.CO B.
C. D.
二、非选择题
12.有A、B、C、D四种元素。A的最高正价与其负价的绝对值之差为6。A、D次外层都是8个电子;A、D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子。B有两个电子层,其最高正价与最低负价的代数和为零。与氖原子具有相同的电子层结构。试写出上述各元素的符号:21世纪教育网
A ,B ,C ,D 。
13.有X、Y、Z、W四种元素,已知X+的核外没有电子,Y原子的最外层电子数是次外层电子数的3倍,Y原子、Z原子和W+的电子层数相同,常见的Z单质是黑色固体,Y、Z、W三种元素可形成ZY2型和W2Y型化合物。填写下列空白:
(1)写出四种元素的符号:X ,Y ,Z ,W 。
(2)写出ZY2与W2Y反应的方程式 。
(3)写出X、Y、W三种元素形成的化合物与ZY2反应的化学方程式 。
14.动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
HYPERLINK "http://www./" EMBED PBrush
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
实验步骤 ① ② ③ ④ ⑤ ⑥
实验现象(填A~F)
① ,
② 。
(4)实验结论:
。
资料卡片21世纪教育网
元素周期律的作用
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下空位。例如,他发现在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。?
门捷列夫还预言了锗的存在和性质,多年后也得到了证实。?
HYPERLINK "http://www./" EMBED PBrush
轻松一题: 思考门捷列夫预测锗的存在和性质是以什么规律为依据??
答案: 元素周期律
自我反馈 ?
导学园地 ?
? HYPERLINK "http://www./" EMBED PBrush
第三课时 元素周期表及其应用
导学园地
1.元素周期表
HYPERLINK "http://www./" EMBED PBrush
2.同周期、同主族元素性质的递变规律21世纪教育网?
同周期?
同周期元素原子核外电子层数相同,随着核电荷数的递增,最外层电子数逐渐[16] ,原子核对核外电子的吸引能力逐渐[17] ,元素的原子得到电子的能力逐渐[18] ,失去电子的能力逐渐[19] 。因此,同一周期的元素,从左到右原子半径逐渐[20] ,元素的金属性[21] ,非金属性[22] 。?
同主族?
同主族元素原子最外层电子数[23] ,随着核电荷数的递增,电子层数逐渐[24] ,原子半径逐渐[25] ,原子核吸引最外层电子的能力逐渐[26] ,原子失去电子的能力逐渐[27] ,得到电子的能力逐渐[28] ,元素金属性逐渐[29] ,非金属性逐渐[30] 。
3.元素金属性和非金属性的递变规律?
+
巩固练习
一、选择题
1.19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说 B.提出分子学说
C.发现元素周期律 D.提出电离学说
2.在元素周期表中,主族元素自ⅢA族的硼到第ⅦA族的砹连一条斜线,此即为金属元素与非金属元素的分界线,从分界线附近可以找到( )
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
3.一般说来,在周期表中的同一主族元素由上至下( )
A.元素单质的金属性越来越弱
B.元素单质的熔、沸点越来越高
C.原子的体积越来越小
D.原子最外层的电子数无变化
4.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
5.下列各表中数字(表示原子序数)所表示的元素与它们在周期表中位置相符的一组是( )
6.下列说法中正确的是( )
A.每一周期的元素都是从碱金属开始,最后以稀有气体结束
B.同一周期中,从左到右,各元素原子的最外层电子数都是从1个逐渐增加到8个
C.第二、三周期上下相邻元素的原子核外电子数相差8个
D.第七周期只有23种元素
7.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是( )
A.HF B.H3O+ C.NaH D.H2O2
8.某含氧酸的分子式为HnRO2n+2,试判断R的最合理价态为( )
A.+5 B.+7 C.+6 D.+4
9.有短周期元素A、B、C,其中A、B为同周期相邻元素,B、C同主族,且最外层电子数之和为17,核电荷数之和为31,则A、B、C为( )
A.C、N、Si B.N、P、O
C.N、O、S D.C、Si、S
10.ⅠA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上周期,当A的原子序数为x时,B的原子序数为( )
A.x-18 B.x -8
C.x +8 D.x +18
11.居里夫人发现的镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
A.在化合物中呈+2价
B.单质能和水剧烈反应,放出氢气
C.氢氧化物呈两性
D.碳酸盐难溶于水
12.短周期元素a、b、c在周期表中位置关系如图所示,则a、b、c三元素的名称是( ) HYPERLINK "http://www./" EMBED PBrush
A.氢、氟、硫 B.氟、硫、砷
C.氦、氟、硫 D.氖、氯、硒
13.碲元素及其化合物最不可能具有的性质是( )
A.碲的氧化物有TeO2和TeO3
B.碲的化合价有-2、+4、+6价
C.碲能与氢气直接化合,且很稳定
D.单质碲为银白色、导电性比硒强的固体
14.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A. x+2 B.x+4 C.x+8 D.x+18
15.在一定条件下与R- 发生如下反应: +5R-+6H+ ==3R2+3H2O,下列关于R的叙述中正确的是( )21世纪教育网
A.R的最外层电子数为5 B.R的氢化物的水溶液属于强酸
C. 中的R只能被还原 D.R2在常温常压下一定是气体
16.下列关于微粒半径的说法正确的是( )
A.电子层数少的元素的原子半径一定小于电子层数多的元素的原子半径
B.核外电子层结构相同的单核微粒半径相同
C.质子数相同的不同单核微粒,电子数越多半径越大
D.原子序数越大,原子半径越大
17.已知a为ⅡA族元素,b为ⅢA族元素,它们的原子序数分别为m和n,且a、b为同一周期元素,下列关系错误的是( )
A. n = m +1 B. n = m+11
C. n = m +25 D. n=m+10
18.若ⅡA族某元素原子序数为x,那么原子序数为x +1的元素可能位于( )
A.ⅢA族 B.ⅠB族
C.ⅡB族 D.Ⅷ族
二、非选择题21世纪教育网
19.A、B、C为短周期元素,在周期表中所处位置如图所示。
A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称: 、 、 。
(2)B位于元素周期表第 周期,第 族。
(3)C的原子结构示意图为 。
(4)比较B、C的原子半径:B C,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式 。
20.现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的最高价氧化物的水化物能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)B和C的元素符号分别为B ,C 。
(2)上述四种元素的原子半径由大到小的顺序(用元素符号表示)为 。
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为 。
(4)写出B元素在周期表中的位置 。
(5)写出C的最高价氧化物的水化物分别跟B和D的最高价氧化物的水化物反应的方程式 。
21.A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为:,B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为 。
(3)B和C最高价氧化物的水化物化学式分别为 和 。
22.制冷剂是易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾采用过乙醚、NH3、CH3Cl等作制冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 > >H2O>HF;第三周期SiH4>PH3>H2S>HCl。
(2)化合物的毒性:PH3>NH3;H2S H2O; CS2 CO2;CCl4>CF4(选填“>”“<”或“=”)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8 ℃,CF4的沸点为?-128 ℃?,新的制冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的制冷剂氟利昂CF2Cl2终于诞生了,其他类似的还可以是 。
(4)然而,这种制冷剂造成了当今的某一环境问题,是 ,但求助于周期表中元素及其化合物的 变化趋势来开发制冷剂的科学思维方法是值得借鉴的(填写字母)。
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
a.①②③ b.②④⑤ c.②③④
23.A、B两元素,A的原子序数为x,A和B所在周期的元素种类总数分别是m和n。
(1)如果A和B同在第ⅠA族,当B在A的上一周期时,B的原子序数为 ,当B在A的下一周期时,B的原子序数为 。
(2)如果A和B同在第ⅦA族,当B在A的上一周期时,B的原子序数为 ,当B在A的下一周期时,B的原子序数为 。
资料卡片
元素周期表发展的远景?
元素周期表中的元素已经编排到112号,元素周期表还能不能延长?根据现有的理论计算第7周期应有32种元素,至118号元素结束。?
第8周期应有50种元素,至168号。同理,第9周期也应有50种元素,至218号。?
有趣的是,有些科学家还提出元素周期表还可以向负方向发展,这是由于发现了正电子、负质子(反质子)。在其他星球上是否存在由这些反质子和正电子以及中子组成的反原子呢?这种观点若能被实践证实,周期表当然可以出现原子核带负电荷的反元素,向负方向发展也就顺理成章了。?
轻松一题: 试写出由负质子、正电子构成的反氢离子、反氢氧根离子的中和反应方程式。 答案: H-+OH+ ==H2O
自我反馈 ?
导学园地 ?
参 考 答 案
第一课时 核外电子排布
巩固练习
1.A 2.A 3.B 4.B 5.A 6.A 7.B 8.A 9.C 10.D 11.A
12.(1)C (2)Li或Si (3)Be或Ar (4)Mg
14.(1)硫化钠
15.(1)A、B (2)A (3)B (4)A
16.H O Al S K
第二课时 元素周期律
巩固练习1.D 2.A 3.C 4.D 5.B 6.B 7.B 8.C 9.C 10.C 11.B
12.Cl C O K
13.(1)H O C Na
(2)CO2+Na2O==Na2CO3
(3)2NaOH+CO2==Na2CO3+H2O(或NaOH+CO2==NaHCO3)
14.(1)同周期 (2)烧杯 试管 酒精灯
(3)
①Mg+2H2OM==g(OH)2+H2↑
②Na2S+Cl2==2NaCl+S↓
(4)金属性:Na>Mg>Al;非金属性:Cl>S
第三课时 元素周期表及其应用
巩固练习
1.C 2.C 3.D 4.D 5.D 6.C 7.C 8.B 9.C 10.B 11.C 12.C 13.C 14.B 15.B 16.C 17.D 18.A
19.(1)氮 硫 氟 (2)三 ⅥA
(4)> 2NH3+H2SO4==(NH4)2SO4(或NH3+H2SO4==NH4HSO4)
20.(1)S Al (2)Na>Al>S>O (3)2Na2O2+2CO22Na2CO3+O2 (4)第三周期ⅥA族
(5)Al(OH)3+NaOH==NaAlO2+2H2O、2Al(OH)3+3H2SO4==Al2(SO4)3+6H2O
21.(1)硅 SiH4 (2)N22.(1)CH4 NH3 (2)> > (3)CFCl3(或CF3Cl) (4)使大气臭氧层出现空洞 a
23.(1)x-n x+m (2)x-m x+n
w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
专题1 微观结构与物质的多样性
第一单元 核外电子排布与周期律?
第一课时 核外电子排布
导学园地?
1.原子的构成及核外电子排布
2.原子的表示?
巩固练习
一、选择题
1.请比较题中前后两数值的相对大小。选择A、B、C、D表示前者和后者的关系。原子核外的M电子层和L电子层最多可容纳的电子数( )
A.大于 B.小于 C.等于 D.不能肯定
2.下列粒子中,核外电子数相同的是( )
HYPERLINK "http://www./" EMBED PBrush
A.①②③⑤ B.①②④⑤
C.①②③④ D.②③④⑤
3.下列离子中,所带电荷数与该离子的核外电子层数相等的是( )
A. B.
C. D.
4.下列原子结构示意图中,正确的是( )21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
5.某元素的原子核外有3个电子层,最外层有4个电子,该原子核内的质子数为( )
A.14 B.15
C.16 D.17
6.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A.57
B.47
C.61
D.293
7.下列说法中肯定错误的是( )w.w.w.k.s.5.u.c.o.m
A.某原子K层上只有1个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某离子M层和L层的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
8.核电荷数为1~18的元素中,电子层数和最外层电子数相等的原子( )
A.只有3种 B.只有4种
C.只有1种 D.只有2种
9.有a和b两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
A.b-a=n+m B. a+b=n+m
C.核电荷数Y
10.某元素原子的最外层电子数是次外层电子数的a倍(a>1),则该原子核中的质子数为( )
A.2 a B. a +2
C.2 a +10 D.2 a+2
11.下列微粒结构示意图表示微粒正确的是( )21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
二、非选择题
12.写出下列原子的元素符号:
(1) 某元素原子的最外层电子数是次外层电子数的2倍,该元素是 。
(2) 某元素原子的次外层电子数是最外层电子数的2倍,该元素是 。
(3)某元素原子的最外层电子数与次外层电子数相同,该元素是 。
(4)某元素原子的K层与M层的电子数相同,该元素是 。
13.某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,则该元素的原子结构示意图是 。
14.A元素原子的M层上有6个电子。B元素与A元素的原子核外电子层数相同,B元素原子的最外层上只有1个电子。
(1)A、B两元素形成的化合物的名称是 。21世纪教育网
(2)B离子的结构示意图为 。
15.用A.质子数,B.中子数,C.核外电子数填写下列空格(填序号)。
(1)同位素种类由 决定。
(2)元素种类由 决定。
(3)某元素有无同位素由 决定。
(4)核电荷数由 决定。
16.有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中只有X、Z是金属元素;V和Z元素原子的最外层都只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此推知(填元素符号):
V是 ;W是 ;X是 ;Y是 ;Z是 。
资料卡片
轻松一题: 认识不同电子层与原子核的距离关系,并按能量由低到高的顺序排列各电子层。?
答案: K<L<M<N
自我反馈 ?
导学园地 w.w.w.k.s.5.u.c.o.m
HYPERLINK "http://www./" EMBED PBrush ?
第二课时 元素周期律
导学园地
1.素周期律 ?
(1)随着元素核电荷数的递增,元素原子最外层电子排布呈现[1] 变化。除H、He元素外,最外电子层上的电子数重复出现从[2] 递增到[3] 的变化。
(2)随着元素核电荷数的递增,元素原子半径呈[4] 变化,并且电子层数相同的元素的原子随原子序数的递增,原子半径逐渐[5] 。?
(3)随着元素核电荷数的递增,元素的主要化合价呈现[6] 变化,且一般情况下,重复着最低价从[7] 价逐渐升高到[8] 价,最高价从[9] 价逐渐升高到[10] 价,元素的最高化合价和最低化合价的数值与原子最外层电子数的关系是:最高正价+|最低负价|=[11] 。
2.钠、镁、铝的性质比较?
HYPERLINK "http://www./" EMBED PBrush
巩固练习
一、选择题 21世纪教育网
1.下列各组元素中,按原子最外层电子数递增的顺序排列的是( )
A.C、N、Si
B.Al、Mg、Na
C.F、Cl、Br
D.P、S、Cl
2.原子序数从11~17的元素,不随着核电荷数变化而产生变化的是( )
A.电子层数
B.原子序数
C.原子半径
D.最外层电子数
3.元素性质呈周期性变化的原因是( )
A.相对原子质量逐渐增大
B.核电荷数逐渐增大
C.核外电子排布呈周期性变化
D.元素的化合价呈周期性变化
4.下列叙述中,通常不能作为判断两种元素非金属性强弱的依据的是( )
A.其气态氢化物稳定性的强弱
B.单质氧化性的强弱
C.其最高价氧化物的水化物的酸性强弱
D.单质熔点的高低
5.气态氢化物按稳定性递增顺序排列的一组是( )21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
6.有三种金属元素a、b、c,在相同条件下,b的最高价氧化物的水化物的碱性比a的最高价氧化物的水化物的碱性强;a可以从c的盐溶液中置换出c。则这三种金属元素的金属性由强到弱的顺序是( ) 21世纪教育网
A.a>b>c
B.b>a>c
C.b>c>a
D.c>b>a
7.下列氧化物按其形成的含氧酸酸性递增的顺序排列正确的是( )
HYPERLINK "http://www./" EMBED PBrush
8.某元素R的原子核外最外层上有5个电子,其最高价含氧酸盐的分子式可以表示为
( )
HYPERLINK "http://www./" EMBED PBrush
9.下列各组中,性质比较正确的是( )
①酸性:
②碱性:
③稳定性:HCl>
④还原性:
A.①②④ B.②③④
C.①②③ D.都正确
10.某主族元素R的最高价氧化物组成是RO x,它的气态氢化物组成是( )
A. B.
C. D.
11.某元素的气态氢化物化学式为RH4,且氢元素的质量分数是25%,则R的最高价氧化物的化学式是( ) w.w.w.k.s.5.u.c.o.m
A.CO B.
C. D.
二、非选择题
12.有A、B、C、D四种元素。A的最高正价与其负价的绝对值之差为6。A、D次外层都是8个电子;A、D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子。B有两个电子层,其最高正价与最低负价的代数和为零。与氖原子具有相同的电子层结构。试写出上述各元素的符号:21世纪教育网
A ,B ,C ,D 。
13.有X、Y、Z、W四种元素,已知X+的核外没有电子,Y原子的最外层电子数是次外层电子数的3倍,Y原子、Z原子和W+的电子层数相同,常见的Z单质是黑色固体,Y、Z、W三种元素可形成ZY2型和W2Y型化合物。填写下列空白:
(1)写出四种元素的符号:X ,Y ,Z ,W 。
(2)写出ZY2与W2Y反应的方程式 。
(3)写出X、Y、W三种元素形成的化合物与ZY2反应的化学方程式 。
14.动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
HYPERLINK "http://www./" EMBED PBrush
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等。
仪器:① ,② ,③ ,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
实验步骤 ① ② ③ ④ ⑤ ⑥
实验现象(填A~F)
① ,
② 。
(4)实验结论:
。
资料卡片21世纪教育网
元素周期律的作用
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下空位。例如,他发现在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。?
门捷列夫还预言了锗的存在和性质,多年后也得到了证实。?
HYPERLINK "http://www./" EMBED PBrush
轻松一题: 思考门捷列夫预测锗的存在和性质是以什么规律为依据??
答案: 元素周期律
自我反馈 ?
导学园地 ?
? HYPERLINK "http://www./" EMBED PBrush
第三课时 元素周期表及其应用
导学园地
1.元素周期表
HYPERLINK "http://www./" EMBED PBrush
2.同周期、同主族元素性质的递变规律21世纪教育网?
同周期?
同周期元素原子核外电子层数相同,随着核电荷数的递增,最外层电子数逐渐[16] ,原子核对核外电子的吸引能力逐渐[17] ,元素的原子得到电子的能力逐渐[18] ,失去电子的能力逐渐[19] 。因此,同一周期的元素,从左到右原子半径逐渐[20] ,元素的金属性[21] ,非金属性[22] 。?
同主族?
同主族元素原子最外层电子数[23] ,随着核电荷数的递增,电子层数逐渐[24] ,原子半径逐渐[25] ,原子核吸引最外层电子的能力逐渐[26] ,原子失去电子的能力逐渐[27] ,得到电子的能力逐渐[28] ,元素金属性逐渐[29] ,非金属性逐渐[30] 。
3.元素金属性和非金属性的递变规律?
+
巩固练习
一、选择题
1.19世纪中叶,门捷列夫的突出贡献是( )
A.提出原子学说 B.提出分子学说
C.发现元素周期律 D.提出电离学说
2.在元素周期表中,主族元素自ⅢA族的硼到第ⅦA族的砹连一条斜线,此即为金属元素与非金属元素的分界线,从分界线附近可以找到( )
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
3.一般说来,在周期表中的同一主族元素由上至下( )
A.元素单质的金属性越来越弱
B.元素单质的熔、沸点越来越高
C.原子的体积越来越小
D.原子最外层的电子数无变化
4.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
5.下列各表中数字(表示原子序数)所表示的元素与它们在周期表中位置相符的一组是( )
6.下列说法中正确的是( )
A.每一周期的元素都是从碱金属开始,最后以稀有气体结束
B.同一周期中,从左到右,各元素原子的最外层电子数都是从1个逐渐增加到8个
C.第二、三周期上下相邻元素的原子核外电子数相差8个
D.第七周期只有23种元素
7.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是( )
A.HF B.H3O+ C.NaH D.H2O2
8.某含氧酸的分子式为HnRO2n+2,试判断R的最合理价态为( )
A.+5 B.+7 C.+6 D.+4
9.有短周期元素A、B、C,其中A、B为同周期相邻元素,B、C同主族,且最外层电子数之和为17,核电荷数之和为31,则A、B、C为( )
A.C、N、Si B.N、P、O
C.N、O、S D.C、Si、S
10.ⅠA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上周期,当A的原子序数为x时,B的原子序数为( )
A.x-18 B.x -8
C.x +8 D.x +18
11.居里夫人发现的镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
A.在化合物中呈+2价
B.单质能和水剧烈反应,放出氢气
C.氢氧化物呈两性
D.碳酸盐难溶于水
12.短周期元素a、b、c在周期表中位置关系如图所示,则a、b、c三元素的名称是( ) HYPERLINK "http://www./" EMBED PBrush
A.氢、氟、硫 B.氟、硫、砷
C.氦、氟、硫 D.氖、氯、硒
13.碲元素及其化合物最不可能具有的性质是( )
A.碲的氧化物有TeO2和TeO3
B.碲的化合价有-2、+4、+6价
C.碲能与氢气直接化合,且很稳定
D.单质碲为银白色、导电性比硒强的固体
14.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A. x+2 B.x+4 C.x+8 D.x+18
15.在一定条件下与R- 发生如下反应: +5R-+6H+ ==3R2+3H2O,下列关于R的叙述中正确的是( )21世纪教育网
A.R的最外层电子数为5 B.R的氢化物的水溶液属于强酸
C. 中的R只能被还原 D.R2在常温常压下一定是气体
16.下列关于微粒半径的说法正确的是( )
A.电子层数少的元素的原子半径一定小于电子层数多的元素的原子半径
B.核外电子层结构相同的单核微粒半径相同
C.质子数相同的不同单核微粒,电子数越多半径越大
D.原子序数越大,原子半径越大
17.已知a为ⅡA族元素,b为ⅢA族元素,它们的原子序数分别为m和n,且a、b为同一周期元素,下列关系错误的是( )
A. n = m +1 B. n = m+11
C. n = m +25 D. n=m+10
18.若ⅡA族某元素原子序数为x,那么原子序数为x +1的元素可能位于( )
A.ⅢA族 B.ⅠB族
C.ⅡB族 D.Ⅷ族
二、非选择题21世纪教育网
19.A、B、C为短周期元素,在周期表中所处位置如图所示。
A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称: 、 、 。
(2)B位于元素周期表第 周期,第 族。
(3)C的原子结构示意图为 。
(4)比较B、C的原子半径:B C,写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式 。
20.现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的最高价氧化物的水化物能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)B和C的元素符号分别为B ,C 。
(2)上述四种元素的原子半径由大到小的顺序(用元素符号表示)为 。
(3)D单质在A单质中燃烧的产物与二氧化碳反应的化学方程式为 。
(4)写出B元素在周期表中的位置 。
(5)写出C的最高价氧化物的水化物分别跟B和D的最高价氧化物的水化物反应的方程式 。
21.A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为:,B、C可形成离子化合物B3C2,据此填空:
(1)A的元素名称为 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为 。
(3)B和C最高价氧化物的水化物化学式分别为 和 。
22.制冷剂是易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾采用过乙醚、NH3、CH3Cl等作制冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 > >H2O>HF;第三周期SiH4>PH3>H2S>HCl。
(2)化合物的毒性:PH3>NH3;H2S H2O; CS2 CO2;CCl4>CF4(选填“>”“<”或“=”)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8 ℃,CF4的沸点为?-128 ℃?,新的制冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的制冷剂氟利昂CF2Cl2终于诞生了,其他类似的还可以是 。
(4)然而,这种制冷剂造成了当今的某一环境问题,是 ,但求助于周期表中元素及其化合物的 变化趋势来开发制冷剂的科学思维方法是值得借鉴的(填写字母)。
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
a.①②③ b.②④⑤ c.②③④
23.A、B两元素,A的原子序数为x,A和B所在周期的元素种类总数分别是m和n。
(1)如果A和B同在第ⅠA族,当B在A的上一周期时,B的原子序数为 ,当B在A的下一周期时,B的原子序数为 。
(2)如果A和B同在第ⅦA族,当B在A的上一周期时,B的原子序数为 ,当B在A的下一周期时,B的原子序数为 。
资料卡片
元素周期表发展的远景?
元素周期表中的元素已经编排到112号,元素周期表还能不能延长?根据现有的理论计算第7周期应有32种元素,至118号元素结束。?
第8周期应有50种元素,至168号。同理,第9周期也应有50种元素,至218号。?
有趣的是,有些科学家还提出元素周期表还可以向负方向发展,这是由于发现了正电子、负质子(反质子)。在其他星球上是否存在由这些反质子和正电子以及中子组成的反原子呢?这种观点若能被实践证实,周期表当然可以出现原子核带负电荷的反元素,向负方向发展也就顺理成章了。?
轻松一题: 试写出由负质子、正电子构成的反氢离子、反氢氧根离子的中和反应方程式。 答案: H-+OH+ ==H2O
自我反馈 ?
导学园地 ?
参 考 答 案
第一课时 核外电子排布
巩固练习
1.A 2.A 3.B 4.B 5.A 6.A 7.B 8.A 9.C 10.D 11.A
12.(1)C (2)Li或Si (3)Be或Ar (4)Mg
14.(1)硫化钠
15.(1)A、B (2)A (3)B (4)A
16.H O Al S K
第二课时 元素周期律
巩固练习1.D 2.A 3.C 4.D 5.B 6.B 7.B 8.C 9.C 10.C 11.B
12.Cl C O K
13.(1)H O C Na
(2)CO2+Na2O==Na2CO3
(3)2NaOH+CO2==Na2CO3+H2O(或NaOH+CO2==NaHCO3)
14.(1)同周期 (2)烧杯 试管 酒精灯
(3)
①Mg+2H2OM==g(OH)2+H2↑
②Na2S+Cl2==2NaCl+S↓
(4)金属性:Na>Mg>Al;非金属性:Cl>S
第三课时 元素周期表及其应用
巩固练习
1.C 2.C 3.D 4.D 5.D 6.C 7.C 8.B 9.C 10.B 11.C 12.C 13.C 14.B 15.B 16.C 17.D 18.A
19.(1)氮 硫 氟 (2)三 ⅥA
(4)> 2NH3+H2SO4==(NH4)2SO4(或NH3+H2SO4==NH4HSO4)
20.(1)S Al (2)Na>Al>S>O (3)2Na2O2+2CO22Na2CO3+O2 (4)第三周期ⅥA族
(5)Al(OH)3+NaOH==NaAlO2+2H2O、2Al(OH)3+3H2SO4==Al2(SO4)3+6H2O
21.(1)硅 SiH4 (2)N
23.(1)x-n x+m (2)x-m x+n
w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
