化学:1.2《微粒之间的相互作用力》学案(苏教版必修2)
文档属性
| 名称 | 化学:1.2《微粒之间的相互作用力》学案(苏教版必修2) |
|
|
| 格式 | rar | ||
| 文件大小 | 297.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-07 09:46:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
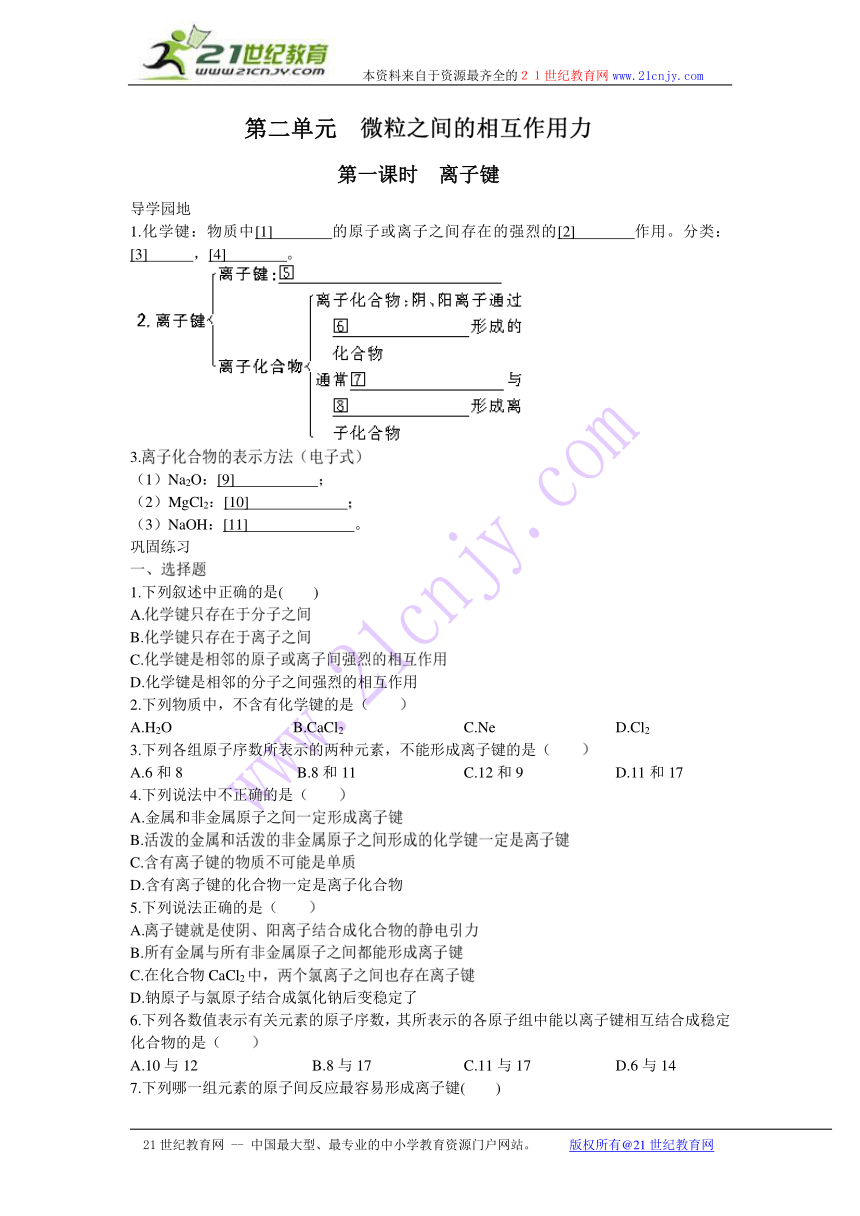
第二单元 微粒之间的相互作用力?
第一课时 离子键
导学园地
1.化学键:物质中[1] 的原子或离子之间存在的强烈的[2] 作用。分类:[3] ,[4] 。?
3.离子化合物的表示方法(电子式)?
(1)Na2O:[9] ;?
(2)MgCl2:[10] ;?
(3)NaOH:[11] 。?
巩固练习
一、选择题
1.下列叙述中正确的是( )
A.化学键只存在于分子之间
B.化学键只存在于离子之间
C.化学键是相邻的原子或离子间强烈的相互作用
D.化学键是相邻的分子之间强烈的相互作用
2.下列物质中,不含有化学键的是( )
A.H2O B.CaCl2 C.Ne D.Cl2
3.下列各组原子序数所表示的两种元素,不能形成离子键的是( )
A.6和8 B.8和11 C.12和9 D.11和17
4.下列说法中不正确的是( )
A.金属和非金属原子之间一定形成离子键
B.活泼的金属和活泼的非金属原子之间形成的化学键一定是离子键
C.含有离子键的物质不可能是单质
D.含有离子键的化合物一定是离子化合物
5.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力?
B.所有金属与所有非金属原子之间都能形成离子键?
C.在化合物CaCl2中,两个氯离子之间也存在离子键?
D.钠原子与氯原子结合成氯化钠后变稳定了
6.下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是( )
A.10与12 B.8与17 C.11与17 D.6与14
7.下列哪一组元素的原子间反应最容易形成离子键( )
HYPERLINK "http://www./" EMBED PBrush
A.b和e B.a和f C.d和g D.a和g
8.下列不是离子化合物的是( )w.w.w.k.s.5.u.c.o.m
A.H2O B.CaI2? C.KOH D.NaNO3
9.下列化合物电子式书写正确的是( )
HYPERLINK "http://www./" EMBED PBrush
10.X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中不正确的是( )
A.Z可以电离
B.Z可以表示为XY2
C.X形成+2价阳离子
D.Z的电子式为: HYPERLINK "http://www./" EMBED PBrush
二、非选择题
11.有下列化合物:NaCl、CaCl2、KOH、HCl、H2O、NH3,请你判断属于离子化合物的是 。
12.X元素位于ⅡA族,原子核内有12个中子,它在最高价氧化物中的质量分数是60%,Y元素原子的原子核外有9个电子,X与Y能形成稳定化合物,该化合物的化学式是 ,它是通过 键结合的,它的电子式为 。
13.已知氮化钠(Na3N)在熔融时能导电,与水作用能产生氨气。试回答下列问题:
(1)氮化钠属于 化合物。
(2)比较Na3N中离子的半径: > 。
(3)Na3N与水反应的方程式为 ,该反应属于 反应。(填四种基本反应类型)
资料卡片21世纪教育网
决定离子键强弱的主要因素?
使带相反电荷的阴、阳离子结合的相互作用,叫做离子键。可见,离子键的强弱取决于静电作用的大小,而静电作用的大小与阴、阳离子所带的电荷多少及阴、阳离子半径的大小有关。根据公式F=k可知,阴、阳离子所带的电荷越多,半径越小,相互作用就越强。离子键的强弱决定着该离子化合物的熔沸点高低。?
轻松一题: 下列离子化合物的熔点最高的是( C )?
A.NaCl B.KCl C.MgO D.Na2O
自我反馈 ?
导学园地 ?
第二课时 共价键、分子间作用力
导学园地
HYPERLINK "http://www./" EMBED PBrush
2.用电子式、结构式表示下列共价分子?
HCl:电子式:[3] ,结构式:[4] ;?
H2O:电子式:[5] ,?
结构式:[6] ;?
NH3:电子式:[7] ,?
结构式:[8] ;?
CH4:电子式:[9] ,?
结构式:[10] 。
3.化学键、分子间作用力21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
巩固练习21世纪教育网
一、选择题
1.下列电子式书写正确的是( )
HYPERLINK "http://www./" EMBED PBrush
2.下列物质中,只含有共价键的化合物是( )
A.碘化氢 B.烧碱 C.液溴 D.食盐
3.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.NaCl溶于水 D.HCl气体溶于水
4.下列说法中不正确的是( )
A.金属和非金属原子之间一定形成离子键
B.两个非金属原子之间形成的化学键一定是共价键
C.含有离子键的物质不可能是单质
D.单质中不一定含有共价键21世纪教育网
5.下列物质在变化过程中,只需克服分子间作用力的是( )
A.食盐溶解 B.干冰升华
C.氯化铵受热,固体消失 D.石墨熔化
6.分子间作用力为a,化学键为b,则a、b的大小关系是( )
A. a>b B.a7.共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
8.当SO3晶体熔化或气化时,下述各项中发生变化的是( )
A.分子内的化学键 B.物质的化学性质
C.分子的空间构型 D.分子间作用力
9.在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是( )
A.N2 B.PCl3 C.HCl D.CO2
10.根据化学反应的实质是旧键断裂、新键生成这一观点,下列变化不属于化学变化的是( )
A.石墨转化为金刚石
B.NaOH溶液与盐酸反应生成NaCl和H2O
C.NaCl熔化
D.Na2O溶于水
11.下列物质中,化学式能真正表示该物质分子组成的是( )
A.Na2O B.SiO2 C.KOH D.H2SO4
12.下列各项表达正确的是( ) 21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
13.下列说法正确的是( )
A.含有离子键的化合物必是离子化合物
B.含有共价键的物质就是共价化合物
C.共价化合物可能含有离子键
D.离子化合物中一定含有共价键
14.在解释下列物质性质的变化规律与物质结构间的因果关系中,与键的强弱无关的变化规律是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.F2、Cl2、Br2、I2的熔沸点逐渐升高
D.H2S稳定性小于H2O的稳定性
15.下表给出几种氯化物的熔沸点,对此有下列说法:①CaCl2属于离子化合物 ②SiCl4是共价化合物 ③1 500 ℃时,NaCl可形成气态分子 ④MgCl2水溶液不能导电
HYPERLINK "http://www./" EMBED PBrush
与表中数据一致的说法有( )
A.仅① B.仅②
C.①和② D.①、②和③
二、非选择题 21世纪教育网
16.将H2S、HCl、CH4、Ar、NH3、H2O、MgO、SiO2、CO2、NaCl、NaOH、NaHCO3等物质按以下要求填空:
(1)微粒间只存在共价键的是 , 只存在离子键的是 ,既存在离子键,又存在共价键的是 。
(2)属于离子化合物的是 ,其中只有离子键的化合物的电子式为 。
(3)含共价键的分子是 , 属于共价化合物的是 。
17.如图所示结构,图中“●”代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2 HYPERLINK "http://www./" EMBED PBrush )。
HYPERLINK "http://www./" EMBED PBrush
根据各图表示的结构特点,写出各分子的化学式:
A ;B ; C ;D 。
资料卡片
氢键对物质性质的影响?
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔点、沸点也越高。例如,卤素单质,随着相对分子质量的增大,分子间作用力增大,它们的熔点、沸点也相应升高。?
但是,有些氢化物的熔点和沸点的递变却与此不完全符合,如NH3、H2O和HF的沸点就反常(如图)。
一些氢化物的沸点?
轻松一题: 为什么NH3、H2O、HF的沸点反常??
答案: 受氢键影响。
自我反馈 ?
导学园地
21世纪教育网
?
21世纪教育网
w.k.s.5.u.c.o.m
参考答案
第二单元 微粒之间的相互作用力
第一课时 离子键
巩固练习
1.C 2.C 3.A 4.A 5.D 6.C 7.D 8.A 9.D 10.D
11.NaCl、CaCl2、KOH
12.MgF2 离子 ( http: / / www. / )
13.(1)离子 (2)N3- Na+ (3)Na3N+3H2O==3NaOH+NH3↑ 复分解
第二课时 共价键、分子间作用力
巩固练习
1.C 2.A 3.D 4.A 5.B 6.B 7.B 8.D 9.C 10.C 11.D 12.A 13.A 14.C 15.D
16.(1)H2S,HCl,CH4,NH3,H2O,SiO2,CO2 MgO,NaCl NaOH,NaHCO3
(2)MgO,NaCl,NaOH,NaHCO3
( http: / / www. / )
(3)H2S,HCl,CH4,NH3,H2O,CO2 H2S,HCl,CH4,NH3,H2O,SiO2,CO2
17.NH3 HCN CH4 BF3
21世纪教育网
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第二单元 微粒之间的相互作用力?
第一课时 离子键
导学园地
1.化学键:物质中[1] 的原子或离子之间存在的强烈的[2] 作用。分类:[3] ,[4] 。?
3.离子化合物的表示方法(电子式)?
(1)Na2O:[9] ;?
(2)MgCl2:[10] ;?
(3)NaOH:[11] 。?
巩固练习
一、选择题
1.下列叙述中正确的是( )
A.化学键只存在于分子之间
B.化学键只存在于离子之间
C.化学键是相邻的原子或离子间强烈的相互作用
D.化学键是相邻的分子之间强烈的相互作用
2.下列物质中,不含有化学键的是( )
A.H2O B.CaCl2 C.Ne D.Cl2
3.下列各组原子序数所表示的两种元素,不能形成离子键的是( )
A.6和8 B.8和11 C.12和9 D.11和17
4.下列说法中不正确的是( )
A.金属和非金属原子之间一定形成离子键
B.活泼的金属和活泼的非金属原子之间形成的化学键一定是离子键
C.含有离子键的物质不可能是单质
D.含有离子键的化合物一定是离子化合物
5.下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力?
B.所有金属与所有非金属原子之间都能形成离子键?
C.在化合物CaCl2中,两个氯离子之间也存在离子键?
D.钠原子与氯原子结合成氯化钠后变稳定了
6.下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是( )
A.10与12 B.8与17 C.11与17 D.6与14
7.下列哪一组元素的原子间反应最容易形成离子键( )
HYPERLINK "http://www./" EMBED PBrush
A.b和e B.a和f C.d和g D.a和g
8.下列不是离子化合物的是( )w.w.w.k.s.5.u.c.o.m
A.H2O B.CaI2? C.KOH D.NaNO3
9.下列化合物电子式书写正确的是( )
HYPERLINK "http://www./" EMBED PBrush
10.X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中不正确的是( )
A.Z可以电离
B.Z可以表示为XY2
C.X形成+2价阳离子
D.Z的电子式为: HYPERLINK "http://www./" EMBED PBrush
二、非选择题
11.有下列化合物:NaCl、CaCl2、KOH、HCl、H2O、NH3,请你判断属于离子化合物的是 。
12.X元素位于ⅡA族,原子核内有12个中子,它在最高价氧化物中的质量分数是60%,Y元素原子的原子核外有9个电子,X与Y能形成稳定化合物,该化合物的化学式是 ,它是通过 键结合的,它的电子式为 。
13.已知氮化钠(Na3N)在熔融时能导电,与水作用能产生氨气。试回答下列问题:
(1)氮化钠属于 化合物。
(2)比较Na3N中离子的半径: > 。
(3)Na3N与水反应的方程式为 ,该反应属于 反应。(填四种基本反应类型)
资料卡片21世纪教育网
决定离子键强弱的主要因素?
使带相反电荷的阴、阳离子结合的相互作用,叫做离子键。可见,离子键的强弱取决于静电作用的大小,而静电作用的大小与阴、阳离子所带的电荷多少及阴、阳离子半径的大小有关。根据公式F=k可知,阴、阳离子所带的电荷越多,半径越小,相互作用就越强。离子键的强弱决定着该离子化合物的熔沸点高低。?
轻松一题: 下列离子化合物的熔点最高的是( C )?
A.NaCl B.KCl C.MgO D.Na2O
自我反馈 ?
导学园地 ?
第二课时 共价键、分子间作用力
导学园地
HYPERLINK "http://www./" EMBED PBrush
2.用电子式、结构式表示下列共价分子?
HCl:电子式:[3] ,结构式:[4] ;?
H2O:电子式:[5] ,?
结构式:[6] ;?
NH3:电子式:[7] ,?
结构式:[8] ;?
CH4:电子式:[9] ,?
结构式:[10] 。
3.化学键、分子间作用力21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
巩固练习21世纪教育网
一、选择题
1.下列电子式书写正确的是( )
HYPERLINK "http://www./" EMBED PBrush
2.下列物质中,只含有共价键的化合物是( )
A.碘化氢 B.烧碱 C.液溴 D.食盐
3.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.NaCl溶于水 D.HCl气体溶于水
4.下列说法中不正确的是( )
A.金属和非金属原子之间一定形成离子键
B.两个非金属原子之间形成的化学键一定是共价键
C.含有离子键的物质不可能是单质
D.单质中不一定含有共价键21世纪教育网
5.下列物质在变化过程中,只需克服分子间作用力的是( )
A.食盐溶解 B.干冰升华
C.氯化铵受热,固体消失 D.石墨熔化
6.分子间作用力为a,化学键为b,则a、b的大小关系是( )
A. a>b B.a7.共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
8.当SO3晶体熔化或气化时,下述各项中发生变化的是( )
A.分子内的化学键 B.物质的化学性质
C.分子的空间构型 D.分子间作用力
9.在下列分子结构中,有原子的最外层电子不能满足8电子稳定结构的是( )
A.N2 B.PCl3 C.HCl D.CO2
10.根据化学反应的实质是旧键断裂、新键生成这一观点,下列变化不属于化学变化的是( )
A.石墨转化为金刚石
B.NaOH溶液与盐酸反应生成NaCl和H2O
C.NaCl熔化
D.Na2O溶于水
11.下列物质中,化学式能真正表示该物质分子组成的是( )
A.Na2O B.SiO2 C.KOH D.H2SO4
12.下列各项表达正确的是( ) 21世纪教育网
HYPERLINK "http://www./" EMBED PBrush
13.下列说法正确的是( )
A.含有离子键的化合物必是离子化合物
B.含有共价键的物质就是共价化合物
C.共价化合物可能含有离子键
D.离子化合物中一定含有共价键
14.在解释下列物质性质的变化规律与物质结构间的因果关系中,与键的强弱无关的变化规律是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.F2、Cl2、Br2、I2的熔沸点逐渐升高
D.H2S稳定性小于H2O的稳定性
15.下表给出几种氯化物的熔沸点,对此有下列说法:①CaCl2属于离子化合物 ②SiCl4是共价化合物 ③1 500 ℃时,NaCl可形成气态分子 ④MgCl2水溶液不能导电
HYPERLINK "http://www./" EMBED PBrush
与表中数据一致的说法有( )
A.仅① B.仅②
C.①和② D.①、②和③
二、非选择题 21世纪教育网
16.将H2S、HCl、CH4、Ar、NH3、H2O、MgO、SiO2、CO2、NaCl、NaOH、NaHCO3等物质按以下要求填空:
(1)微粒间只存在共价键的是 , 只存在离子键的是 ,既存在离子键,又存在共价键的是 。
(2)属于离子化合物的是 ,其中只有离子键的化合物的电子式为 。
(3)含共价键的分子是 , 属于共价化合物的是 。
17.如图所示结构,图中“●”代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2 HYPERLINK "http://www./" EMBED PBrush )。
HYPERLINK "http://www./" EMBED PBrush
根据各图表示的结构特点,写出各分子的化学式:
A ;B ; C ;D 。
资料卡片
氢键对物质性质的影响?
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔点、沸点也越高。例如,卤素单质,随着相对分子质量的增大,分子间作用力增大,它们的熔点、沸点也相应升高。?
但是,有些氢化物的熔点和沸点的递变却与此不完全符合,如NH3、H2O和HF的沸点就反常(如图)。
一些氢化物的沸点?
轻松一题: 为什么NH3、H2O、HF的沸点反常??
答案: 受氢键影响。
自我反馈 ?
导学园地
21世纪教育网
?
21世纪教育网
w.k.s.5.u.c.o.m
参考答案
第二单元 微粒之间的相互作用力
第一课时 离子键
巩固练习
1.C 2.C 3.A 4.A 5.D 6.C 7.D 8.A 9.D 10.D
11.NaCl、CaCl2、KOH
12.MgF2 离子 ( http: / / www. / )
13.(1)离子 (2)N3- Na+ (3)Na3N+3H2O==3NaOH+NH3↑ 复分解
第二课时 共价键、分子间作用力
巩固练习
1.C 2.A 3.D 4.A 5.B 6.B 7.B 8.D 9.C 10.C 11.D 12.A 13.A 14.C 15.D
16.(1)H2S,HCl,CH4,NH3,H2O,SiO2,CO2 MgO,NaCl NaOH,NaHCO3
(2)MgO,NaCl,NaOH,NaHCO3
( http: / / www. / )
(3)H2S,HCl,CH4,NH3,H2O,CO2 H2S,HCl,CH4,NH3,H2O,SiO2,CO2
17.NH3 HCN CH4 BF3
21世纪教育网
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
