第四节海水中的化学元素 第二课时学案
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第四节 海水中的化学元素
学习目标:
1、掌握溴单质和含溴化合物的用途,了解海水提溴的原理。
2、理解氯、溴、碘单质的氧化性及氧化性的递变规律。
知识回顾
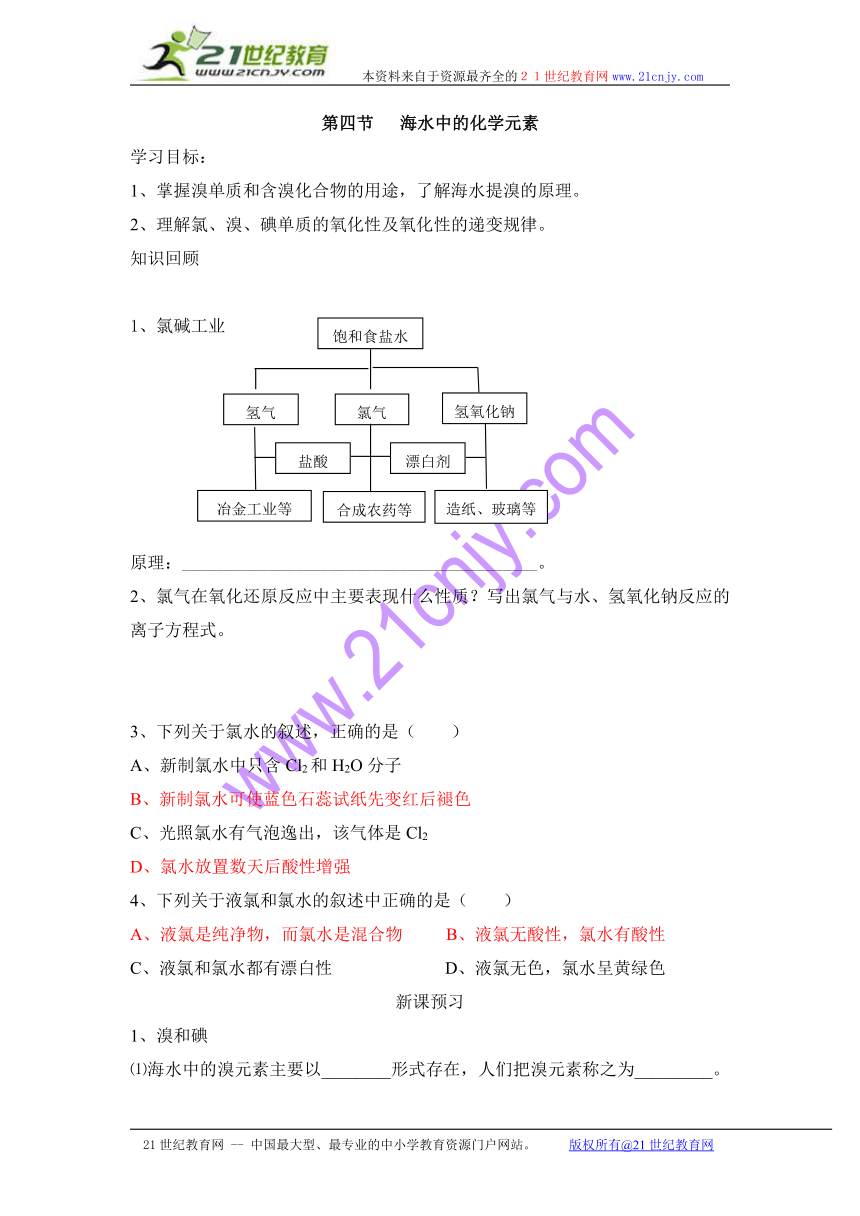
1、氯碱工业
原理:_________________________________________。
2、氯气在氧化还原反应中主要表现什么性质?写出氯气与水、氢氧化钠反应的离子方程式。
3、下列关于氯水的叙述,正确的是( )
A、新制氯水中只含Cl2和H2O分子
B、新制氯水可使蓝色石蕊试纸先变红后褪色
C、光照氯水有气泡逸出,该气体是Cl2
D、氯水放置数天后酸性增强
4、下列关于液氯和氯水的叙述中正确的是( )
A、液氯是纯净物,而氯水是混合物 B、液氯无酸性,氯水有酸性
C、液氯和氯水都有漂白性 D、液氯无色,氯水呈黄绿色
新课预习
1、溴和碘
⑴海水中的溴元素主要以________形式存在,人们把溴元素称之为_________。溴单质具有很强的___________,取用时应戴橡皮手套。
⑵氯、溴、碘三种元素在元素周期表中排在同一纵列里,都属于_____族元素,简称____。它们在原子结构和元素性质方面具有一定的相似性,化学上放在一起研究。
⑶溴单质和碘单质不易溶于______,易溶于_________。
2、什么叫萃取?
3、根据教材100页活动·探究提供的物质,思考如何比较氯、溴、碘三种单质氧化性的强弱?
课堂学案
三、溴和海水提溴
1、溴单质和碘单质的物理性质
<演示实验1>:观察溴单质和碘单质的状态、颜色;取少量的溴单质和碘单质,分别观察它们在水、酒精和四氯化碳溶剂中的溶解情况和所形成溶液的颜色,把观察结果填入下表中:
物理性质 溴单质 碘单质
颜色
状态
溶解性和溶液颜色 水中
酒精中
四氯化碳中
<演示实验2>:给碘锤加热,观察发生的现象。
【交流讨论】
1、在保存溴单质和碘单质时应分别注意哪些问题?
2、碘容易升华的性质有什么重要用途?
3、如何选择萃取液?
【活动探究】 我们已经认识了氯气的强氧化性,请用氯水、溴水、碘水、氯化钠溶液、溴化钠溶液、碘化钾溶液,设计实验探究氯、溴、碘三种单质的氧化性强弱。记录实验现象、实验结论或化学方程式。
你的实验方案与实验记录
实验内容 实验现象 实验结论或化学方程式
<思考>:
1、通过实验探究,你认为氯、溴、碘单质的化学性质有什么共同特点?它们的氧化性强弱如何?写出发生反应的离子方程式。
2、氯、溴和碘单质的氧化性强弱对于从溴化物中提取溴有何启示?
【指导阅读】 阅读教材,思考并回答下列问题:
1、海水提溴的化学反应原理是什么?工业流程所经历的主要步骤有哪些?
2、溴及其化合物在工业、农业、医药等方面有哪些用途?
3、为了降低开发成本,海水化学资源的利用将走什么道路?我国科学家在此领域取得了哪些成就?
课后学案
1、在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是 ( )
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸
④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
A、①④②⑤③ B、④①②⑤③
C、②⑤④①③ D、⑤②④③①
2、0.1mol某元素的单质直接与氯气反应后,质量增加7.1g,这种元素可能是( )
A.Na B.Mg C.Fe D.Cu
3、已知KMnO4与浓HCl在常温下反应能产生Cl2,若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )
A.只有①和②处 B.只有②处
C.只有②处和③处 D.只有②、③、④处
4、向NaI和NaBr的混合溶液中通入过量的Cl2气,充分反应后将溶液蒸干,灼烧残余物,最后剩余的物质是 ( )
A NaCl、I2、Cl2 B NaCl、I2 C NaCl、NaBr D NaCl
5、已知某溶液中Cl—,Br—,I—的物质的量之比为2:3:4现欲是溶液中的Cl—,Br—,I—的物质的量之比变成4:3:2,要通入Cl2的物质的量是原溶液中I—的物质的量的 ( ) A、 B、 C、 D、
6、在反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O中,试从氧化还原与元素化合价的升降的角度分析上述反应,并回答下列问题:
(1)___________元素被氧化,________是氧化剂。
(2)___________是氧化产物,_______发生氧化反应。
7、a b c d四个集气瓶中装有氯气、氢气、氯化氢、溴化氢中的任意一种气体,若a d两瓶气体混合见光爆炸,a b两瓶气体混合瓶壁出现暗红色液滴,则c瓶气体是______________
8、在100mL的FeBr2溶液中通入2.24L的标准状况下的Cl2,充分反应后,溶液中有的Br—被氧化成Br2单质,求原FeBr2的物质的量浓度
饱和食盐水
氯气
氢氧化钠
氢气
合成农药等
冶金工业等
造纸、玻璃等
漂白剂
盐酸
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第四节 海水中的化学元素
学习目标:
1、掌握溴单质和含溴化合物的用途,了解海水提溴的原理。
2、理解氯、溴、碘单质的氧化性及氧化性的递变规律。
知识回顾
1、氯碱工业
原理:_________________________________________。
2、氯气在氧化还原反应中主要表现什么性质?写出氯气与水、氢氧化钠反应的离子方程式。
3、下列关于氯水的叙述,正确的是( )
A、新制氯水中只含Cl2和H2O分子
B、新制氯水可使蓝色石蕊试纸先变红后褪色
C、光照氯水有气泡逸出,该气体是Cl2
D、氯水放置数天后酸性增强
4、下列关于液氯和氯水的叙述中正确的是( )
A、液氯是纯净物,而氯水是混合物 B、液氯无酸性,氯水有酸性
C、液氯和氯水都有漂白性 D、液氯无色,氯水呈黄绿色
新课预习
1、溴和碘
⑴海水中的溴元素主要以________形式存在,人们把溴元素称之为_________。溴单质具有很强的___________,取用时应戴橡皮手套。
⑵氯、溴、碘三种元素在元素周期表中排在同一纵列里,都属于_____族元素,简称____。它们在原子结构和元素性质方面具有一定的相似性,化学上放在一起研究。
⑶溴单质和碘单质不易溶于______,易溶于_________。
2、什么叫萃取?
3、根据教材100页活动·探究提供的物质,思考如何比较氯、溴、碘三种单质氧化性的强弱?
课堂学案
三、溴和海水提溴
1、溴单质和碘单质的物理性质
<演示实验1>:观察溴单质和碘单质的状态、颜色;取少量的溴单质和碘单质,分别观察它们在水、酒精和四氯化碳溶剂中的溶解情况和所形成溶液的颜色,把观察结果填入下表中:
物理性质 溴单质 碘单质
颜色
状态
溶解性和溶液颜色 水中
酒精中
四氯化碳中
<演示实验2>:给碘锤加热,观察发生的现象。
【交流讨论】
1、在保存溴单质和碘单质时应分别注意哪些问题?
2、碘容易升华的性质有什么重要用途?
3、如何选择萃取液?
【活动探究】 我们已经认识了氯气的强氧化性,请用氯水、溴水、碘水、氯化钠溶液、溴化钠溶液、碘化钾溶液,设计实验探究氯、溴、碘三种单质的氧化性强弱。记录实验现象、实验结论或化学方程式。
你的实验方案与实验记录
实验内容 实验现象 实验结论或化学方程式
<思考>:
1、通过实验探究,你认为氯、溴、碘单质的化学性质有什么共同特点?它们的氧化性强弱如何?写出发生反应的离子方程式。
2、氯、溴和碘单质的氧化性强弱对于从溴化物中提取溴有何启示?
【指导阅读】 阅读教材,思考并回答下列问题:
1、海水提溴的化学反应原理是什么?工业流程所经历的主要步骤有哪些?
2、溴及其化合物在工业、农业、医药等方面有哪些用途?
3、为了降低开发成本,海水化学资源的利用将走什么道路?我国科学家在此领域取得了哪些成就?
课后学案
1、在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是 ( )
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸
④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
A、①④②⑤③ B、④①②⑤③
C、②⑤④①③ D、⑤②④③①
2、0.1mol某元素的单质直接与氯气反应后,质量增加7.1g,这种元素可能是( )
A.Na B.Mg C.Fe D.Cu
3、已知KMnO4与浓HCl在常温下反应能产生Cl2,若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )
A.只有①和②处 B.只有②处
C.只有②处和③处 D.只有②、③、④处
4、向NaI和NaBr的混合溶液中通入过量的Cl2气,充分反应后将溶液蒸干,灼烧残余物,最后剩余的物质是 ( )
A NaCl、I2、Cl2 B NaCl、I2 C NaCl、NaBr D NaCl
5、已知某溶液中Cl—,Br—,I—的物质的量之比为2:3:4现欲是溶液中的Cl—,Br—,I—的物质的量之比变成4:3:2,要通入Cl2的物质的量是原溶液中I—的物质的量的 ( ) A、 B、 C、 D、
6、在反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O中,试从氧化还原与元素化合价的升降的角度分析上述反应,并回答下列问题:
(1)___________元素被氧化,________是氧化剂。
(2)___________是氧化产物,_______发生氧化反应。
7、a b c d四个集气瓶中装有氯气、氢气、氯化氢、溴化氢中的任意一种气体,若a d两瓶气体混合见光爆炸,a b两瓶气体混合瓶壁出现暗红色液滴,则c瓶气体是______________
8、在100mL的FeBr2溶液中通入2.24L的标准状况下的Cl2,充分反应后,溶液中有的Br—被氧化成Br2单质,求原FeBr2的物质的量浓度
饱和食盐水
氯气
氢氧化钠
氢气
合成农药等
冶金工业等
造纸、玻璃等
漂白剂
盐酸
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
