一年级语文上册教案 数字歌 1(北师大版)
文档属性
| 名称 | 一年级语文上册教案 数字歌 1(北师大版) |

|
|
| 格式 | rar | ||
| 文件大小 | 33.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北师大版 | ||
| 科目 | 语文 | ||
| 更新时间 | 2009-09-24 00:00:00 | ||
图片预览




文档简介
南昌一中2008-2009学年度第二学期高一月考试卷
化 学
命题:熊维平 2009年3月
注意:本卷所有答案都写入答题卷中, 考后试卷自己保存
可能用到的相对原子质量: O=16 Na=23 Mg=24 Al=27 S=32 Ca=40
一、选择题(只有1个选项,3×18=54分)
1.“生物质”是指由植物或动物生命体衍生得到的物质的总称。作为人类解决能源危机重要
途径之一的“生物质能”,主要指用树木、庄稼、草类等植物直接或间接提供的能量。古
老的刀耕火种、烧柴做饭、烧炭取暖等粗放用能方式正在被现代科学技术所改变。下面
有关“生物质能”的说法,不正确的是
A.生物质能的缺点是严重污染环境
B.生物质能源是可再生的能源
C.利用生物质能就是间接利用太阳能
D.生物质能源是解决农村能源的主要途径
2.不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在近20年来植物生理学、
生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中, 2H、13C、15N、18O、
34S、等常用作环境分析指示物。下列有关说法正确的是
A.34S原子核内中子数为16
B.2H+的结合OH-的能力比1H+的更强
C.13C和15N原子核内的质子数相差2
D.1H216O和1H218O的相对分子质量不同
3.下列关于元素周期表的说法错误的是
A.元素周期表是元素周期律的具体表现形式
B.是先有元素周期律,再有元素周期表的
C.中学课本上的元素周期表是常用的一种形式,也是唯一的一种形式
D.同一周期的元素原子的电子层数大都相等
4.下列各组顺序的排列不正确的是
A.离子半径:F->Na+>Mg2+>Al3+
B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱:H3AlO3D.熔点:Rb>K>Na>Li
5.下列数字为几种元素的核电荷数,其中核外最外层电子数最多的是
A.8 B.14 C.20 D.33
6.核外电子数相等的原子一定是
① 同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤同位素
A.①②③ B.①③
C.①②③④ D.全部
7.原子系数为83的元素位于:①第五周期;②第六周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是
A.①④ B.②④
C.②③ D.①⑤
8.某元素原子最外层有两个电子,该元素
A.一定是第二主族元素
B.一定是非金属元素
C.一定是稀有气体元素
D.可能是金属元素
9.短周期元素X、Y、Z在周期表中的位置关系如图所示,则下列叙述中正确的是
A.X、Y、Z均为金属元素
B.无法确定X、Y、Z各为何种元素
C.Y的最高价氧化物的水化物是一种强酸
D.Y的氢化物稳定性大于Z的氢化物稳定性
10.A和B是同周期相邻的元素,A和C是同主族相邻的元素,已知三种元素的核电荷数之和为33,则B可能是
A.氯元素 B.氮元素 C.硅元素 D.铝元素
11.X、Y分别为元素周期表ⅦA中第三、四周期的两种元素,下列有关叙述正确的是
A.X原子的电子层数比Y原子的电子层数多
B.相同条件下,X的单质的密度比Y的单质的密度大
C.常温常压下X的单质的颜色比Y的单质的颜色浅
D.Y的单质能将X从NaX的溶液中置换出来
12.下列叙述中,正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.阳离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
13.下列说法中不正确的是
A.离子化合物中不一定含有金属元素
B.由不同原子所形成的纯净物不一定是化合物
C.分子中一定含有化学键
D.含有金属元素的离子不一定是阳离子
14.同温同压下有等质量的H2、D2、T2三种气体,有下列几种叙述,其中正确地是
①密度之比1:2:3; ②质子数之比6:3:2;
③中子数之比0:3:4; ④体积之比6:3:2;
A.只有①② B.①②③④
C.只有③④ D.只有②④
15.氢气能在氯气中燃烧,反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1Kj,破坏1mol氯气中的化学键消耗的能量为Q2Kj,形成1mol氯化氢气体中的化学键释放的能量为Q3Kj;则下列关系正确地是
A.Q1+Q2>Q3 B.Q1+Q2<2Q3
C.Q1+Q2=2Q3 D.Q1+Q2>2Q3
16.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”,已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,则原子个数比应为
A.61:39 B.30:61
C.1:1 D.39:11
17.已知反应KClO3+6HCl=KCl+3Cl2↑+3H2O,若用K35ClO3和H37Cl作用,则下列说法
中正确的是
A.生成1molCl2转移6mole-
B.生成的氯气中既有35Cl又有37Cl
C.生成的KCl中既有35Cl又有37Cl
D.生成的氯气式量约为74
18.已知A、B、C、D、E是核电核数依次增大的五种短周期主族元素,原子半径按D、E、
B、C、A的顺序依次减小,B和E同主族,则下列推断中,正确的是
A.A、D不可能属于同一族
B.A、B、E至少有两种元素在同一周期
C.C可能是金属元素也可能是非金属元素
D.C、D的单质有可能形成离子化合物
二、主观题(共46分)
19.(10分)下列反应中,属于放热反应的是 ,属于吸热
反应的是 。
①煅烧石灰石(主要成分是CaCO 3)制生石灰(CaO) ②燃烧木炭取暖 ③炸药爆炸
④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
⑦Ba(OH)2 8H2O与NH4Cl反应 ⑧盐酸与金属镁反应 ⑨将胆矾加热使其变为白色粉末 ⑩过氧化钠溶于水中
20.(8分)某金属重4 g,其原子核外有2 mol 电子,核内共有1.204×1024个中子,该金属与足量盐酸反应,有0.2 mol电子发生转移,生成了6.02×1022个阳离子。
(1)该金属元素符号是____________;摩尔质量是____________。
(2)原子核内有________个质子;________个中子。
21.(7分)A、B、C、D四种元素在元素周期表中的位置如右图所示
A为同主族元素中原子半径最小的元素原子,D为该周期中
非金属性最强的元素,请回答下列有关问题
(1)C元素的名称是 ;在周期表的第 周期;第 族;
(2)B元素的原子结构示意图为 ;其气态氢化物的电子式 ;
(3)A、B、C、D四种元素的氢化物中最不稳定的是 ;熔沸点最高的是
。(书写化学式)
22.(9分)X、Y、Z三种主族元素位于周期表中连续的三个不同周期。原子序数:Z>X>Y,其中Y原子的次外层电子数为2,X原子的次外层电子数与Y、Z原子的次外层电子数均不相同,X与Y的族序数之和等于Z的族序数。已知X的氢氧化物难溶于水,Y的最高价氧化物对应的水化物是一种强酸。由此推出:
(1)X是__________,Y是___________,Z是___________。(书写元素符号)
(2)用电子式表示由X、Z两种元素组成的化合物的形成过程:
_________________________________________________。
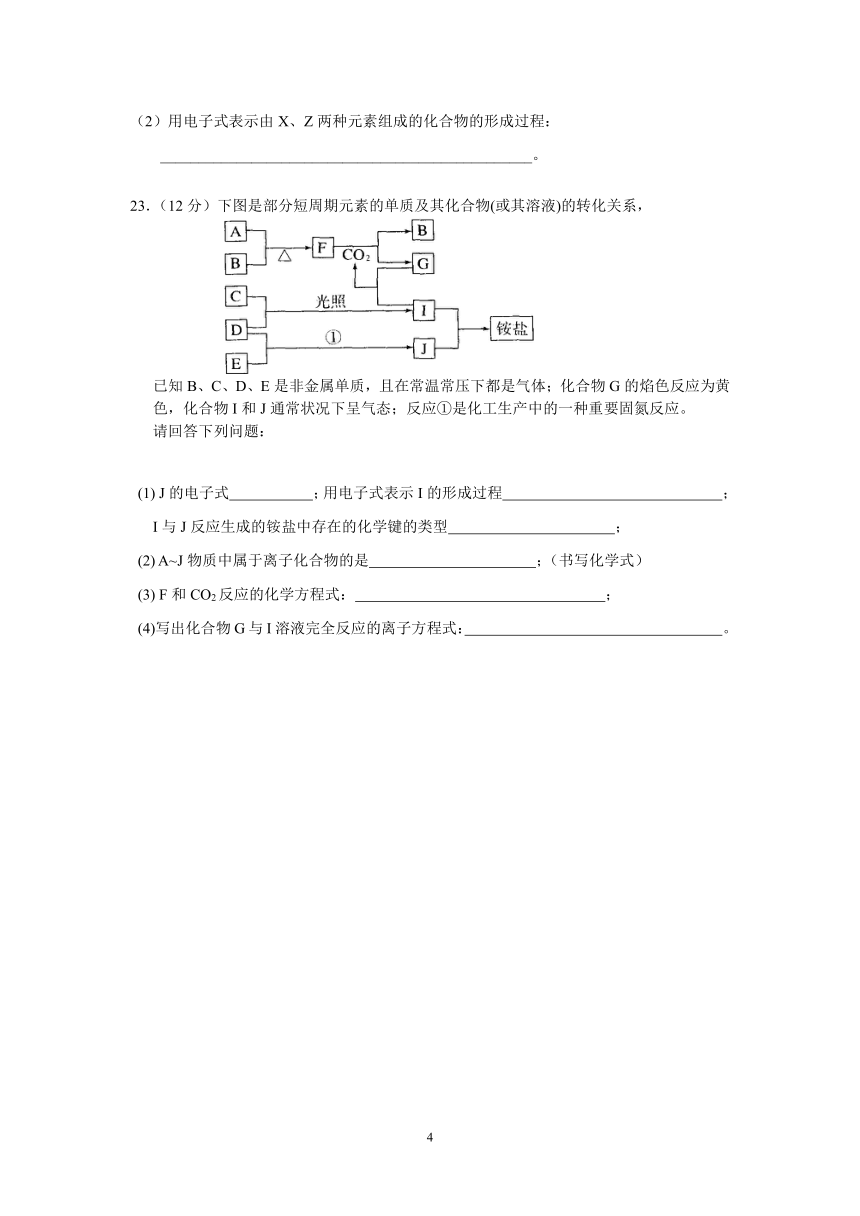
23.(12分)下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,
已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
请回答下列问题:
(1) J的电子式 ;用电子式表示I的形成过程 ;
I与J反应生成的铵盐中存在的化学键的类型 ;
(2) A~J物质中属于离子化合物的是 ;(书写化学式)
(3) F和CO2反应的化学方程式: ;
(4)写出化合物G与I溶液完全反应的离子方程式: 。
南昌一中2008-2009学年度第二学期高一月考试卷
化 学 答 题 卷
座号
一、选择题
题号 1 2 3 4 5 6 7 8 9
答案
题号 10 11 12 13 14 15 16 17 18
答案
二、主观题
19.(10分)
下列反应中,属于放热反应的是 ,属于吸热
反应的是 。
20.(8分)
(1)该金属元素符号是____________;摩尔质量是____________。
(2)原子核内有________个质子;________个中子。
21.(7分)
(1)C元素的名称是 ;在周期表的第 周期;第 族;
(2)B元素的原子结构示意图为 ;其气态氢化物的电子式 ;
(3)A、B、C、D四种元素的氢化物中最不稳定的是 ;熔沸点最高的是
。(书写化学式)
22.(9分)
(1)X是__________,Y是___________,Z是___________。
(2)用电子式表示由Y、Z两种元素组成的化合物的形成过程:
_________________________________________________。
23.(12分)
(1) J的电子式 ;用电子式表示I的形成过程 ;
I与J反应生成的铵盐中存在的化学键的类型 ;
(2) A~J物质中属于离子化合物的是 ;(书写化学式)
(3) F和CO2反应的化学方程式: ;
(4)写出化合物G与I溶液完全反应的离子方程式: 。
参考答案:
题号 1 2 3 4 5 6 7 8 9
答案 A D C D A B B D D
题号 10 11 12 13 14 15 16 17 18
答案 D C C C B B A B D
18.A
A
B C
D E
B
A
B C
D E
C
A
B C只能为硼或后面的元素
D E
19.②③④⑤⑥⑧⑩;①⑦⑨
20.(1)Ca; 40g/mol;
(2) 20; 20
21.(1)磷;三;ⅤA;
(2)硫原子结构示意图;硫化氢的电子式
(3)PH3;H2O
22.(1)N; Mg ; Br ;
(2)MgBr2的形成过程
23.(1)NH3的电子式;HCl的形成过程;NH4Cl的键形
(2)Na2O2;Na2CO3
(3)2Na2O2+2CO2=2Na2CO3+O2
(4) 2H++CO32-=CO2+H2O
备用提:
10.下列说法正确的是
A.离子化合物中可能含有共价键 B.离子化合物中不可能含有共价键
C.共价化合物中可能含有离子键 D.H2O2中不含非极性键
13.按核电荷数的增大,氧族元素的下列性质按递增顺序排列的是
①单质的熔点 ②元素的非金属性 ③氢化物的还原性 ④与氢气反应的能力 ⑤+6价氧化物对应水化物的酸性 ⑥阴离子的半径
A.①②③ B.④⑤⑥ C.③④⑤ D.①③⑥
17.A和M为两种元素,已知A位于短周期,且A2+与M-两种离子的电子数之差为8,则下列说法正确的是
A.A和M的原子序数之差为6
B.A和M原子的最外层电子数之和为9
C.A和M原子的最外层电子数之差为7
D.A和M原子的电子总数之和可能为11
10.已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
14.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已
知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
A.Q1 < Q2
B.石墨不如金刚石稳定
C.石墨具有的能量比金刚石低
D.石墨与金刚石完全燃烧,生成的二氧化碳一样多
3.对于放热反应H2 + Cl2 点燃 2HCl,下列说法正确的是:
A.产物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1mol H—H键和1mol Cl—Cl键所吸收的总能量小于形成1mol H—Cl键所放出
的能量
D.该反应中,化学能只有转变为热能
2.已知X、Y均为1—18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原 子
序数小于X的原子序数,则这两种元素的原子序数之和为
A.19 B.18 C.16 D.9
6.甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙阴离子发生置换反应;③
甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性 强;④与某
金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙
的非金属性强的是
A.只有④ B.只有⑤ C.①②③ D.①②③④⑤
8.A、B均为原子序数1—20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个
电子,则B的原子序数是
A.n+4 B.n+6 C.n+8 D.n+10
14.两种微粒的质子数和电子数都相等,则这两种微粒肯定不可能的是
A.两种不同的原子 B.一种原子和一种分子
C.两种不同的离子 D.一种原子和一种离子
20.主族元素X的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确
的是
A.X的原子序数比Y的小 B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大 D.X元素的最高正价比Y的大
14.已知R2+离子核外有a个电子,b个中子,表示R原子符号正确的是
A.R B.R C.R D.R
15.下列说法中错误的是
A.质量数相同的原子,其化学性质一定相同
B.质子数相同的微粒,其核外电子排布也相同
C.金属性越活泼,其原子在反应中越易失去电子
D.非金属性越活泼,其阴离子越容易失去电子
7.下列叙述中,正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布式
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
13.下列叙述正确的是
A.单质分子中一定存在着共价键
B.气态物质中一定存在着共价键
C.全部由非金属元素构成的化合物一定不存在离子键
D.在共价化合物中一定含有共价键
14.下列表示电子式的形成过程正确的是
11.下列叙述中正确的一组是
①离子化合物中只含离子键;
②同周期元素形成的阳离子和阴离子,具有相同的电子层结构;
③化学键是指晶体中或分子中相邻原子间或离子间强烈的相互作用;
④质子数相同的微粒一定属于同一种元素;
⑤同种元素的原子具有相同的质量;
⑥共价化合物中一定不含离子键。
A.①③⑥ B.②④⑤ C.③④ D.③⑥
19.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中
正确的是
A.原子半径:B>A>C>D B.原子序数:d>c>b>a
C.离子半径:C>D>A>B D.单质的还原性:B10.X、Y、Z、W四种元素在周期表中相对位置如图,Y、Z质子数之和为21,下列说法
正确的是
X Y
Z W
A.常压下,四种元素单质中,W单质的熔点最高
B.X的气态氢化物比Y的气态氢化物稳定
C.Z的阳离子与Y的阴离子电子层结构相同
D.W元素的金属性比Z元素金属性强
15.下列说法正确的是
A.IA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
47.下列推断符合实际的是
A.第n周期的最后一种金属元素处在第n-l族
B.m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物
C.第n周期有n种主族金属元素(1D.m-n=5(m为最外层电子数,n为电子层数)的主族元素存在最强的对应含氧酸
11.根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
21.短周期的A、B两种元素,A原子半径小于B原子半径,两种元素可形成A是正价的
AB2型化合物,下列关于两元素的叙述正确的是
①A、B可能属于同一周期 ②A是B的前一周期元素 ③A只能是金属元素,
④A可能是第二周期IIA族或ⅣA族元素:
A.①③ B.②③ C.②④ D.②③④
40.A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出的能
量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收
的能量。若A、B、C、D间分别形成化合物时,属于离子化合物可能性最大的是
A.D2A B.C2B C.C2A D.D2B
15.下列叙述正确的是
A.分子是由一定数目的原子组成的,原子之间的相互作用叫化学键
B.按C、N、O、F的顺序,元素的最高正价依次升高
C.非金属元素之间构成的化合物都不是离子化合物
D.离子化合物中一定含有离子键
17.关于周期表和周期律,下列说法中正确的是
A.在周期表中,元素的族序数都等于其原子的最外层电子数
B.VIIA组元素的单质,随相对分子质量的增大,熔、沸点升高;IA族单质,由上至下,
随相对原子质量递增,熔、沸点下降
C.周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强
D.同主族元素随原子核电荷数的递增,原子半径依次增大
18.有Xn-、Yn+、Z三种微粒,其电子层结构相同,下列分析中正确的是
A.微粒半径大小关系是X>Y B.Z一定是稀有气体元素
C.原子序数关系是Z>Y>X D.微粒半径关系是Xn-19.有A、B、C、D四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同
的电子层结构,且A的阳离子氧化性比B的氧化性弱,C的阴离子所带负电荷比D的阴
离子所带负电荷多,则A、B、C、D的原子序数大小关系是
A.B>A>C>D B.C>B>A>D
C.A>B>C>D D.B>A>D>C
15.某碱金属元素R有两种同位素R’和R”,相对原子质量分别是a和b,原子百分组成分
别为X和Y,则R元素的硫酸盐的相对分子质量是
A.2(ax+by)+96 B.2(ay+bx)+96
C.ay+bx+96 D.ax+by+96
16.同主族两种元素原子的核外电子数差值可能为
A.6 B.12 C.26 D.30
29.现有A、B、C、D、E五种主族元素,其中A、C、D、E为短同期元素,A的最高价氧化物中含A40%,A原子中质子数等于中子数;B是第四周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物 ,且B、D两离子的电子层结构相同;C和D能形成CD3的化合物;C原子比E原子多1个电子; 1.8gC与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24L;C原子中质子数比中子数少1;D原子比A原子多1个质子.则:
(1)A、B的元素符号分别为:A ,B
(2)五种元素中,单质还原性最强的是 ,简单离子还原性最强的是 .
(3五种元素最高价氧化物对应水化物中酸性最强的是 ,碱性最强的是 .
(4)D单质与B的最高价氧化物的水化物反应的离子方程式 .
29. (1)S、K
(2)K、S2-
(3)HClO4、KOH
(4)Cl2+2OH ==Cl-+ClO +H2O
24、(9分)位于短周期的四种主族元素A、B、C、D,原子序数依次增大。已知A、C位于同一主族,B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
⑴写出C元素的单质与A2B反应的化学方程式 ;
⑵请写出含B质量分数最高的化合物的电子式 ;
⑶由上述四种元素可形成四种具有漂白作用的物质,请写出其中漂白原理与另三种不同的物质的化学式: ;
⑷写出两种均含有这四种元素的化合物相互反应的离子方程式:
24、(9分)A:氢,B:氧,C:钠,D:硫。
⑴2Na+2H2O=4NaOH+O2↑(2分);
⑵HH(2分);
⑶SO2(2分);
⑷H++HSO3-=SO2↑+H2O(3分);
21.有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍; C燃烧时呈现黄色火焰, C的单质在加热条件下与B的单质反应, 可以得到与D单质颜色相同的固态化合物;D的最高价与最低价之和为其最低价绝对值的两倍,试根据以上叙述回答:
(1)写出A与B两元素所形成化合物的结构式为 ______________;该化合物分子所含有的化学键属于(极性键或非极性键)______________;该化合物分子属于(极性分子或非极性分子)______________;
(2)用电子式表示C与B两元素可能形成的化合物结构________________________;
(3)画出D的原子结构简图 ___________________, 用电子式表示C与D两元素化合物的形成过程 _______________________________________________________。
21.(1)O=C=O; (2分) 极性键(1分); 非极性分子(1分)
.(2) (4分)需写出两种(Na2O,Na2O2)方给4分;写出一种只给1分;
(3)S的原子结构简图及Na2S形成过程电子式表示各2分。
11 已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,
B、C同主族。A与B形成离子化合物A2B中所有离子的电子数相同,其电
子总数为30;D和E可形成含4核10个电子的分子。试回答下列问题:
(1)写出这几种元素的元素符号A:_______、B:________、C________、
D:_______、E:________。
(2)用电子式表示离子化合物A2B的形成过程:_________________________________
(3)写出下列物质的电子式。
①E与B形成的个数比为1:1的化合物:______________
②E与D形成的化合物:_____________
③D、C、E形成的离子化合物:_______________
答案:(1) (2) (3)
24、A、B、C、D、E五种元素的原子序数依次增大,且均小于18;A原子的最外层比B原子的最外层少2个电子,A原子的最外层电子数是次外层电子数的两倍;A、B、C三种元素能结合成化合物C2AB3,在1 mol C2AB3中共有52mol电子,D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移,在B与D形成的化合物,D的质量分数为52.94%,D原子核内有14个中子,每个E原子与氢原子化合时只生成了一个共价单键。试填写下列空白。
(1)这五种元素的名称
A B C D E
(2)A与B形成的高价化合物属于___________分子(填“极性”、“非极性”)
(3)C在B中燃烧生成的化合物中化学键有 键和 键(填
离子、极性、非极性)。
(4)B与D形成的化合物分别和E的氢化物、C的最高价氧化物对应的水化物反应的离子方程式:____________________________, ___________________________
(5)在D的最高价氧化物对应的水化物和C的最高价氧化物对应的水化物反应的产物的溶液中通入少量CO2气体,简述现象和理由,并书写出相关的离子方程式:
_____________________________________________________________________
______________________________________________________________________
_____________________________________________________________________。
24、(1)碳;氧;钠;铝;氯 (2)非极性 (3)离子;非极性 (4)Al2O3+6H+=2Al3++3H2O;
Al2O3+2OH—=2AlO2—+H2O (5)溶液中出现白色絮状沉淀,这是因为二氧化碳通入水中生成的碳酸酸性比偏铝酸的酸性强,强酸可制弱酸。Al(OH)3+ OH—= AlO2—+2H2O;
2AlO2—+3H2O+CO2== 2Al(OH)3↓+CO32—
30.下表是元素周期表的一部分
族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA O
1
2 D
3 B C F E
4 A
(1)写出单质的化学式:B 、D 、E ;
⑵ A核外电子排布为 ,C离子的电子式 ,D-和B+的电子层结构都与 电子层结构相同;
(3)AD2、HD电子式 ,F最高价氧化物的化学式 ;
(4)能生成两性氢氧化物的元素是 ,其最高价氧化物对应水化物与强碱溶液反应的离子方程式 .
30.(1)B:Na D:F2 E:Ar (2) ;Al3+ ;Ne原子
Cl2O7
(4)Al; Al(OH)3+OH- == AlO2-+2H2O
27.(6分) A、B、C、D四种元素在周期表中分别处于元素X的四周(如下图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
B
A X C
D
(1)各元素的符号:
A:_____,B:____,C:____, X:_____。
(2) C、D、X最高价氧化物对应水化物酸性由强到弱的顺序:___________。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:______________。
(1)Si N S As P (2)H2SO4>H 3PO4>H3AsO4 (3)NH3>PH3>SiH4
21、(10分)在元素周期表1——18号元素中,A元素的单质能与水剧烈反应放出气体,A成为稳定的气态氢化物;B元素的气态氢化物溶于水,溶液呈碱性;C元素阳离子与A元素的阴离子电子层结构相同,0.1mol C单质与足量盐酸反应,生成的H2在标准状况下体积为3.36L;D元素的原子序数等于B元素原子序数的2倍.
⑴A、B、C、D的元素符号分别是 , , , .
⑵用电子式表示B的气态氢化物的形成过程: .
⑶写出在可溶性C盐溶液中逐滴加入氢氧化钠溶液直至过量的离子方程式: .
⑷A单质的氧化性比B单质 ,C单质的还原性比D单质 .(填“强”或“弱”)
21(10分)⑴ F , N , Al , Si
⑵略⑶ Al3++4OH-=AlO2-+2H2O
⑷ 强 , 强 (填“强”或“弱”)
17.有几种元素的微粒的最外电子层结构如图所示,其中:
(1)某电中性微粒一般不和其他元素的原子反应,这种微
粒符号是________。
(2)某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,
这种微粒符号是_______。
(3)某微粒氧化性甚弱,但得到电子后还原性强,且这种原子有一个单电子,
微粒符号是________。
(4)某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的
符号是___________。
17.
(1)Ar ( 2) Cl- (3) K+ (4) S2-
34.现有前四周期中的A、B、C、D、E五种主族元素,A的最高价氧化物含A40%,A原子中质子数等于中子数;B是同周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合 物 ,且B、D两离子的电子层结构相同;C和D能形成CD3的化合物;C原子比E原子多1个电子; 1.8gC与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24L;C原子中质子 数比中子数少1;D原子比A原子多1个质子.则:
(1)五种元素的元素符号分别为:A ,B ,C ,D ,E
(2)五种元素中,单质还原性最强的是 ,简单离子还原性最强的是 .
(3)依次写出A—E五种元素最高价氧化物对应水化物的化学式 、 、 、
、 ,其中酸性最强的是 ,碱性最强的是 .
(4)D单质与B的最高价氧化物的水化物反应的离子方程式 ___.
(5)B、C元素的最高价氧化物的水化物之间反应的化学方程式 ___________.
34.(1)S、K、Al、Cl、Mg (2)K、S2-
(3)H2SO4、KOH、Al(OH)3、HClO4、Mg(OH)2、HClO4、KOH
(4)Cl2+2OH →cl-+ClO +HCO (5)H3AlO3+KOH→KAlO2+2H2O
5.下列说法中,错误的是
A.人类目前所直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界最重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
6.下列说法中,错误的是
A.化学反应必然伴随发生能量变化
B.化学变化中的能量变化主要是由化学键变化引起的
C.化学反应中能量变化的大小与反应物的质量多少无关
D.能量变化是化学反应的基本特征之一
7.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100kPa时,l mol石墨转化为金刚石,要吸收1.895 kJ的热能。据此,试判断在100 kPa压强下,下列结论正确的是
A.石墨比金刚石稳定
D.金刚石比石墨稳定
C.1mol石墨比lmol金刚石的总能量高
D.1mol石墨比lmol金刚石的总能量低
8.阅读下面的叙述,回答有关问题。
“生物质”是指由植物或动物生命体衍生得到的物质的总称。作为人类解决能源危机重要途径之一的“生物质能”,主要指用树木、庄稼、草类等植物直接或间接提供的能量。古老的刀耕火种、烧柴做饭、烧炭取暖等粗放用能方式正在被现代科学技术所改变。
(1)下面有关“生物质能”的说法,不正确的是
A.利用生物质能就是间接利用太阳能
B.生物质能源是可再生的能源
C.生物质能源是解决农村能源的主要途径
D.生物质能的缺点是严重污染环境
(2)沼气是有机废弃物(树叶、秸秆、萆类及垃圾、粪便等)在隔绝空气的条件下发酵分解
而成的气体,主要成分是甲烷。农村沼气池中发酵后的池底剩余物是很好的沤肥。下面有关结论中,错误的是
A.沼气是一种清洁的能源
B.使用沼气作能源可以保护森林 、
C.使用沼气给农民的生活带来了不便
D.使用沼气是对化学能的充分利用
2
8
2
8
+20
A
C B D
PAGE
1
化 学
命题:熊维平 2009年3月
注意:本卷所有答案都写入答题卷中, 考后试卷自己保存
可能用到的相对原子质量: O=16 Na=23 Mg=24 Al=27 S=32 Ca=40
一、选择题(只有1个选项,3×18=54分)
1.“生物质”是指由植物或动物生命体衍生得到的物质的总称。作为人类解决能源危机重要
途径之一的“生物质能”,主要指用树木、庄稼、草类等植物直接或间接提供的能量。古
老的刀耕火种、烧柴做饭、烧炭取暖等粗放用能方式正在被现代科学技术所改变。下面
有关“生物质能”的说法,不正确的是
A.生物质能的缺点是严重污染环境
B.生物质能源是可再生的能源
C.利用生物质能就是间接利用太阳能
D.生物质能源是解决农村能源的主要途径
2.不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在近20年来植物生理学、
生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中, 2H、13C、15N、18O、
34S、等常用作环境分析指示物。下列有关说法正确的是
A.34S原子核内中子数为16
B.2H+的结合OH-的能力比1H+的更强
C.13C和15N原子核内的质子数相差2
D.1H216O和1H218O的相对分子质量不同
3.下列关于元素周期表的说法错误的是
A.元素周期表是元素周期律的具体表现形式
B.是先有元素周期律,再有元素周期表的
C.中学课本上的元素周期表是常用的一种形式,也是唯一的一种形式
D.同一周期的元素原子的电子层数大都相等
4.下列各组顺序的排列不正确的是
A.离子半径:F->Na+>Mg2+>Al3+
B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱:H3AlO3
5.下列数字为几种元素的核电荷数,其中核外最外层电子数最多的是
A.8 B.14 C.20 D.33
6.核外电子数相等的原子一定是
① 同种元素 ②同种原子 ③质子数相同 ④质量数相同 ⑤同位素
A.①②③ B.①③
C.①②③④ D.全部
7.原子系数为83的元素位于:①第五周期;②第六周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是
A.①④ B.②④
C.②③ D.①⑤
8.某元素原子最外层有两个电子,该元素
A.一定是第二主族元素
B.一定是非金属元素
C.一定是稀有气体元素
D.可能是金属元素
9.短周期元素X、Y、Z在周期表中的位置关系如图所示,则下列叙述中正确的是
A.X、Y、Z均为金属元素
B.无法确定X、Y、Z各为何种元素
C.Y的最高价氧化物的水化物是一种强酸
D.Y的氢化物稳定性大于Z的氢化物稳定性
10.A和B是同周期相邻的元素,A和C是同主族相邻的元素,已知三种元素的核电荷数之和为33,则B可能是
A.氯元素 B.氮元素 C.硅元素 D.铝元素
11.X、Y分别为元素周期表ⅦA中第三、四周期的两种元素,下列有关叙述正确的是
A.X原子的电子层数比Y原子的电子层数多
B.相同条件下,X的单质的密度比Y的单质的密度大
C.常温常压下X的单质的颜色比Y的单质的颜色浅
D.Y的单质能将X从NaX的溶液中置换出来
12.下列叙述中,正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.阳离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
13.下列说法中不正确的是
A.离子化合物中不一定含有金属元素
B.由不同原子所形成的纯净物不一定是化合物
C.分子中一定含有化学键
D.含有金属元素的离子不一定是阳离子
14.同温同压下有等质量的H2、D2、T2三种气体,有下列几种叙述,其中正确地是
①密度之比1:2:3; ②质子数之比6:3:2;
③中子数之比0:3:4; ④体积之比6:3:2;
A.只有①② B.①②③④
C.只有③④ D.只有②④
15.氢气能在氯气中燃烧,反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1Kj,破坏1mol氯气中的化学键消耗的能量为Q2Kj,形成1mol氯化氢气体中的化学键释放的能量为Q3Kj;则下列关系正确地是
A.Q1+Q2>Q3 B.Q1+Q2<2Q3
C.Q1+Q2=2Q3 D.Q1+Q2>2Q3
16.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”,已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,则原子个数比应为
A.61:39 B.30:61
C.1:1 D.39:11
17.已知反应KClO3+6HCl=KCl+3Cl2↑+3H2O,若用K35ClO3和H37Cl作用,则下列说法
中正确的是
A.生成1molCl2转移6mole-
B.生成的氯气中既有35Cl又有37Cl
C.生成的KCl中既有35Cl又有37Cl
D.生成的氯气式量约为74
18.已知A、B、C、D、E是核电核数依次增大的五种短周期主族元素,原子半径按D、E、
B、C、A的顺序依次减小,B和E同主族,则下列推断中,正确的是
A.A、D不可能属于同一族
B.A、B、E至少有两种元素在同一周期
C.C可能是金属元素也可能是非金属元素
D.C、D的单质有可能形成离子化合物
二、主观题(共46分)
19.(10分)下列反应中,属于放热反应的是 ,属于吸热
反应的是 。
①煅烧石灰石(主要成分是CaCO 3)制生石灰(CaO) ②燃烧木炭取暖 ③炸药爆炸
④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
⑦Ba(OH)2 8H2O与NH4Cl反应 ⑧盐酸与金属镁反应 ⑨将胆矾加热使其变为白色粉末 ⑩过氧化钠溶于水中
20.(8分)某金属重4 g,其原子核外有2 mol 电子,核内共有1.204×1024个中子,该金属与足量盐酸反应,有0.2 mol电子发生转移,生成了6.02×1022个阳离子。
(1)该金属元素符号是____________;摩尔质量是____________。
(2)原子核内有________个质子;________个中子。
21.(7分)A、B、C、D四种元素在元素周期表中的位置如右图所示
A为同主族元素中原子半径最小的元素原子,D为该周期中
非金属性最强的元素,请回答下列有关问题
(1)C元素的名称是 ;在周期表的第 周期;第 族;
(2)B元素的原子结构示意图为 ;其气态氢化物的电子式 ;
(3)A、B、C、D四种元素的氢化物中最不稳定的是 ;熔沸点最高的是
。(书写化学式)
22.(9分)X、Y、Z三种主族元素位于周期表中连续的三个不同周期。原子序数:Z>X>Y,其中Y原子的次外层电子数为2,X原子的次外层电子数与Y、Z原子的次外层电子数均不相同,X与Y的族序数之和等于Z的族序数。已知X的氢氧化物难溶于水,Y的最高价氧化物对应的水化物是一种强酸。由此推出:
(1)X是__________,Y是___________,Z是___________。(书写元素符号)
(2)用电子式表示由X、Z两种元素组成的化合物的形成过程:
_________________________________________________。
23.(12分)下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,
已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应。
请回答下列问题:
(1) J的电子式 ;用电子式表示I的形成过程 ;
I与J反应生成的铵盐中存在的化学键的类型 ;
(2) A~J物质中属于离子化合物的是 ;(书写化学式)
(3) F和CO2反应的化学方程式: ;
(4)写出化合物G与I溶液完全反应的离子方程式: 。
南昌一中2008-2009学年度第二学期高一月考试卷
化 学 答 题 卷
座号
一、选择题
题号 1 2 3 4 5 6 7 8 9
答案
题号 10 11 12 13 14 15 16 17 18
答案
二、主观题
19.(10分)
下列反应中,属于放热反应的是 ,属于吸热
反应的是 。
20.(8分)
(1)该金属元素符号是____________;摩尔质量是____________。
(2)原子核内有________个质子;________个中子。
21.(7分)
(1)C元素的名称是 ;在周期表的第 周期;第 族;
(2)B元素的原子结构示意图为 ;其气态氢化物的电子式 ;
(3)A、B、C、D四种元素的氢化物中最不稳定的是 ;熔沸点最高的是
。(书写化学式)
22.(9分)
(1)X是__________,Y是___________,Z是___________。
(2)用电子式表示由Y、Z两种元素组成的化合物的形成过程:
_________________________________________________。
23.(12分)
(1) J的电子式 ;用电子式表示I的形成过程 ;
I与J反应生成的铵盐中存在的化学键的类型 ;
(2) A~J物质中属于离子化合物的是 ;(书写化学式)
(3) F和CO2反应的化学方程式: ;
(4)写出化合物G与I溶液完全反应的离子方程式: 。
参考答案:
题号 1 2 3 4 5 6 7 8 9
答案 A D C D A B B D D
题号 10 11 12 13 14 15 16 17 18
答案 D C C C B B A B D
18.A
A
B C
D E
B
A
B C
D E
C
A
B C只能为硼或后面的元素
D E
19.②③④⑤⑥⑧⑩;①⑦⑨
20.(1)Ca; 40g/mol;
(2) 20; 20
21.(1)磷;三;ⅤA;
(2)硫原子结构示意图;硫化氢的电子式
(3)PH3;H2O
22.(1)N; Mg ; Br ;
(2)MgBr2的形成过程
23.(1)NH3的电子式;HCl的形成过程;NH4Cl的键形
(2)Na2O2;Na2CO3
(3)2Na2O2+2CO2=2Na2CO3+O2
(4) 2H++CO32-=CO2+H2O
备用提:
10.下列说法正确的是
A.离子化合物中可能含有共价键 B.离子化合物中不可能含有共价键
C.共价化合物中可能含有离子键 D.H2O2中不含非极性键
13.按核电荷数的增大,氧族元素的下列性质按递增顺序排列的是
①单质的熔点 ②元素的非金属性 ③氢化物的还原性 ④与氢气反应的能力 ⑤+6价氧化物对应水化物的酸性 ⑥阴离子的半径
A.①②③ B.④⑤⑥ C.③④⑤ D.①③⑥
17.A和M为两种元素,已知A位于短周期,且A2+与M-两种离子的电子数之差为8,则下列说法正确的是
A.A和M的原子序数之差为6
B.A和M原子的最外层电子数之和为9
C.A和M原子的最外层电子数之差为7
D.A和M原子的电子总数之和可能为11
10.已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
14.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已
知12g石墨或金刚石完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是
A.Q1 < Q2
B.石墨不如金刚石稳定
C.石墨具有的能量比金刚石低
D.石墨与金刚石完全燃烧,生成的二氧化碳一样多
3.对于放热反应H2 + Cl2 点燃 2HCl,下列说法正确的是:
A.产物所具有的总能量高于反应物所具有的总能量
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1mol H—H键和1mol Cl—Cl键所吸收的总能量小于形成1mol H—Cl键所放出
的能量
D.该反应中,化学能只有转变为热能
2.已知X、Y均为1—18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原 子
序数小于X的原子序数,则这两种元素的原子序数之和为
A.19 B.18 C.16 D.9
6.甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙阴离子发生置换反应;③
甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性 强;④与某
金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙
的非金属性强的是
A.只有④ B.只有⑤ C.①②③ D.①②③④⑤
8.A、B均为原子序数1—20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个
电子,则B的原子序数是
A.n+4 B.n+6 C.n+8 D.n+10
14.两种微粒的质子数和电子数都相等,则这两种微粒肯定不可能的是
A.两种不同的原子 B.一种原子和一种分子
C.两种不同的离子 D.一种原子和一种离子
20.主族元素X的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确
的是
A.X的原子序数比Y的小 B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大 D.X元素的最高正价比Y的大
14.已知R2+离子核外有a个电子,b个中子,表示R原子符号正确的是
A.R B.R C.R D.R
15.下列说法中错误的是
A.质量数相同的原子,其化学性质一定相同
B.质子数相同的微粒,其核外电子排布也相同
C.金属性越活泼,其原子在反应中越易失去电子
D.非金属性越活泼,其阴离子越容易失去电子
7.下列叙述中,正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布式
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
13.下列叙述正确的是
A.单质分子中一定存在着共价键
B.气态物质中一定存在着共价键
C.全部由非金属元素构成的化合物一定不存在离子键
D.在共价化合物中一定含有共价键
14.下列表示电子式的形成过程正确的是
11.下列叙述中正确的一组是
①离子化合物中只含离子键;
②同周期元素形成的阳离子和阴离子,具有相同的电子层结构;
③化学键是指晶体中或分子中相邻原子间或离子间强烈的相互作用;
④质子数相同的微粒一定属于同一种元素;
⑤同种元素的原子具有相同的质量;
⑥共价化合物中一定不含离子键。
A.①③⑥ B.②④⑤ C.③④ D.③⑥
19.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述中
正确的是
A.原子半径:B>A>C>D B.原子序数:d>c>b>a
C.离子半径:C>D>A>B D.单质的还原性:B
正确的是
X Y
Z W
A.常压下,四种元素单质中,W单质的熔点最高
B.X的气态氢化物比Y的气态氢化物稳定
C.Z的阳离子与Y的阴离子电子层结构相同
D.W元素的金属性比Z元素金属性强
15.下列说法正确的是
A.IA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
47.下列推断符合实际的是
A.第n周期的最后一种金属元素处在第n-l族
B.m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物
C.第n周期有n种主族金属元素(1
11.根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
21.短周期的A、B两种元素,A原子半径小于B原子半径,两种元素可形成A是正价的
AB2型化合物,下列关于两元素的叙述正确的是
①A、B可能属于同一周期 ②A是B的前一周期元素 ③A只能是金属元素,
④A可能是第二周期IIA族或ⅣA族元素:
A.①③ B.②③ C.②④ D.②③④
40.A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出的能
量;C、D两元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收
的能量。若A、B、C、D间分别形成化合物时,属于离子化合物可能性最大的是
A.D2A B.C2B C.C2A D.D2B
15.下列叙述正确的是
A.分子是由一定数目的原子组成的,原子之间的相互作用叫化学键
B.按C、N、O、F的顺序,元素的最高正价依次升高
C.非金属元素之间构成的化合物都不是离子化合物
D.离子化合物中一定含有离子键
17.关于周期表和周期律,下列说法中正确的是
A.在周期表中,元素的族序数都等于其原子的最外层电子数
B.VIIA组元素的单质,随相对分子质量的增大,熔、沸点升高;IA族单质,由上至下,
随相对原子质量递增,熔、沸点下降
C.周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强
D.同主族元素随原子核电荷数的递增,原子半径依次增大
18.有Xn-、Yn+、Z三种微粒,其电子层结构相同,下列分析中正确的是
A.微粒半径大小关系是X>Y B.Z一定是稀有气体元素
C.原子序数关系是Z>Y>X D.微粒半径关系是Xn-
的电子层结构,且A的阳离子氧化性比B的氧化性弱,C的阴离子所带负电荷比D的阴
离子所带负电荷多,则A、B、C、D的原子序数大小关系是
A.B>A>C>D B.C>B>A>D
C.A>B>C>D D.B>A>D>C
15.某碱金属元素R有两种同位素R’和R”,相对原子质量分别是a和b,原子百分组成分
别为X和Y,则R元素的硫酸盐的相对分子质量是
A.2(ax+by)+96 B.2(ay+bx)+96
C.ay+bx+96 D.ax+by+96
16.同主族两种元素原子的核外电子数差值可能为
A.6 B.12 C.26 D.30
29.现有A、B、C、D、E五种主族元素,其中A、C、D、E为短同期元素,A的最高价氧化物中含A40%,A原子中质子数等于中子数;B是第四周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物 ,且B、D两离子的电子层结构相同;C和D能形成CD3的化合物;C原子比E原子多1个电子; 1.8gC与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24L;C原子中质子数比中子数少1;D原子比A原子多1个质子.则:
(1)A、B的元素符号分别为:A ,B
(2)五种元素中,单质还原性最强的是 ,简单离子还原性最强的是 .
(3五种元素最高价氧化物对应水化物中酸性最强的是 ,碱性最强的是 .
(4)D单质与B的最高价氧化物的水化物反应的离子方程式 .
29. (1)S、K
(2)K、S2-
(3)HClO4、KOH
(4)Cl2+2OH ==Cl-+ClO +H2O
24、(9分)位于短周期的四种主族元素A、B、C、D,原子序数依次增大。已知A、C位于同一主族,B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
⑴写出C元素的单质与A2B反应的化学方程式 ;
⑵请写出含B质量分数最高的化合物的电子式 ;
⑶由上述四种元素可形成四种具有漂白作用的物质,请写出其中漂白原理与另三种不同的物质的化学式: ;
⑷写出两种均含有这四种元素的化合物相互反应的离子方程式:
24、(9分)A:氢,B:氧,C:钠,D:硫。
⑴2Na+2H2O=4NaOH+O2↑(2分);
⑵HH(2分);
⑶SO2(2分);
⑷H++HSO3-=SO2↑+H2O(3分);
21.有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍; C燃烧时呈现黄色火焰, C的单质在加热条件下与B的单质反应, 可以得到与D单质颜色相同的固态化合物;D的最高价与最低价之和为其最低价绝对值的两倍,试根据以上叙述回答:
(1)写出A与B两元素所形成化合物的结构式为 ______________;该化合物分子所含有的化学键属于(极性键或非极性键)______________;该化合物分子属于(极性分子或非极性分子)______________;
(2)用电子式表示C与B两元素可能形成的化合物结构________________________;
(3)画出D的原子结构简图 ___________________, 用电子式表示C与D两元素化合物的形成过程 _______________________________________________________。
21.(1)O=C=O; (2分) 极性键(1分); 非极性分子(1分)
.(2) (4分)需写出两种(Na2O,Na2O2)方给4分;写出一种只给1分;
(3)S的原子结构简图及Na2S形成过程电子式表示各2分。
11 已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,
B、C同主族。A与B形成离子化合物A2B中所有离子的电子数相同,其电
子总数为30;D和E可形成含4核10个电子的分子。试回答下列问题:
(1)写出这几种元素的元素符号A:_______、B:________、C________、
D:_______、E:________。
(2)用电子式表示离子化合物A2B的形成过程:_________________________________
(3)写出下列物质的电子式。
①E与B形成的个数比为1:1的化合物:______________
②E与D形成的化合物:_____________
③D、C、E形成的离子化合物:_______________
答案:(1) (2) (3)
24、A、B、C、D、E五种元素的原子序数依次增大,且均小于18;A原子的最外层比B原子的最外层少2个电子,A原子的最外层电子数是次外层电子数的两倍;A、B、C三种元素能结合成化合物C2AB3,在1 mol C2AB3中共有52mol电子,D元素的单质0.5mol与酸全部反应时,有9.03×1023个电子转移,在B与D形成的化合物,D的质量分数为52.94%,D原子核内有14个中子,每个E原子与氢原子化合时只生成了一个共价单键。试填写下列空白。
(1)这五种元素的名称
A B C D E
(2)A与B形成的高价化合物属于___________分子(填“极性”、“非极性”)
(3)C在B中燃烧生成的化合物中化学键有 键和 键(填
离子、极性、非极性)。
(4)B与D形成的化合物分别和E的氢化物、C的最高价氧化物对应的水化物反应的离子方程式:____________________________, ___________________________
(5)在D的最高价氧化物对应的水化物和C的最高价氧化物对应的水化物反应的产物的溶液中通入少量CO2气体,简述现象和理由,并书写出相关的离子方程式:
_____________________________________________________________________
______________________________________________________________________
_____________________________________________________________________。
24、(1)碳;氧;钠;铝;氯 (2)非极性 (3)离子;非极性 (4)Al2O3+6H+=2Al3++3H2O;
Al2O3+2OH—=2AlO2—+H2O (5)溶液中出现白色絮状沉淀,这是因为二氧化碳通入水中生成的碳酸酸性比偏铝酸的酸性强,强酸可制弱酸。Al(OH)3+ OH—= AlO2—+2H2O;
2AlO2—+3H2O+CO2== 2Al(OH)3↓+CO32—
30.下表是元素周期表的一部分
族周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA O
1
2 D
3 B C F E
4 A
(1)写出单质的化学式:B 、D 、E ;
⑵ A核外电子排布为 ,C离子的电子式 ,D-和B+的电子层结构都与 电子层结构相同;
(3)AD2、HD电子式 ,F最高价氧化物的化学式 ;
(4)能生成两性氢氧化物的元素是 ,其最高价氧化物对应水化物与强碱溶液反应的离子方程式 .
30.(1)B:Na D:F2 E:Ar (2) ;Al3+ ;Ne原子
Cl2O7
(4)Al; Al(OH)3+OH- == AlO2-+2H2O
27.(6分) A、B、C、D四种元素在周期表中分别处于元素X的四周(如下图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
B
A X C
D
(1)各元素的符号:
A:_____,B:____,C:____, X:_____。
(2) C、D、X最高价氧化物对应水化物酸性由强到弱的顺序:___________。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:______________。
(1)Si N S As P (2)H2SO4>H 3PO4>H3AsO4 (3)NH3>PH3>SiH4
21、(10分)在元素周期表1——18号元素中,A元素的单质能与水剧烈反应放出气体,A成为稳定的气态氢化物;B元素的气态氢化物溶于水,溶液呈碱性;C元素阳离子与A元素的阴离子电子层结构相同,0.1mol C单质与足量盐酸反应,生成的H2在标准状况下体积为3.36L;D元素的原子序数等于B元素原子序数的2倍.
⑴A、B、C、D的元素符号分别是 , , , .
⑵用电子式表示B的气态氢化物的形成过程: .
⑶写出在可溶性C盐溶液中逐滴加入氢氧化钠溶液直至过量的离子方程式: .
⑷A单质的氧化性比B单质 ,C单质的还原性比D单质 .(填“强”或“弱”)
21(10分)⑴ F , N , Al , Si
⑵略⑶ Al3++4OH-=AlO2-+2H2O
⑷ 强 , 强 (填“强”或“弱”)
17.有几种元素的微粒的最外电子层结构如图所示,其中:
(1)某电中性微粒一般不和其他元素的原子反应,这种微
粒符号是________。
(2)某微粒的盐溶液,加入AgNO3溶液时会出现白色浑浊,
这种微粒符号是_______。
(3)某微粒氧化性甚弱,但得到电子后还原性强,且这种原子有一个单电子,
微粒符号是________。
(4)某微粒具有还原性,且这种微粒失去2个电子即变为原子,这种微粒的
符号是___________。
17.
(1)Ar ( 2) Cl- (3) K+ (4) S2-
34.现有前四周期中的A、B、C、D、E五种主族元素,A的最高价氧化物含A40%,A原子中质子数等于中子数;B是同周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合 物 ,且B、D两离子的电子层结构相同;C和D能形成CD3的化合物;C原子比E原子多1个电子; 1.8gC与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24L;C原子中质子 数比中子数少1;D原子比A原子多1个质子.则:
(1)五种元素的元素符号分别为:A ,B ,C ,D ,E
(2)五种元素中,单质还原性最强的是 ,简单离子还原性最强的是 .
(3)依次写出A—E五种元素最高价氧化物对应水化物的化学式 、 、 、
、 ,其中酸性最强的是 ,碱性最强的是 .
(4)D单质与B的最高价氧化物的水化物反应的离子方程式 ___.
(5)B、C元素的最高价氧化物的水化物之间反应的化学方程式 ___________.
34.(1)S、K、Al、Cl、Mg (2)K、S2-
(3)H2SO4、KOH、Al(OH)3、HClO4、Mg(OH)2、HClO4、KOH
(4)Cl2+2OH →cl-+ClO +HCO (5)H3AlO3+KOH→KAlO2+2H2O
5.下列说法中,错误的是
A.人类目前所直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界最重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
6.下列说法中,错误的是
A.化学反应必然伴随发生能量变化
B.化学变化中的能量变化主要是由化学键变化引起的
C.化学反应中能量变化的大小与反应物的质量多少无关
D.能量变化是化学反应的基本特征之一
7.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100kPa时,l mol石墨转化为金刚石,要吸收1.895 kJ的热能。据此,试判断在100 kPa压强下,下列结论正确的是
A.石墨比金刚石稳定
D.金刚石比石墨稳定
C.1mol石墨比lmol金刚石的总能量高
D.1mol石墨比lmol金刚石的总能量低
8.阅读下面的叙述,回答有关问题。
“生物质”是指由植物或动物生命体衍生得到的物质的总称。作为人类解决能源危机重要途径之一的“生物质能”,主要指用树木、庄稼、草类等植物直接或间接提供的能量。古老的刀耕火种、烧柴做饭、烧炭取暖等粗放用能方式正在被现代科学技术所改变。
(1)下面有关“生物质能”的说法,不正确的是
A.利用生物质能就是间接利用太阳能
B.生物质能源是可再生的能源
C.生物质能源是解决农村能源的主要途径
D.生物质能的缺点是严重污染环境
(2)沼气是有机废弃物(树叶、秸秆、萆类及垃圾、粪便等)在隔绝空气的条件下发酵分解
而成的气体,主要成分是甲烷。农村沼气池中发酵后的池底剩余物是很好的沤肥。下面有关结论中,错误的是
A.沼气是一种清洁的能源
B.使用沼气作能源可以保护森林 、
C.使用沼气给农民的生活带来了不便
D.使用沼气是对化学能的充分利用
2
8
2
8
+20
A
C B D
PAGE
1
