第三节实验室里研究不同价态硫元素间的转化第二课时学案
文档属性
| 名称 | 第三节实验室里研究不同价态硫元素间的转化第二课时学案 |

|
|
| 格式 | rar | ||
| 文件大小 | 14.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-07 00:00:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第2课时 实验室里研究不同价态硫元素间的转化
学习目标:
1.运用氧化还原反反应规律探究不同价态硫之间的转化
2.掌握二氧化硫的化学性质(酸性氧化物的通性,氧化性、
还原性、漂白性)
3.掌握浓硫酸的强氧化性
4.了解二氧化硫对空气的污染,酸雨的防治
学习过程:
二、实验室里研究不同价态硫元素间的转化
1、预测不同价态硫元素的性质
价态 性质
-2价的S
0价的S
+4价的S
+6价的S
2、以H2S(或Na2S)、SO2(或NaSO3)、浓H2SO4为例进行实验探究
[知识回顾]
常见氧化剂
常见还原剂
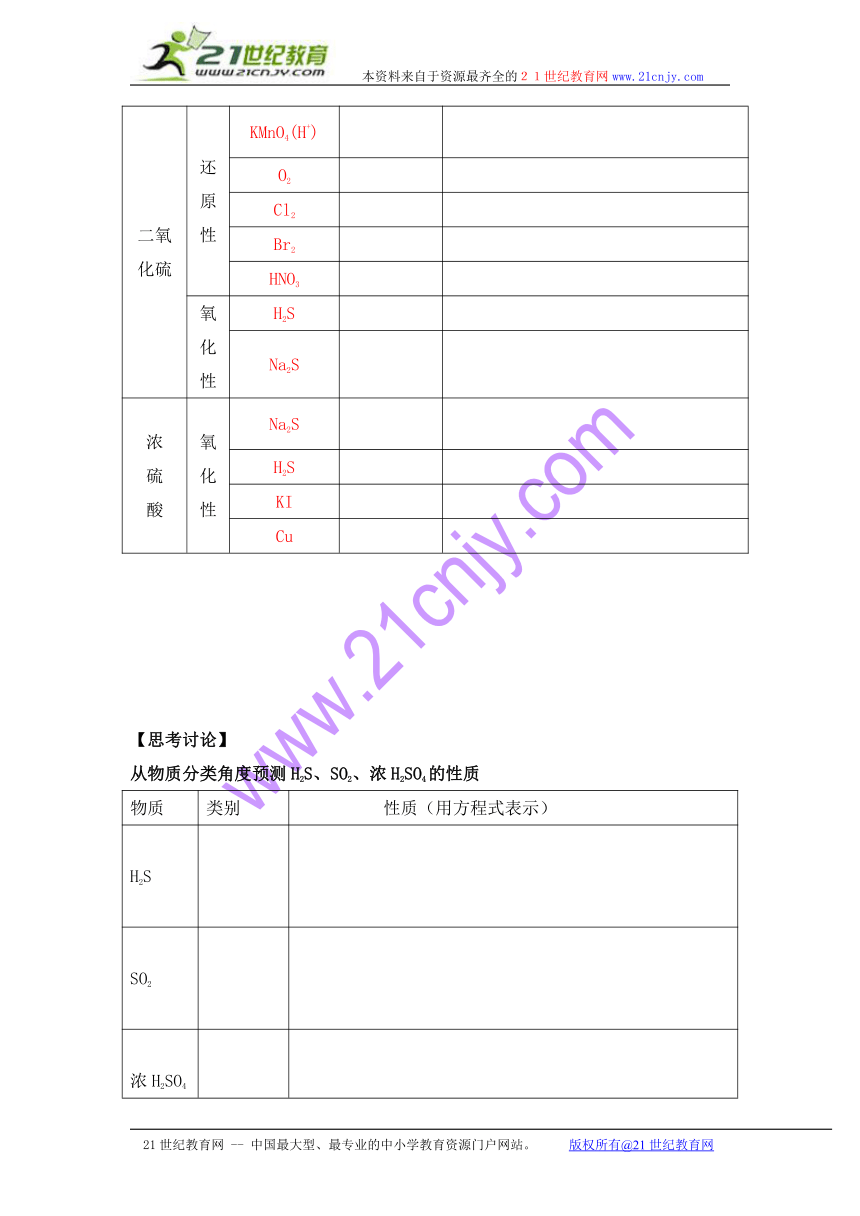
含硫物质 性质 选择的试剂 实验现象 反应化学方程式
H2S(或Na2S) 还原性 KMnO4(H+)
O2
Cl2
Br2
SO2
HNO3
二氧化硫 还原性 KMnO4(H+)
O2
Cl2
Br2
HNO3
氧化性 H2S
Na2S
浓硫酸 氧化性 Na2S
H2S
KI
Cu
【思考讨论】
从物质分类角度预测H2S、SO2、浓H2SO4的性质
物质 类别 性质(用方程式表示)
H2S
SO2
浓H2SO4
三、酸雨及其防治
【阅读】:自读课90页,完成下列各题。
1.酸雨的形成与二氧化硫有何关系?写出有关化学方程式。
2.结合实际谈一下酸雨给人类带来的危害。
3.在防治和减少酸雨形成方面我们应做些什么?
4.我国目前主要利用的能源是煤。假如你是一位工程师,火力发电厂燃烧废气中有二氧化硫,氧气,一氧化碳等。你将采取什么措施防止二氧化硫排放到大气中?
课后练习:
1. 区别二氧化硫气体和二氧化碳气体的方法是( )
A、通入澄清的石灰水 B、根据有无毒性
C、用湿润的蓝色石蕊试纸 D、用品红溶液
1. 酸雨形成的最主要原因是( )
A、森林受到了乱砍滥伐,破坏了生态平衡 B、工业上燃烧了大量含硫的燃料
C、大气中二氧化碳的含量增多 D、汽车排放出大量尾气
1. 已知SO2+Cl2+2H2O=H2SO4+2HCl,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质( )
A、立即褪色 B、慢慢褪色 C、先褪色后复原 D、颜色不褪
1. 下列反应中SO2被氧化的是( )
A、SO2+2NaOH=Na2SO3+H2O B、2H2S+SO2=3S↓+2H2O
C、SO2+H2O+Na2SO3=2NaHSO3 D、Cl2+SO2+2H2O=H2SO4+2HCl
1. 下列气体既具有氧化性又有还原性的是( )
A.SO2 B、SO3 C、O2 D、CO2
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第2课时 实验室里研究不同价态硫元素间的转化
学习目标:
1.运用氧化还原反反应规律探究不同价态硫之间的转化
2.掌握二氧化硫的化学性质(酸性氧化物的通性,氧化性、
还原性、漂白性)
3.掌握浓硫酸的强氧化性
4.了解二氧化硫对空气的污染,酸雨的防治
学习过程:
二、实验室里研究不同价态硫元素间的转化
1、预测不同价态硫元素的性质
价态 性质
-2价的S
0价的S
+4价的S
+6价的S
2、以H2S(或Na2S)、SO2(或NaSO3)、浓H2SO4为例进行实验探究
[知识回顾]
常见氧化剂
常见还原剂
含硫物质 性质 选择的试剂 实验现象 反应化学方程式
H2S(或Na2S) 还原性 KMnO4(H+)
O2
Cl2
Br2
SO2
HNO3
二氧化硫 还原性 KMnO4(H+)
O2
Cl2
Br2
HNO3
氧化性 H2S
Na2S
浓硫酸 氧化性 Na2S
H2S
KI
Cu
【思考讨论】
从物质分类角度预测H2S、SO2、浓H2SO4的性质
物质 类别 性质(用方程式表示)
H2S
SO2
浓H2SO4
三、酸雨及其防治
【阅读】:自读课90页,完成下列各题。
1.酸雨的形成与二氧化硫有何关系?写出有关化学方程式。
2.结合实际谈一下酸雨给人类带来的危害。
3.在防治和减少酸雨形成方面我们应做些什么?
4.我国目前主要利用的能源是煤。假如你是一位工程师,火力发电厂燃烧废气中有二氧化硫,氧气,一氧化碳等。你将采取什么措施防止二氧化硫排放到大气中?
课后练习:
1. 区别二氧化硫气体和二氧化碳气体的方法是( )
A、通入澄清的石灰水 B、根据有无毒性
C、用湿润的蓝色石蕊试纸 D、用品红溶液
1. 酸雨形成的最主要原因是( )
A、森林受到了乱砍滥伐,破坏了生态平衡 B、工业上燃烧了大量含硫的燃料
C、大气中二氧化碳的含量增多 D、汽车排放出大量尾气
1. 已知SO2+Cl2+2H2O=H2SO4+2HCl,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质( )
A、立即褪色 B、慢慢褪色 C、先褪色后复原 D、颜色不褪
1. 下列反应中SO2被氧化的是( )
A、SO2+2NaOH=Na2SO3+H2O B、2H2S+SO2=3S↓+2H2O
C、SO2+H2O+Na2SO3=2NaHSO3 D、Cl2+SO2+2H2O=H2SO4+2HCl
1. 下列气体既具有氧化性又有还原性的是( )
A.SO2 B、SO3 C、O2 D、CO2
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
