化学:第三章《金属及其化合物》教案(新人教版必修1)
文档属性
| 名称 | 化学:第三章《金属及其化合物》教案(新人教版必修1) |
|
|
| 格式 | rar | ||
| 文件大小 | 78.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-15 00:00:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
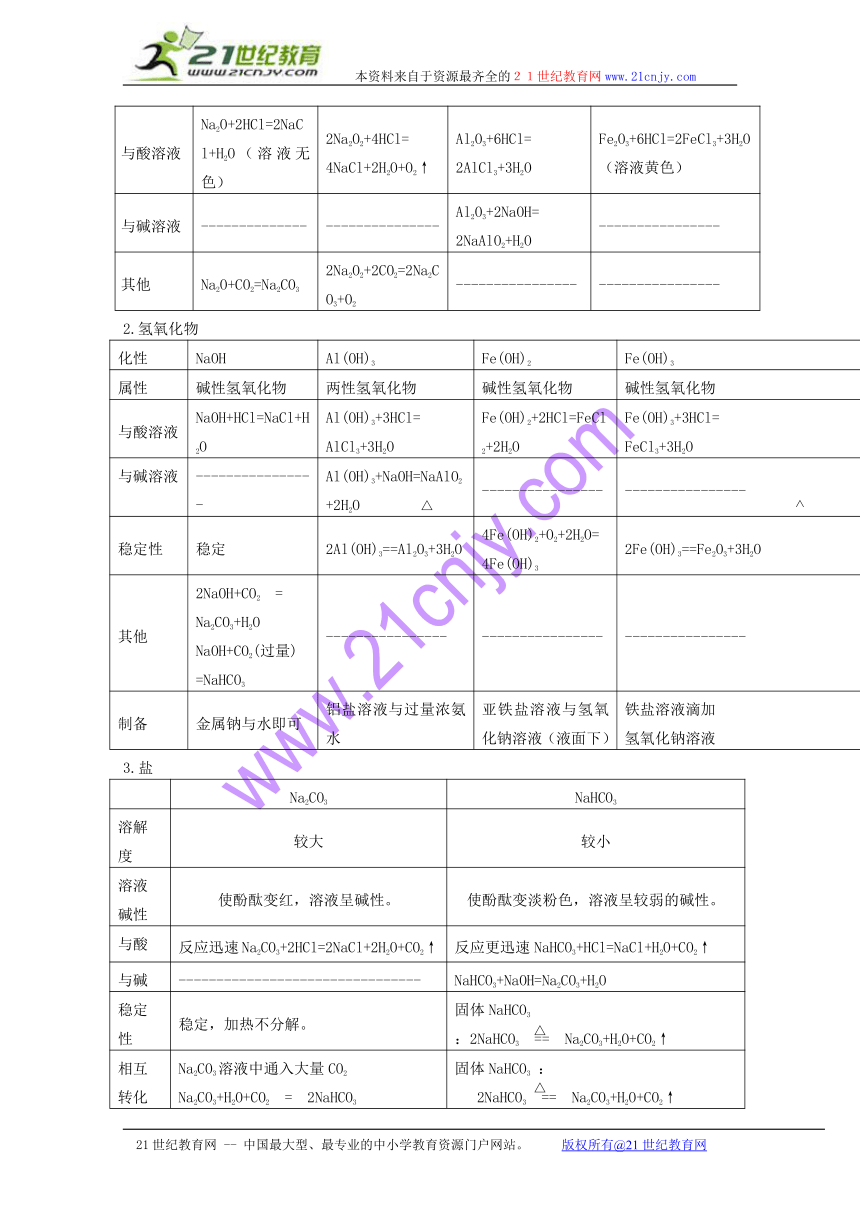
第三章《金属及其化合物》复习提纲
一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。
二、金属的化学性质:
多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。
物质 Na Al Fe
保存 煤油(或石蜡油)中 直接在试剂瓶中即可 直接在试剂瓶中
化性 常温下氧化成Na2O:4Na + O2 = 2Na2O点燃生成Na2O22Na + O2 == Na2O2 常温下生成致密氧化膜:4Al + 3O2 = 2Al2O3致密氧化膜使铝耐腐蚀。纯氧中可燃,生成氧化铝:4Al + 3O2 == 2Al2O3 潮湿空气中易受腐蚀:铁锈:主要成分Fe2O3纯氧中点燃生成:3Fe+2O2 == Fe3O4
与 O2
与Cl2 2Na+Cl2 == 2NaCl 2Al+3Cl2 == 2AlCl3 2Fe+3Cl2== 2FeCl3
与S 常温下即可反应:2Na + S = Na2S 加热时才能反应:2Al + 3S == Al2S3 加热只能生成亚铁盐:Fe + S == FeS
与水 常温与冷水剧烈反应:2Na+2H2O=2NaOH+H2↑ 去膜后与热水反应:2Al+6H2O==2Al(OH)3↓+3H2↑ 常温下纯铁不与水反应。加热时才与水蒸气反应:3Fe+4H2O(g) == Fe3O4+4H2
与 酸溶 液 2Na+2HCl=2NaCl+H2↑ 2Al+6HCl==2AlCl3+ 3H2↑ Fe+2HCl=FeCl2+H2↑
与 碱 溶 液 ---------------------- 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ---------------------
与 盐溶 液 与硫酸铜溶液:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑与氯化铁溶液:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑ 置换出较不活泼的金属单质 置换出较不活泼的金属单质
与 氧化 物 ---------------------- 镁条引燃时铝热反应:2Al+Fe2O3==Al2O3+2Fe ---------------------
金属活泼性逐渐减弱
三、金属化合物的性质:
1.氧化物
Na2O Na2O2 Al2O3 Fe2O3
性质 碱性氧化物 非碱性氧化物 两性氧化物 碱性氧化物
颜色状态 白色固体 淡黄色固体 白色固体 赤红色固体
与水反应 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑ ---------------- ----------------
与酸溶液 Na2O+2HCl=2NaCl+H2O(溶液无色) 2Na2O2+4HCl=4NaCl+2H2O+O2↑ Al2O3+6HCl=2AlCl3+3H2O Fe2O3+6HCl=2FeCl3+3H2O(溶液黄色)
与碱溶液 -------------- --------------- Al2O3+2NaOH=2NaAlO2+H2O ----------------
其他 Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2 ---------------- ----------------
2.氢氧化物
化性 NaOH Al(OH)3 Fe(OH)2 Fe(OH)3
属性 碱性氢氧化物 两性氢氧化物 碱性氢氧化物 碱性氢氧化物
与酸溶液 NaOH+HCl=NaCl+H2O Al(OH)3+3HCl=AlCl3+3H2O Fe(OH)2+2HCl=FeCl2+2H2O Fe(OH)3+3HCl=FeCl3+3H2O
与碱溶液 ---------------- Al(OH)3+NaOH=NaAlO2+2H2O ---------------- ----------------
稳定性 稳定 2Al(OH)3==Al2O3+3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O
其他 2NaOH+CO2 =Na2CO3+H2ONaOH+CO2(过量)=NaHCO3 ---------------- ---------------- ----------------
制备 金属钠与水即可 铝盐溶液与过量浓氨水 亚铁盐溶液与氢氧化钠溶液(液面下) 铁盐溶液滴加氢氧化钠溶液
3.盐
Na2CO3 NaHCO3
溶解度 较大 较小
溶液碱性 使酚酞变红,溶液呈碱性。 使酚酞变淡粉色,溶液呈较弱的碱性。
与酸 反应迅速Na2CO3+2HCl=2NaCl+2H2O+CO2↑ 反应更迅速NaHCO3+HCl=NaCl+H2O+CO2↑
与碱 -------------------------------- NaHCO3+NaOH=Na2CO3+H2O
稳定性 稳定,加热不分解。 固体NaHCO3 :2NaHCO3 == Na2CO3+H2O+CO2↑
相互转化 Na2CO3溶液中通入大量CO2Na2CO3+H2O+CO2 = 2NaHCO3 固体NaHCO3 :2NaHCO3 == Na2CO3+H2O+CO2↑
其他 溶液中:Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓ 溶液中:NaHCO3+Ca(OH)2 = NaOH+CaCO3↓+H2O
用途 工业原料等 中和胃酸、制糕点等
金属离子检验:焰色反应呈黄色
FeCl2 FeCl3
颜色 浅绿色 黄色
与碱溶液 FeCl2+2NaOH = Fe(OH)2↓+2NaCl FeCl3+3NaOH= Fe(OH)3↓+3NaCl
相互转化 2FeCl2+Cl2 = 2FeCl3 2FeBr2+Br2 = 2FeBr3主要表现: 性(还原性) 2FeCl3+Fe = 3FeCl2 2FeBr3+Fe = 3FeBr2表现: 性(氧化性)
检验 遇KSCN不显血红色,加入氯水后显红色 遇KSCN显血红色
用途 净水剂等 印刷线路板等
四、金属及其化合物之间的相互转化
1.铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。
⑩NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
2.铁及其重要化合物之间的转化关系,写出相应的化学反应方程式。
3.钠及其化合物之间的相互转化,写出相应的化学反应方程式。
附:1.焰色反应:用于在火焰上呈现特殊颜色的金属或它们的化合物的检验。
注:观察钾焰色反应时,应透过蓝色钴玻璃,以便滤去杂质钠的黄光。
2.碳酸钠、碳酸氢钠:Na2CO3又叫纯碱,俗称苏打。无水碳酸钠是白色粉末。NaHCO3俗称小苏打,也叫酸式碳酸钠。它是白色粉末,在水中的溶解度比碳酸钠略小,水溶液呈微碱性,固体碳酸氢钠受热即分解。NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。将碳酸钠溶液或结晶碳酸钠吸收CO2可制得碳酸氢钠。
3.氧化铝、氢氧化铝
(1)Al2O3俗名矾土,是一种难熔又不溶于水的白色粉末。它的熔点、沸点都高于2000度。
(2)氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。氢氧化铝可用来制备铝盐,作吸附剂等的原料。氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。
10.合金:
21世纪教育网
www.
w.w.w.k.s.5.u.c.o.m
www.
点燃
点燃
点燃
点燃
点燃
点燃
△
△
△
△
点燃
△
△
△
△
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第三章《金属及其化合物》复习提纲
一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。
二、金属的化学性质:
多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。
物质 Na Al Fe
保存 煤油(或石蜡油)中 直接在试剂瓶中即可 直接在试剂瓶中
化性 常温下氧化成Na2O:4Na + O2 = 2Na2O点燃生成Na2O22Na + O2 == Na2O2 常温下生成致密氧化膜:4Al + 3O2 = 2Al2O3致密氧化膜使铝耐腐蚀。纯氧中可燃,生成氧化铝:4Al + 3O2 == 2Al2O3 潮湿空气中易受腐蚀:铁锈:主要成分Fe2O3纯氧中点燃生成:3Fe+2O2 == Fe3O4
与 O2
与Cl2 2Na+Cl2 == 2NaCl 2Al+3Cl2 == 2AlCl3 2Fe+3Cl2== 2FeCl3
与S 常温下即可反应:2Na + S = Na2S 加热时才能反应:2Al + 3S == Al2S3 加热只能生成亚铁盐:Fe + S == FeS
与水 常温与冷水剧烈反应:2Na+2H2O=2NaOH+H2↑ 去膜后与热水反应:2Al+6H2O==2Al(OH)3↓+3H2↑ 常温下纯铁不与水反应。加热时才与水蒸气反应:3Fe+4H2O(g) == Fe3O4+4H2
与 酸溶 液 2Na+2HCl=2NaCl+H2↑ 2Al+6HCl==2AlCl3+ 3H2↑ Fe+2HCl=FeCl2+H2↑
与 碱 溶 液 ---------------------- 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ---------------------
与 盐溶 液 与硫酸铜溶液:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑与氯化铁溶液:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑ 置换出较不活泼的金属单质 置换出较不活泼的金属单质
与 氧化 物 ---------------------- 镁条引燃时铝热反应:2Al+Fe2O3==Al2O3+2Fe ---------------------
金属活泼性逐渐减弱
三、金属化合物的性质:
1.氧化物
Na2O Na2O2 Al2O3 Fe2O3
性质 碱性氧化物 非碱性氧化物 两性氧化物 碱性氧化物
颜色状态 白色固体 淡黄色固体 白色固体 赤红色固体
与水反应 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑ ---------------- ----------------
与酸溶液 Na2O+2HCl=2NaCl+H2O(溶液无色) 2Na2O2+4HCl=4NaCl+2H2O+O2↑ Al2O3+6HCl=2AlCl3+3H2O Fe2O3+6HCl=2FeCl3+3H2O(溶液黄色)
与碱溶液 -------------- --------------- Al2O3+2NaOH=2NaAlO2+H2O ----------------
其他 Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2 ---------------- ----------------
2.氢氧化物
化性 NaOH Al(OH)3 Fe(OH)2 Fe(OH)3
属性 碱性氢氧化物 两性氢氧化物 碱性氢氧化物 碱性氢氧化物
与酸溶液 NaOH+HCl=NaCl+H2O Al(OH)3+3HCl=AlCl3+3H2O Fe(OH)2+2HCl=FeCl2+2H2O Fe(OH)3+3HCl=FeCl3+3H2O
与碱溶液 ---------------- Al(OH)3+NaOH=NaAlO2+2H2O ---------------- ----------------
稳定性 稳定 2Al(OH)3==Al2O3+3H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O
其他 2NaOH+CO2 =Na2CO3+H2ONaOH+CO2(过量)=NaHCO3 ---------------- ---------------- ----------------
制备 金属钠与水即可 铝盐溶液与过量浓氨水 亚铁盐溶液与氢氧化钠溶液(液面下) 铁盐溶液滴加氢氧化钠溶液
3.盐
Na2CO3 NaHCO3
溶解度 较大 较小
溶液碱性 使酚酞变红,溶液呈碱性。 使酚酞变淡粉色,溶液呈较弱的碱性。
与酸 反应迅速Na2CO3+2HCl=2NaCl+2H2O+CO2↑ 反应更迅速NaHCO3+HCl=NaCl+H2O+CO2↑
与碱 -------------------------------- NaHCO3+NaOH=Na2CO3+H2O
稳定性 稳定,加热不分解。 固体NaHCO3 :2NaHCO3 == Na2CO3+H2O+CO2↑
相互转化 Na2CO3溶液中通入大量CO2Na2CO3+H2O+CO2 = 2NaHCO3 固体NaHCO3 :2NaHCO3 == Na2CO3+H2O+CO2↑
其他 溶液中:Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓ 溶液中:NaHCO3+Ca(OH)2 = NaOH+CaCO3↓+H2O
用途 工业原料等 中和胃酸、制糕点等
金属离子检验:焰色反应呈黄色
FeCl2 FeCl3
颜色 浅绿色 黄色
与碱溶液 FeCl2+2NaOH = Fe(OH)2↓+2NaCl FeCl3+3NaOH= Fe(OH)3↓+3NaCl
相互转化 2FeCl2+Cl2 = 2FeCl3 2FeBr2+Br2 = 2FeBr3主要表现: 性(还原性) 2FeCl3+Fe = 3FeCl2 2FeBr3+Fe = 3FeBr2表现: 性(氧化性)
检验 遇KSCN不显血红色,加入氯水后显红色 遇KSCN显血红色
用途 净水剂等 印刷线路板等
四、金属及其化合物之间的相互转化
1.铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。
⑩NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
2.铁及其重要化合物之间的转化关系,写出相应的化学反应方程式。
3.钠及其化合物之间的相互转化,写出相应的化学反应方程式。
附:1.焰色反应:用于在火焰上呈现特殊颜色的金属或它们的化合物的检验。
注:观察钾焰色反应时,应透过蓝色钴玻璃,以便滤去杂质钠的黄光。
2.碳酸钠、碳酸氢钠:Na2CO3又叫纯碱,俗称苏打。无水碳酸钠是白色粉末。NaHCO3俗称小苏打,也叫酸式碳酸钠。它是白色粉末,在水中的溶解度比碳酸钠略小,水溶液呈微碱性,固体碳酸氢钠受热即分解。NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。将碳酸钠溶液或结晶碳酸钠吸收CO2可制得碳酸氢钠。
3.氧化铝、氢氧化铝
(1)Al2O3俗名矾土,是一种难熔又不溶于水的白色粉末。它的熔点、沸点都高于2000度。
(2)氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。氢氧化铝可用来制备铝盐,作吸附剂等的原料。氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。
10.合金:
21世纪教育网
www.
w.w.w.k.s.5.u.c.o.m
www.
点燃
点燃
点燃
点燃
点燃
点燃
△
△
△
△
点燃
△
△
△
△
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
