化学:2.2.1《分子的立体结构》教案(新人教版选修3)
文档属性
| 名称 | 化学:2.2.1《分子的立体结构》教案(新人教版选修3) |

|
|
| 格式 | rar | ||
| 文件大小 | 47.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-15 00:00:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第二节 分子的立体结构
第一课时
教学目标:
1.了解一些典型分子的立体结构,认识分子结构的多样性和复杂性,理解价层电子对互斥模型。
2.通过对典型分子立体结构探究过程,学会运用观察、比较、分类及归纳等方法对信息进行加工,提高科学探究能力。
3.通过PowerPoint展示分子的立体结构,激发学习化学的兴趣,感受化学世界的奇妙。
教学重点:价层电子对互斥模型
教学难点:能用价层电子对互斥模型解释分子的立体结构
教学方法:分组讨论,启发式、多媒体辅助教学
教学过程:
教师活动 学生活动 设计意图
【投影】 展示CO2、H2O、NH3、CH2O、CH4等分子的球辊模型(或比例模型) 阅读课本P37-40内容;观察一些典型分子的立体结构,观察,分析。 让学生对分子的空间结构有直观的认识
【板书】2.1 形形式式的分子【提出问题】 什么是分子的空间结构?结构式能反映出分子的空间构造吗? 思考,回答。讨论分子在三维空间的构造情况。 让学生区分结构式与空间结构的区别
【归纳】结构式不能反映出分子的空间结构【思考】1.同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?2.同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因? 记忆
【黑板练习】 写出C、H、N、O的电子式,根据共价键的饱和性讨论C、H、N、O的成键情况。原子HCNO电子式可形成共用电子对数1432成键情况1432 复习旧知识,培养学生知识归纳的能力
【归纳】原子不同,可形成的电子对数目不同,共价键的饱和性不同
【黑板练习】 写出CO2、H2O、NH3、CH2O、CH4的电子式和结构式;根据电子式、结构式描述CO2、H2O、NH3、CH2O、CH4的成键情况.分析分子内的原子总数、孤对电子数及空间结构。分子CO2H2ONH3CH2OCH4电子式结构式O=C=OH-O-H原子总数33445孤对电子数无21无无空间结构直线型V型三角锥形平面三角形正四面体 发挥学生的主观能动性 ,通过学生的亲自动手构建模型,能强化学生对常见分子空间结构的了解和记忆。
【归纳】含有同种原子的分子,因为原子形成的共价键的方向性不同,结构不同 学生自主探究CO2、H2O、NH3、CH2O、CH4的球棍模型,分析其结构不同的原因。
【归纳板书】分子结构多样性的原因1.构成分子的原子总数不同2.含有同样数目原子的分子的键角不一样,即共价键方向性的影响。 思考 小结
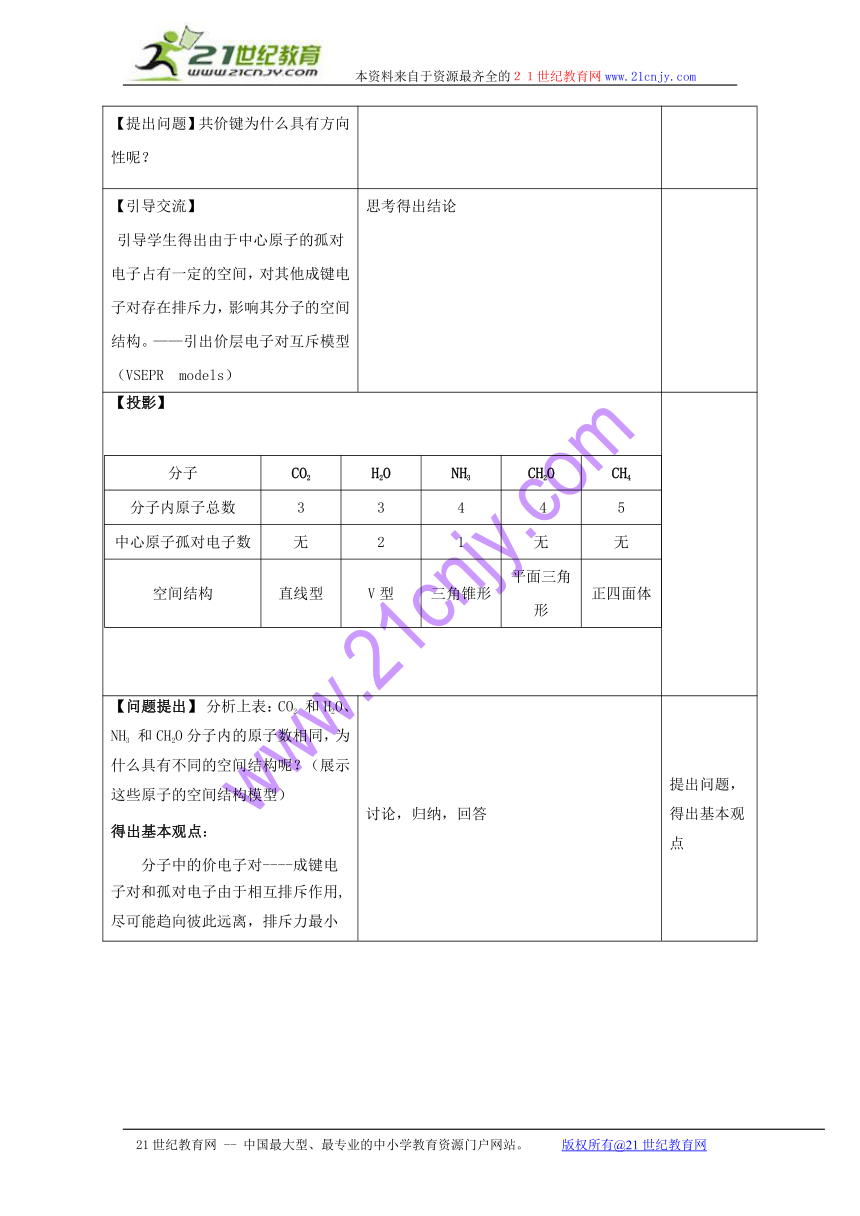
【提出问题】共价键为什么具有方向性呢?
【引导交流】引导学生得出由于中心原子的孤对电子占有一定的空间,对其他成键电子对存在排斥力,影响其分子的空间结构。——引出价层电子对互斥模型(VSEPR models) 思考得出结论
分子CO2H2ONH3CH2OCH4分子内原子总数33445中心原子孤对电子数无21无无空间结构直线型V型三角锥形平面三角形正四面体【投影】
【问题提出】 分析上表:CO2 和H2O、NH3 和CH2O分子内的原子数相同,为什么具有不同的空间结构呢?(展示这些原子的空间结构模型)得出基本观点:分子中的价电子对----成键电子对和孤对电子由于相互排斥作用,尽可能趋向彼此远离,排斥力最小 讨论,归纳,回答 提出问题,得出基本观点
【板书】2.2价层电子对互斥模型【归纳】对于ABm型分子,分子的构型同电子对数目和类型的关系归纳为:【教师活动】投影,引导观察【学生活动】观察,讨论,动手创建模型,思考归纳。【板书】常见分子的立体结构一览表A的电子对数成键电子对数孤对电子对数VSEPR几何构型实例实例构型220直线型CO2直线型330平面三角形CH2O平面三角形21三角形V型440四面体CH4四面体31四面体NH3三角锥22四面体H2OV型660八面体SF6八面体42八面体XeF4平面正方形 分组讨论,让学生自行完成知识体系的构建。
【启发归纳】对于ABm型分子空间结构确定的一般规律为:确定中心原子(A)的价层电子对数n其中,中心原子的价电子数为中心原子的最外层电子数,氢原子和卤素原子按1个价电子计,氧原子和硫原子按不提供价电子算。根据n从上表找出理想的几何结构。根据孤对电子和成键电子对数估计实际构型,要求实际构型应该满足互斥力最小,结构最稳定。 归纳,总结 总结规律
【练习】课本P40页思考与交流 练习 形成性训练
【升华】1.在ABm分子中A与B之间存在共价双键和共价三键的处理办法:将双键或三键当作一对共用电子对来分析。如CO2为直线型。2.价层电子对相互排斥力大小情况:①电子对夹角越小斥力越大;②孤对电子对-孤对电子对>孤对电子对-成键电子>成键电子-成键电子;③三键>双键>单键。 记忆 知识升华
【板书设计】2.1 形形式式的分子一、填写下表,了解原子的成键情况原子HCNO电子式可形成共用电子对数成键情况二、完成下表分子CO2H2ONH3CH2OCH4电子式结构式原子总数孤对电子对数空间结构三、分子结构的多样性1.构成分子的原子总数不同2.含相同原子数目的分子的共价键的方向性不一致2.2价层电子对互斥模型基本观点:分子中的价电子对----成键电子对和孤对电子由于相互排斥作用,尽可能趋向彼此远离,排斥力最小。1.中心原子上的价电子都用于形成共价键。ABn立体结构范例n=2n=3n=4 2.常见分子的立体结构一览表A的电子对数成键电子对数孤对电子数VSEPR几何构型实例实例构型2346 3. 对于ABm型分子空间结构确定的一般规则为:1. 确定中心原子(A)的价层电子对数n其中,中心原子的价电子数为中心原子的最外层电子数,氢原子和卤素原子按1个价电子,氧原子和硫原子按不提供价电子算。2. 根据n从上表找出理想的几何结构。3. 根据孤对电子和成键电子对数估计实际构型,要求实际构型应该满足互斥力最小,结构最稳定。
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第二节 分子的立体结构
第一课时
教学目标:
1.了解一些典型分子的立体结构,认识分子结构的多样性和复杂性,理解价层电子对互斥模型。
2.通过对典型分子立体结构探究过程,学会运用观察、比较、分类及归纳等方法对信息进行加工,提高科学探究能力。
3.通过PowerPoint展示分子的立体结构,激发学习化学的兴趣,感受化学世界的奇妙。
教学重点:价层电子对互斥模型
教学难点:能用价层电子对互斥模型解释分子的立体结构
教学方法:分组讨论,启发式、多媒体辅助教学
教学过程:
教师活动 学生活动 设计意图
【投影】 展示CO2、H2O、NH3、CH2O、CH4等分子的球辊模型(或比例模型) 阅读课本P37-40内容;观察一些典型分子的立体结构,观察,分析。 让学生对分子的空间结构有直观的认识
【板书】2.1 形形式式的分子【提出问题】 什么是分子的空间结构?结构式能反映出分子的空间构造吗? 思考,回答。讨论分子在三维空间的构造情况。 让学生区分结构式与空间结构的区别
【归纳】结构式不能反映出分子的空间结构【思考】1.同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?2.同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因? 记忆
【黑板练习】 写出C、H、N、O的电子式,根据共价键的饱和性讨论C、H、N、O的成键情况。原子HCNO电子式可形成共用电子对数1432成键情况1432 复习旧知识,培养学生知识归纳的能力
【归纳】原子不同,可形成的电子对数目不同,共价键的饱和性不同
【黑板练习】 写出CO2、H2O、NH3、CH2O、CH4的电子式和结构式;根据电子式、结构式描述CO2、H2O、NH3、CH2O、CH4的成键情况.分析分子内的原子总数、孤对电子数及空间结构。分子CO2H2ONH3CH2OCH4电子式结构式O=C=OH-O-H原子总数33445孤对电子数无21无无空间结构直线型V型三角锥形平面三角形正四面体 发挥学生的主观能动性 ,通过学生的亲自动手构建模型,能强化学生对常见分子空间结构的了解和记忆。
【归纳】含有同种原子的分子,因为原子形成的共价键的方向性不同,结构不同 学生自主探究CO2、H2O、NH3、CH2O、CH4的球棍模型,分析其结构不同的原因。
【归纳板书】分子结构多样性的原因1.构成分子的原子总数不同2.含有同样数目原子的分子的键角不一样,即共价键方向性的影响。 思考 小结
【提出问题】共价键为什么具有方向性呢?
【引导交流】引导学生得出由于中心原子的孤对电子占有一定的空间,对其他成键电子对存在排斥力,影响其分子的空间结构。——引出价层电子对互斥模型(VSEPR models) 思考得出结论
分子CO2H2ONH3CH2OCH4分子内原子总数33445中心原子孤对电子数无21无无空间结构直线型V型三角锥形平面三角形正四面体【投影】
【问题提出】 分析上表:CO2 和H2O、NH3 和CH2O分子内的原子数相同,为什么具有不同的空间结构呢?(展示这些原子的空间结构模型)得出基本观点:分子中的价电子对----成键电子对和孤对电子由于相互排斥作用,尽可能趋向彼此远离,排斥力最小 讨论,归纳,回答 提出问题,得出基本观点
【板书】2.2价层电子对互斥模型【归纳】对于ABm型分子,分子的构型同电子对数目和类型的关系归纳为:【教师活动】投影,引导观察【学生活动】观察,讨论,动手创建模型,思考归纳。【板书】常见分子的立体结构一览表A的电子对数成键电子对数孤对电子对数VSEPR几何构型实例实例构型220直线型CO2直线型330平面三角形CH2O平面三角形21三角形V型440四面体CH4四面体31四面体NH3三角锥22四面体H2OV型660八面体SF6八面体42八面体XeF4平面正方形 分组讨论,让学生自行完成知识体系的构建。
【启发归纳】对于ABm型分子空间结构确定的一般规律为:确定中心原子(A)的价层电子对数n其中,中心原子的价电子数为中心原子的最外层电子数,氢原子和卤素原子按1个价电子计,氧原子和硫原子按不提供价电子算。根据n从上表找出理想的几何结构。根据孤对电子和成键电子对数估计实际构型,要求实际构型应该满足互斥力最小,结构最稳定。 归纳,总结 总结规律
【练习】课本P40页思考与交流 练习 形成性训练
【升华】1.在ABm分子中A与B之间存在共价双键和共价三键的处理办法:将双键或三键当作一对共用电子对来分析。如CO2为直线型。2.价层电子对相互排斥力大小情况:①电子对夹角越小斥力越大;②孤对电子对-孤对电子对>孤对电子对-成键电子>成键电子-成键电子;③三键>双键>单键。 记忆 知识升华
【板书设计】2.1 形形式式的分子一、填写下表,了解原子的成键情况原子HCNO电子式可形成共用电子对数成键情况二、完成下表分子CO2H2ONH3CH2OCH4电子式结构式原子总数孤对电子对数空间结构三、分子结构的多样性1.构成分子的原子总数不同2.含相同原子数目的分子的共价键的方向性不一致2.2价层电子对互斥模型基本观点:分子中的价电子对----成键电子对和孤对电子由于相互排斥作用,尽可能趋向彼此远离,排斥力最小。1.中心原子上的价电子都用于形成共价键。ABn立体结构范例n=2n=3n=4 2.常见分子的立体结构一览表A的电子对数成键电子对数孤对电子数VSEPR几何构型实例实例构型2346 3. 对于ABm型分子空间结构确定的一般规则为:1. 确定中心原子(A)的价层电子对数n其中,中心原子的价电子数为中心原子的最外层电子数,氢原子和卤素原子按1个价电子,氧原子和硫原子按不提供价电子算。2. 根据n从上表找出理想的几何结构。3. 根据孤对电子和成键电子对数估计实际构型,要求实际构型应该满足互斥力最小,结构最稳定。
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
