4.4《硫酸、硝酸和氨》教案-新人教必修1
文档属性
| 名称 | 4.4《硫酸、硝酸和氨》教案-新人教必修1 |

|
|
| 格式 | rar | ||
| 文件大小 | 58.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-22 00:00:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第四章 非金属及其化合物
4.硫酸、硝酸和氨
课时安排:
3课时
第1和第2课时:硫酸和硝酸的氧化性
第3课时:氨
4.硫酸、硝酸和氨(第1、2课时)
教学目标:
使学生掌握硫酸和硝酸的氧化性,通过探究硫酸、硝酸的性质,培养学生的动脑、运用知识的能力和观察能力。
教学重点:
浓硫酸和硝酸的氧化性。
教学难点:
浓硫酸、硝酸的氧化性。
教学过程
[引言]硫酸、硝酸和盐酸是我们常说的三大强酸,它们在组成上有什么特点,有什么相似的性质,又有那些不同的性质?
[投影]
酸的通性
稀硫酸 盐酸 硝酸
离子方程式 H2SO4==2H+ + SO42- HCl==H+ + Cl- HNO3==H+ + NO3-
指示剂 紫色石蕊变红
与碱反应 H+ + OH- == H2O
与碱性氧化物反应 CuO + 2H+ == Cu2+ + H2O
与盐反应 CO32- + 2H+ == CO2↑+ H2O
与金属反应 Fe + 2H+ == Fe2+ + H2↑(HNO3不产生H2)
我们在实验室制取氢气时,不用浓硫酸和硝酸来制取,说明它们除了具有酸的通性外还具有特殊性质。
[实验4-8]浓硫酸与铜反应,将产生的气体通入品红溶液,并观察溶液的颜色。
[师问]品红溶液有什么变化?
[生答]品红溶液褪色。
[补充实验]加热褪色的品红溶液,观察其现象。
[提问]浓硫酸与铜反应产生什么物质会引起这样的变化?
[生答]产生了SO2气体。
[展示]浓硫酸与铜反应后的溶液,并提问:溶液的颜色说明产生了什么离子?
[生答]产生了Cu2+。
[师问]硫酸和铜中的元素化合价有什么变化,并分析产物是什么,硫酸和铜各表现什么性质?
[生答]产生了SO2和Cu2+,硫元素从+6价变成了+4价,化合价降低,被还原;铜从0价变成了+2价,被氧化。硫酸表现氧化性,作氧化剂;铜表现还原性,作还原剂。
[讲解]浓硫酸与铜反应除了表现氧化性,还表现酸性。
[板书]一.硫酸和硝酸的氧化性
1.浓硫酸的氧化性
①与金属反应
2H2SO4(浓)+ Cu === CuSO4 + SO2↑+ 2H2O
[补充实验]浓硫酸与蔗糖实验。请同学观察现象,并闻一闻放出气体的气味。
[现象]蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并放出有刺激性气味的气体。
[讲解]蔗糖变黑是因为浓硫酸将蔗糖中的氢和氧以水的形式脱去,从而产生了炭,浓硫酸具有脱水性。
[板书]脱水性:浓硫酸将化合物(主要是有机物)分子中氢、氧两种元素按水的组成比例(2:1)脱去。
C12H22O11 12C + 11H2O
[过渡]浓硫酸与蔗糖反应能放出气体,说明浓硫酸可能与产生C反应。
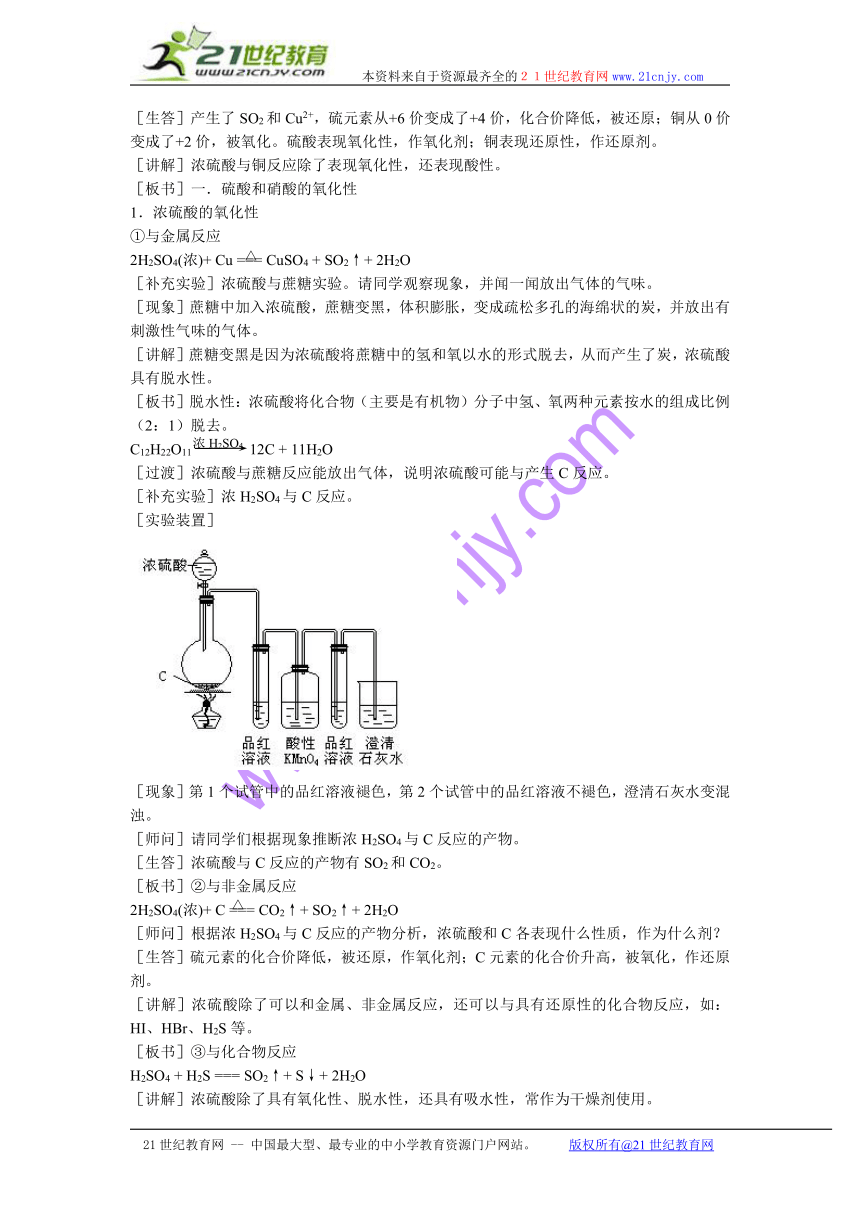
[补充实验]浓H2SO4与C反应。
[实验装置]
[现象]第1个试管中的品红溶液褪色,第2个试管中的品红溶液不褪色,澄清石灰水变混浊。
[师问]请同学们根据现象推断浓H2SO4与C反应的产物。
[生答]浓硫酸与C反应的产物有SO2和CO2。
[板书]②与非金属反应
2H2SO4(浓)+ C === CO2↑+ SO2↑+ 2H2O
[师问]根据浓H2SO4与C反应的产物分析,浓硫酸和C各表现什么性质,作为什么剂?
[生答]硫元素的化合价降低,被还原,作氧化剂;C元素的化合价升高,被氧化,作还原剂。
[讲解]浓硫酸除了可以和金属、非金属反应,还可以与具有还原性的化合物反应,如:HI、HBr、H2S等。
[板书]③与化合物反应
H2SO4 + H2S === SO2↑+ S↓+ 2H2O
[讲解]浓硫酸除了具有氧化性、脱水性,还具有吸水性,常作为干燥剂使用。
[板书]吸水性:吸收现存的水。
吸收结晶水。CuSO4·5H2O ====== CuSO4 + 5H2O
[过渡]硝酸也具有某些与浓硫酸相似的性质。
[板书]2.硝酸的氧化性
[补充实验]浓HNO3、稀HNO3分别与Cu反应
请同学们观察实验现象,并根据现象推断是什么产物,HNO3表现什么性质。
[现象]浓HNO3:反应剧烈,产生红棕色气体,溶液变蓝色
反应缓慢,产生无色气体,进入空气后变红棕色,溶液变蓝
[生答]浓HNO3与Cu反应产生红棕色气体,说明是NO2,则硝酸被还原,表现氧化性。
稀HNO3与Cu反应产生无色气体,遇到空气变成红棕色,说明是NO,则硝酸也被还原,表现氧化性。同时溶液都变成蓝色,则Cu被氧化成+2价。
[板书]①与金属反应
Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑+ 2H2O
3Cu + 8HNO3(稀)=== 3Cu(NO3)2 + 2NO↑+ 4H2O
[探究]稀硝酸与铜反应也有少量红棕色的NO2生成,请设计一个实验证明,铜与稀硝酸反应只产生NO而没有NO2。实验成败的关键是什么?
[生答]隔绝空气。
[投影]下面的装置能否证明上述的问题?
[讲解]硝酸与Cu反应,硝酸的浓度不同,被还原的产物中N元素的价态也不同。通过这点可以说明,硝酸在与其他物质反应时,反应物或反应条件不同,硝酸被还原的产物也不相同。如:
+4 +3 +2 +1 0 -3
NO2 HNO2 NO N2O N2 NH3
[补充实验]浓HNO3与C反应
[讲解]硝酸除了可以与金属反应外,也可以与非金属(如碳、硫)反应,反应的产物类型与浓硫酸与C反应相似。
[板书]②与非金属反应
C + 4HNO3(浓)=== CO2↑+ 4NO2↑+ 2H2O
[过渡]硝酸虽然具有很强的氧化性,但不能溶解金、铂等金属,有没有什么溶液可以溶解金、铂等金属呢?
[投影]《玻尔巧藏金质奖章》的故事
[讲解]故事中提到溶液叫王水,可以溶解金、铂等金属。
[板书]王水:浓硝酸和浓盐酸的混合物(体积比为1︰3)。
[讲解]硝酸也可以氧化具有还原性是化合物,如Fe(NO3)2等。
[板书]③与化合物反应
2HNO3(浓)+ Fe(NO3)2 === Fe(NO3)3 + NO2↑+H2O
4HNO3(稀)+ 3Fe(NO3)2 === 3Fe(NO3)3 + NO↑+2H2O
[总结]浓硫酸与硝酸的特性比较
浓H2SO4 稀HNO3 浓HNO3
强氧化性 与金属 Fe、Al(常温) 钝化 NO 钝化
Cu(加热) SO2(加热) NO NO2
与非金属C(加热) CO2、SO2 CO2、NO2
与化合物 SO2 NO NO2
其他特性 脱水性 王水
吸水性
[讲解]硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。在工业是可用于制化肥、农药、炸药、染料、盐类等。
[板书]3.硫酸和硝酸的用途
板书设计:
4.硫酸、硝酸和氨
一.硫酸和硝酸的氧化性
1.浓硫酸的氧化性
①与金属反应
2H2SO4(浓)+ Cu === CuSO4 + SO2↑+ 2H2O
脱水性:浓硫酸将化合物(主要是有机物)分子中氢、氧两种元素按水的组成比例(2:1)脱去。
C12H22O11 12C + 11H2O
②与非金属反应
2H2SO4(浓)+ C === CO2↑+ SO2↑+ 2H2O
③与化合物反应
H2SO4 + H2S === SO2↑+ S↓+ 2H2O
吸水性:吸收现存的水。
吸收结晶水。CuSO4·5H2O ====== CuSO4 + 5H2O
2.硝酸的氧化性
①与金属反应
Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑+ 2H2O
3Cu + 8HNO3(稀)=== 3Cu(NO3)2 + 2NO↑+ 4H2O
王水:浓硝酸和浓盐酸的混合物(体积比为1︰3)。
②与非金属反应
C + 4HNO3(浓)=== CO2↑+ 4NO2↑+ 2H2O
③与化合物反应
2HNO3(浓)+ Fe(NO3)2 === Fe(NO3)3 + NO2↑+H2O
4HNO3(稀)+ 3Fe(NO3)2 === 3Fe(NO3)3 + NO↑+2H2O
3.硫酸和硝酸的用途
△7
浓H2SO4
△7
浓H2SO4
△7
△7
浓H2SO4
浓H2SO4
△7
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
第四章 非金属及其化合物
4.硫酸、硝酸和氨
课时安排:
3课时
第1和第2课时:硫酸和硝酸的氧化性
第3课时:氨
4.硫酸、硝酸和氨(第1、2课时)
教学目标:
使学生掌握硫酸和硝酸的氧化性,通过探究硫酸、硝酸的性质,培养学生的动脑、运用知识的能力和观察能力。
教学重点:
浓硫酸和硝酸的氧化性。
教学难点:
浓硫酸、硝酸的氧化性。
教学过程
[引言]硫酸、硝酸和盐酸是我们常说的三大强酸,它们在组成上有什么特点,有什么相似的性质,又有那些不同的性质?
[投影]
酸的通性
稀硫酸 盐酸 硝酸
离子方程式 H2SO4==2H+ + SO42- HCl==H+ + Cl- HNO3==H+ + NO3-
指示剂 紫色石蕊变红
与碱反应 H+ + OH- == H2O
与碱性氧化物反应 CuO + 2H+ == Cu2+ + H2O
与盐反应 CO32- + 2H+ == CO2↑+ H2O
与金属反应 Fe + 2H+ == Fe2+ + H2↑(HNO3不产生H2)
我们在实验室制取氢气时,不用浓硫酸和硝酸来制取,说明它们除了具有酸的通性外还具有特殊性质。
[实验4-8]浓硫酸与铜反应,将产生的气体通入品红溶液,并观察溶液的颜色。
[师问]品红溶液有什么变化?
[生答]品红溶液褪色。
[补充实验]加热褪色的品红溶液,观察其现象。
[提问]浓硫酸与铜反应产生什么物质会引起这样的变化?
[生答]产生了SO2气体。
[展示]浓硫酸与铜反应后的溶液,并提问:溶液的颜色说明产生了什么离子?
[生答]产生了Cu2+。
[师问]硫酸和铜中的元素化合价有什么变化,并分析产物是什么,硫酸和铜各表现什么性质?
[生答]产生了SO2和Cu2+,硫元素从+6价变成了+4价,化合价降低,被还原;铜从0价变成了+2价,被氧化。硫酸表现氧化性,作氧化剂;铜表现还原性,作还原剂。
[讲解]浓硫酸与铜反应除了表现氧化性,还表现酸性。
[板书]一.硫酸和硝酸的氧化性
1.浓硫酸的氧化性
①与金属反应
2H2SO4(浓)+ Cu === CuSO4 + SO2↑+ 2H2O
[补充实验]浓硫酸与蔗糖实验。请同学观察现象,并闻一闻放出气体的气味。
[现象]蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并放出有刺激性气味的气体。
[讲解]蔗糖变黑是因为浓硫酸将蔗糖中的氢和氧以水的形式脱去,从而产生了炭,浓硫酸具有脱水性。
[板书]脱水性:浓硫酸将化合物(主要是有机物)分子中氢、氧两种元素按水的组成比例(2:1)脱去。
C12H22O11 12C + 11H2O
[过渡]浓硫酸与蔗糖反应能放出气体,说明浓硫酸可能与产生C反应。
[补充实验]浓H2SO4与C反应。
[实验装置]
[现象]第1个试管中的品红溶液褪色,第2个试管中的品红溶液不褪色,澄清石灰水变混浊。
[师问]请同学们根据现象推断浓H2SO4与C反应的产物。
[生答]浓硫酸与C反应的产物有SO2和CO2。
[板书]②与非金属反应
2H2SO4(浓)+ C === CO2↑+ SO2↑+ 2H2O
[师问]根据浓H2SO4与C反应的产物分析,浓硫酸和C各表现什么性质,作为什么剂?
[生答]硫元素的化合价降低,被还原,作氧化剂;C元素的化合价升高,被氧化,作还原剂。
[讲解]浓硫酸除了可以和金属、非金属反应,还可以与具有还原性的化合物反应,如:HI、HBr、H2S等。
[板书]③与化合物反应
H2SO4 + H2S === SO2↑+ S↓+ 2H2O
[讲解]浓硫酸除了具有氧化性、脱水性,还具有吸水性,常作为干燥剂使用。
[板书]吸水性:吸收现存的水。
吸收结晶水。CuSO4·5H2O ====== CuSO4 + 5H2O
[过渡]硝酸也具有某些与浓硫酸相似的性质。
[板书]2.硝酸的氧化性
[补充实验]浓HNO3、稀HNO3分别与Cu反应
请同学们观察实验现象,并根据现象推断是什么产物,HNO3表现什么性质。
[现象]浓HNO3:反应剧烈,产生红棕色气体,溶液变蓝色
反应缓慢,产生无色气体,进入空气后变红棕色,溶液变蓝
[生答]浓HNO3与Cu反应产生红棕色气体,说明是NO2,则硝酸被还原,表现氧化性。
稀HNO3与Cu反应产生无色气体,遇到空气变成红棕色,说明是NO,则硝酸也被还原,表现氧化性。同时溶液都变成蓝色,则Cu被氧化成+2价。
[板书]①与金属反应
Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑+ 2H2O
3Cu + 8HNO3(稀)=== 3Cu(NO3)2 + 2NO↑+ 4H2O
[探究]稀硝酸与铜反应也有少量红棕色的NO2生成,请设计一个实验证明,铜与稀硝酸反应只产生NO而没有NO2。实验成败的关键是什么?
[生答]隔绝空气。
[投影]下面的装置能否证明上述的问题?
[讲解]硝酸与Cu反应,硝酸的浓度不同,被还原的产物中N元素的价态也不同。通过这点可以说明,硝酸在与其他物质反应时,反应物或反应条件不同,硝酸被还原的产物也不相同。如:
+4 +3 +2 +1 0 -3
NO2 HNO2 NO N2O N2 NH3
[补充实验]浓HNO3与C反应
[讲解]硝酸除了可以与金属反应外,也可以与非金属(如碳、硫)反应,反应的产物类型与浓硫酸与C反应相似。
[板书]②与非金属反应
C + 4HNO3(浓)=== CO2↑+ 4NO2↑+ 2H2O
[过渡]硝酸虽然具有很强的氧化性,但不能溶解金、铂等金属,有没有什么溶液可以溶解金、铂等金属呢?
[投影]《玻尔巧藏金质奖章》的故事
[讲解]故事中提到溶液叫王水,可以溶解金、铂等金属。
[板书]王水:浓硝酸和浓盐酸的混合物(体积比为1︰3)。
[讲解]硝酸也可以氧化具有还原性是化合物,如Fe(NO3)2等。
[板书]③与化合物反应
2HNO3(浓)+ Fe(NO3)2 === Fe(NO3)3 + NO2↑+H2O
4HNO3(稀)+ 3Fe(NO3)2 === 3Fe(NO3)3 + NO↑+2H2O
[总结]浓硫酸与硝酸的特性比较
浓H2SO4 稀HNO3 浓HNO3
强氧化性 与金属 Fe、Al(常温) 钝化 NO 钝化
Cu(加热) SO2(加热) NO NO2
与非金属C(加热) CO2、SO2 CO2、NO2
与化合物 SO2 NO NO2
其他特性 脱水性 王水
吸水性
[讲解]硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。在工业是可用于制化肥、农药、炸药、染料、盐类等。
[板书]3.硫酸和硝酸的用途
板书设计:
4.硫酸、硝酸和氨
一.硫酸和硝酸的氧化性
1.浓硫酸的氧化性
①与金属反应
2H2SO4(浓)+ Cu === CuSO4 + SO2↑+ 2H2O
脱水性:浓硫酸将化合物(主要是有机物)分子中氢、氧两种元素按水的组成比例(2:1)脱去。
C12H22O11 12C + 11H2O
②与非金属反应
2H2SO4(浓)+ C === CO2↑+ SO2↑+ 2H2O
③与化合物反应
H2SO4 + H2S === SO2↑+ S↓+ 2H2O
吸水性:吸收现存的水。
吸收结晶水。CuSO4·5H2O ====== CuSO4 + 5H2O
2.硝酸的氧化性
①与金属反应
Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑+ 2H2O
3Cu + 8HNO3(稀)=== 3Cu(NO3)2 + 2NO↑+ 4H2O
王水:浓硝酸和浓盐酸的混合物(体积比为1︰3)。
②与非金属反应
C + 4HNO3(浓)=== CO2↑+ 4NO2↑+ 2H2O
③与化合物反应
2HNO3(浓)+ Fe(NO3)2 === Fe(NO3)3 + NO2↑+H2O
4HNO3(稀)+ 3Fe(NO3)2 === 3Fe(NO3)3 + NO↑+2H2O
3.硫酸和硝酸的用途
△7
浓H2SO4
△7
浓H2SO4
△7
△7
浓H2SO4
浓H2SO4
△7
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
