高三复习专题讲座-实验设计
图片预览




文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
高三化学专题复习
——化学实验的方案设计
一、本周教学进度及主要内容:
第三册 第六章 化学实验的方案设计
本讲主要内容
1.掌握实验设计的一般原则、要领、步骤.
2.运用综合性实验多方位培养设计能力.
二、学习指导
(一)实验设计的一般要领、
1.目的:根据一定的条件和要求,运用有关的化学原理和实验技能,对实验的仪器、装置、步骤和方法进行规划和设想,提出可行方案.
2.原则:科学性、可行性、简约性、安全性.
3.步骤:①说明相关的理论根据和实验原理,写出对应的化学方程式.
②选择实验所必需的仪器和药品.
③注明装置的连接顺序和试剂加入的先后顺序及其它操作要领.
④描述有关实验现象,得出正确结论.
(二)实验设计中的仪器选择
根据设计好的方案,选择合适的仪器,必须考虑以下几方面:
1.反应物的状态和性质:
例如:实验室制取O2.
原料 装置 主要仪器
① KClO3、MnO2
固+固 气 大试管、单孔塞管、酒精灯
② KMnO4
③ H2O2、MnO2
液+固 气 烧瓶、分液漏斗、双孔塞导气管
④ H2O、Na2O2
2.反应条件
例如:实验室制Cl2
① MnO2 + 4HCl(浓) MnCl2 + H2O + Cl2↑ 需用酒精灯
② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O 不用酒精灯
又如:加热需分清是直接还是间接加热或是水浴加热,这就决定了是否要用石棉网、烧杯.
另外,加热时温度是否有一定的限制,若有,则还需用到温度计,同时考虑温度计的水银球应放在何处,才是恰当的位置.
3.根据制取物质的需要量
制取少量气体,可用试管来代替烧瓶,启普发生器等大容量的气体发生装置.
量筒、容量瓶、烧杯等都有不同的规格,尽量要选择符合要求的最小规格的仪器.否则既浪费药品又带来误差.
4.是否要控制反应速率等
大多实验中分液漏斗和长颈漏斗选用时无严格区别,只需将长颈漏斗末端液封住,即可起到相同的作用.但是有时只能选择其一.
如用电石制乙炔时,因水与电石反应太激烈,为了控制液体滴加的速度,平缓反应,必须选用分液漏斗.
又如下列两种制H2装置,谁能起到随开随用,随关随停的作用呢?显然只能选择A.
5.生成物的性质
应考虑生成物的状态、溶解性、沸点高低等性质.例如用浓H2SO4、乙醇、溴化钠加热来制取的溴乙烷,蒸馏出的溴乙烷蒸气应通入到冰水浴中冷却.且导气管尽量长一些.
6.根据生成物的纯度要求
一般制取的物质常混有某些杂质,为提高其纯度则应加净化除杂装置.常用的有洗气瓶、干燥管、U型管,若要分离,则可能要用到过滤器、分液漏斗、蒸馏烧瓶等.
7.环境污染和保护
如有毒性、有刺激性的尾气应考虑吸收或其它处理方法.处理方法不同,所用到的仪器、装置也可能不同.
(三)实验设计中的试剂及反应原理的选择
为了实现实验目标,应根据提供的仪器及原料等考虑最佳方案.
例如制备氧气有多种方法,为何一般不用CO2和Na2O2反应来作为实验室制法呢?原因是用一种气体来制备另一种气体,一般会导致所制气体纯度不高,且CO2也要制取.同样,在测定Na2O和Na2O2混合物中Na2O2的质量分数时,采用加入足量水,测出Na2O2与水反应放出的O2体积的方法来测定.
想一想:若用通入CO2的方法来测定Na2O和Na2O2中Na2O2的质量分数,有何不妥?
另外,对试剂的种类、浓稀等问题均要根据具体的反应特点来考虑.
例如:HCl、H2SO4、HNO3在不同的实验中有不同的要求.
① 制NO2:用Cu和浓HNO3.
制NO:用Cu和稀HNO3.
用Cu和浓H2SO4(△)
② 制SO2
或用Na2SO3和稀H2SO4
用CaCO3和稀HCl(或HNO3)
③ 制CO2
或用Na2CO3和稀H2SO4(或HNO3)
用MnO2和浓HCl(稀到一定程度不反应)④ 制Cl2
也可用KMnO4和HCl
⑤ 制H2、H2S、糖类及酯的水解均要用稀H2SO4(否则,可发生其它反应,得不到相应产物或产率、纯度不高).
⑥ 用乙醇制乙烯、酯化反应、蒸糖脱水、乙醇的卤代、苯的硝化、磺化、纤维素的硝化均要用浓H2SO4.
(四)实验设计中有关顺序的选择
1.装置的排列顺序:按气流方向确定仪器的连接顺序.
一般遵循:气体的发生→除杂→干燥→主体实验→尾气处理.
2.接口连接顺序:导管的进出口方向及长短是连接的关键.
洗气装置
吸收气体装置
“长进短出” 水排气装置
一般的向上、向下排气集气装置
气排水装置
“短进长出”
反常的向上、向下排气集气装置
“大进小出”——通过干燥管的气流方向.
请注意气一固反应装置放置的方向不同,则气流方向有所不同.
除杂顺序:应遵循有序、互不干扰的原则.
3.操作顺序:
(1)气体发生:装置连接→气密性检查→装固体药品→加液体药品→其它操作.
(2)加热操作:
①在烧瓶或其它玻璃容器中,加入固体后不能先加热后加液体.原因:热的干的玻璃容器,遇到冷的液体,容器可能爆裂.
②凡用可燃性气体(如H2、PH3、C2H2、CH4等)与固体反应(需加热)时,应在加热前先通原料气驱赶尽装置中的空气,才能加热.若原料气本身有毒性或对环境有害的气体,应点燃尾气或改用其它无毒性气体驱赶,赶尽空气的目的是防止可燃性气体与空气混合受热爆炸.
例如:用H2、CO还原CuO,先通气体后试纯再加热,尾部用燃烧法除去多余H2、CO.
思考:制PH3(一种剧毒性气体易自燃)可用类似制NH3的方法反应为:
PH4I+NaOH PH3↑+NaI+H2 O实验开始时,先往气体发生装置中加入适量乙醚(沸点:34.5℃)并微热,其目的是什么?
提示:加热,乙醚易挥发,利用乙醚蒸气密度大,排尽装置中的空气,以防止PH3自燃或爆炸,影响实验结果及安全.
用反应气赶走空气的另一目的是保证产品的纯度.如用N2与Mg制Mg3N2.若有O2,则更易形成MgO.
④熄灭酒精灯时,一般遵循“先点后灭”的原则.目的是:
(ⅰ)防止产物再被空气氧化,使其在还原性气体中冷却.
(ⅱ)防止可能引起倒吸.
三、综合性实验的典型例析
例1.利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
(A) (B) (C)
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱
石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复
使用),请填写对应的序号:
① 、② 、③ 、④ 、⑤ 、⑥ 、⑦ .
(2)实验中使用了空气,其作用是 ;若通入空气的速度过
快或通入空气的量不足,则所测定Na2CO3的含量 (填“偏高”、“偏低”
或“准确”).
(3)干燥管Ⅱ的作用是 ,若缺乏干燥管Ⅱ,其后
果是 .
(4)若分液漏斗中④的滴液速度过快,将导致实验结果 (填“偏高”、“偏低”
和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量
分数的数学表达式为 .
解:
(1) g;f;d;b;a;e;e.
(2) 使反应产生的CO2气体充分排出,偏低.
(3) 防止空气中的CO2和H2O被吸入干燥管Ⅰ中,使测出的样品中Na2CO3的质量分
数偏大.
(4) 偏低.
(5) ×100%.
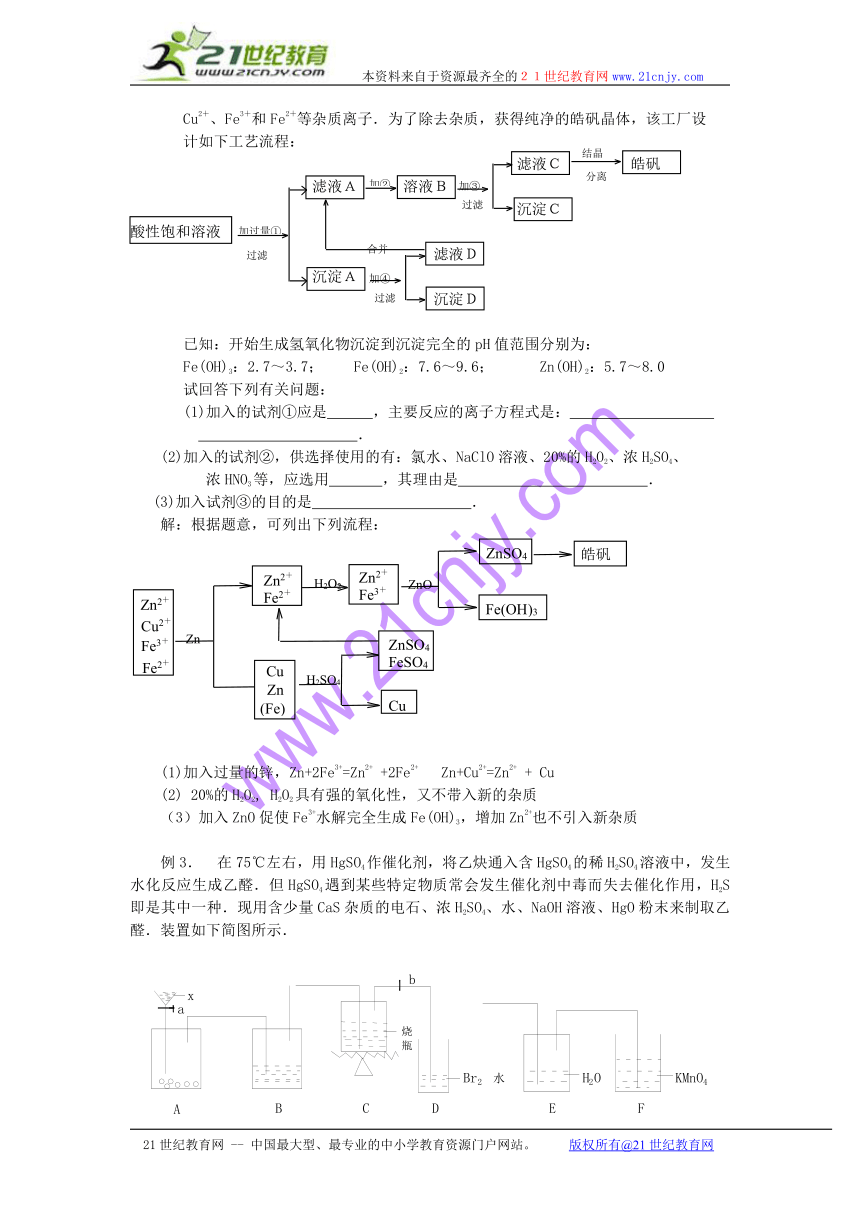
例2某小型化工厂生产皓矾(ZnSO4·7H2O),结晶前的酸性饱和溶液中含有少量的
Cu2+、Fe3+和Fe2+等杂质离子.为了除去杂质,获得纯净的皓矾晶体,该工厂设
计如下工艺流程:
滤液C 皓矾
滤液A 溶液B
沉淀C
酸性饱和溶液
滤液D
沉淀A
沉淀D
已知:开始生成氢氧化物沉淀到沉淀完全的pH值范围分别为:
Fe(OH)3:2.7~3.7; Fe(OH)2:7.6~9.6; Zn(OH)2:5.7~8.0
试回答下列有关问题:
(1)加入的试剂①应是 ,主要反应的离子方程式是:
.
(2)加入的试剂②,供选择使用的有:氯水、NaClO溶液、20%的H2O2、浓H2SO4、
浓HNO3等,应选用 ,其理由是 .
(3)加入试剂③的目的是 .
解:根据题意,可列出下列流程:
(1)加入过量的锌,Zn+2Fe3+=Zn2+ +2Fe2+ Zn+Cu2+=Zn2+ + Cu
(2) 20%的H2O2, H2O2具有强的氧化性,又不带入新的杂质
(3)加入ZnO促使Fe3+水解完全生成Fe(OH)3,增加Zn2+也不引入新杂质
例3. 在75℃左右,用HgSO4作催化剂,将乙炔通入含HgSO4的稀H2SO4溶液中,发生水化反应生成乙醛.但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S即是其中一种.现用含少量CaS杂质的电石、浓H2SO4、水、NaOH溶液、HgO粉末来制取乙醛.装置如下简图所示.
实验前应检查装置的气密性.实验开始时,打开夹子b,用活栓a控制x液体的流量,使A中反应放出的气流平稳、持续.当D中溶液褪色时,用b夹紧橡皮管,撤走D,使橡皮管与E中导管连接.然后点燃C处的酒精灯,同时打开夹b,使反应生成的乙醛蒸气通入E中.回答下列问题:
(1)实验前如何检查装置的气密性? .
(2)烧瓶中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括氧化汞在内的各试剂名称 .
(3)为了得到平稳的气流,液体x通常用 .
(4)B中盛放的试剂是 ,其作用是 ,发生反应的离子方程式 .
(5)为什么要等溴水褪色后才能给烧瓶加热? .
(6)为了使烧瓶受热均匀且控制较准的温度,还需用到 ,加热的方式为
.
(7)F装置的作用是 .
(8)检验E中含有乙醛的方法是 .
解析 (1)该装置较复杂,不能用手捂烧瓶的简单方法.检查该套装置气密性的方法是:
在A、B、D瓶中分别加入少量水,使水面刚浸没漏斗(或长玻导管)下端管口,打开a、b,对烧瓶稍加热,若A、B中导管内水面上升,且D中导管口有气泡逸出,表示装置不漏气.同理夹紧B、C间橡皮管,撤D,按E、F,可检查E、F是否漏气.
(2)HgO、H2O、浓H2SO4.注意:①一般应先加固体后加液体(防止固体粉末沾在潮湿的器壁上);②浓H2SO4稀释的操作顺序:在水中逐滴加入浓H2SO4.
(3)饱和食盐水
(4)NaOH溶液,吸收H2S.
H2S+2OH-=S2-+2H2O
(5)为把烧瓶中空气完全排出,避免乙炔与空气混合遇热发生爆炸.
(6)温度计,(因温度较明确),水浴.
(7)吸收尾气(多余的乙炔和未能冷却的乙醛蒸气),红色变浅,逐渐褪色.(因C2H2、CH3CHO均能与KMnO4溶液反应).
(8)取E中溶液少许,加入新制Cu(OH)2悬浊液,加热,若产生砖红色沉淀,则可证明含有乙醛.
例4 实验室里临时需要用NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体在通入NaOH溶液过程中极易过量生成NaHCO3,且无明显现象.
实验室有下列试剂:①未知浓度的NaOH溶液 ②37%的盐酸 ③37%的硫酸 ④14%的盐酸 ⑤大理石 ⑥ K2CO3固体 ⑦ Cu2(OH)2CO3.
实验室有下列仪器:铁架台、启普发生器、量筒、烧杯、橡皮管、玻璃导管、分液漏斗.
已知下表中各物质在常温时的溶解度(g/100g H2O)
Na2CO3 NaHCO3 NaCl Na2SO4 NaHSO4 NaOH
15.9 8.4 35 35.5 20 40
(1)本实验应选用的仪器:
除启普发生器、橡皮管、玻璃导管外,还需要 .
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品(填编号):
除①外,还需要:
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装可省略).
(4)根据给出的溶解度表,求出当NaOH溶液中溶质的质量分数大于多少时,在配制过程中会有晶体析出?(写出计算步骤和必要的文字说明).
解析 这是一个设计性较强的实验题.从反应原理、试剂到仪器、步骤均要根据题意和已学知识一一分析,作出合理安排.
首先,考虑根据什么反应原理,制得纯净的Na2CO3溶液?
若在NaOH溶液中直接通入适量的CO2,使其只发生反应:CO2+NaOH=Na2CO3.
显然,“适量”两字是难以实际控制的,题干也明确指出此种方法的不足.
若在NaOH溶液中通入足量的CO2,使其生成NaHCO3溶液.再将其加热蒸干灼烧,使其分解为Na2CO3固体,最后溶于水.此方法步骤较多,操作复杂,且蒸干灼烧时也难以做到固体NaHCO3恰好完全分解,何况题中未给酒精灯.
合理的思路是:依据如下反应
CO2 + NaOH = NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
两反应中消耗的NaOH量相等.这是关键,因而必须取两等份的NaOH同种溶液,使其中一份完全转化为NaHCO3,然而再加入另一份NaOH溶液,又使NaHCO3刚好转化为Na2CO3.
其次,考虑怎样选择的合适的试剂和仪器?
欲制CO2,选用哪一种碳酸盐和哪一种酸?
因要用启普发生器,K2CO3固体可溶于水,不能选用.Cu2(OH)2CO3、大理石均为不溶于水的固体.但CaCO3、Cu2(OH)2CO3分别与HCl的反应产生等量的CO2,后者将消耗更多的HCl.故应选用CaCO3.
由于CaCO3和H2SO4反应生成CaSO4微溶物,覆盖在CaCO3固体表面,使反应速率降低.故应选择盐酸.但现有两种不同的盐酸,该选择浓的还是稀的?由于浓盐酸具有挥发性,使CO2中混有HCl,从而与NaOH反应将有NaCl生成,最终无法制得纯净的Na2CO3溶液.故应用稀HCl.
本题答案:
(1)烧杯、量筒(用于量取等体积的两份NaOH溶液).
(2)④、⑤
(3)①量取一定量的NaOH溶液,分成两等份.
②用稀HCl和CaCO 3反应制取CO2(启普发生器进行),向①其中一份NaOH溶液通入过量的CO2气体.
③将两份溶液混合、摇匀.
④从表中可知,NaHCO3常温下的溶解度为8.4g.
设常温下100g水中溶解的NaOH质量为x g时,NaHCO3达饱和
NaOH + CO2 = NaHCO3
40 84
x 8.4
x=4(g)
×100%=3.85%.
故溶液中NaOH的质量分数若大于3.85%,则在步骤②中会有NaHCO3晶体析出.
四、巩固练习
1.用以下三种途径来制取相等质量的硝酸铜:
(1)铜跟浓硝酸反应
(2)铜跟稀硝酸反应
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应
以下叙述正确的是 _________ A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的消酸的物质的量相等
C.所消耗的铜的物质的量是: 途径(3)>途径(1)>途径(2)
D.所消耗的硝酸的物质的量是: 途径(1)>途径(2)>途径(3)
2.已知某无色的混合气体,可能由NH3、HCl、O2、CH3Cl中一种或多种组成.通过如图装置后,洗瓶内有白色沉淀生成.请判断:
(1)原混合物中肯定有_______
原因__________________________(用化学方程表示)
(2)混合物中肯定没有_______
原因__________________________(用文字叙述)
3.现有右图所示装置,为实现下列实验目的,其中y端适合于作入口的是
(A)瓶内盛液体干燥剂,用以干燥气体
(B)瓶内盛液体洗涤剂,用以除去某气体中的杂质
(C)瓶内盛水,用以测量某难溶于水的气体的体积
(D)瓶内贮存气体,加水时气体可被排出
(E)收集密度比空气大的气体
(F)收集密度比空气小的气体
4.某无色混合气体,可能含有CO、CO2、NH3、H2、HCl和H2O(g)中的一种或几种,当混
合气体依次通过石灰水、Ba(OH)2溶液、浓H2SO4、灼热的CuO粉末和无水CuSO4时,
现象依次为澄清石灰水未见浑浊,Ba(OH)2溶液变浑浊,灼热的CuO变红,无水CuSO4
变蓝.由此可知原混合气体中一定含有_____________________.
1.TiCl4是工业上制取聚乙烯的催化剂,它是一种无色液体,沸点136.4℃,在潮湿的
空气中极易水解.工业上制取TiCl4在炭粉存在条件下,将TiO2进行高温氯化.现
利用下图中所给仪器(本题未画出CO2的发生装置)在实验室里制取TiCl4,主要
步骤有:
①连接好装置,在通Cl2前先通入CO2,并持续一段时间.
②锥形瓶中的TiCl4的量不再增加时停止加热,改通CO2,直到瓷管冷却.
③将TiO2、炭粉末混合均匀后,装入管式炉的瓷管中.
④将电炉升温到800℃,改通Cl2,同时在冷凝管中通入冷凝水.
一 二 三 四 五
装置图
管式电炉炭粉和TiO2
(1)正确的操作程序是(填写操作步骤的序号) .
(2)装置(2)中,分液漏斗中的液体是 ,烧瓶中的粉末是 .
(3)操作步骤①的目的是 .
(4)当气体从左向右流向时,图中仪器装置连接顺序是(填仪器序号) .
(5)装置(1)上端的干燥管的作用是 .
(6)上述制取TiCl4的化学方程式 .
5.过碳酸钠(Na2CO4)和HCl反应的化学方程式为:
2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
商品过碳酸钠中往往含有少量的碳酸钠,为了测定其纯度,现称取0.9克样品进
行实验.供实验选用的仪器、试剂如下:
E F
无水CuSO4
① ② ③ ④
G H J K L M
水
5% 饱和
NaOH Ca(OH)2
⑤ ⑥ ⑦ ⑧ ⑨
(1)为了使实验尽可能简单,应选用的装置是 (填编号).
(2)所选用的装置的连接顺序是 (填字母,胶管已略去).
(3)为了能通过实验和计算,求得样品的纯度.所需测定的物质名称和物理量
是 ,若所测定的物质的物理量以质量表示,且为m克,则样品的纯度为
.
(4)实验室有50mL、100mL、500mL三种规格的量筒,实验时选用的量筒的规格为
.
6.已知NH3和CuO反应可得较纯净的铜、氮气和水.现利用氨的还原性来测定氨分子
中各元素的质量分数,同时测定氨氧化的百分含量[在反应中生成的气体用排气法
测出其体积(假设水的体积为标准状况下气体的体积)].
f
d e
碱石灰
A B C D
h i k j l
水
浓 H2SO4
E F G
(1)用上述装置连接成整套实验装置(填写各接口代号与字母):
a接( )( )接( )( )接( )( )接( )( )
( )( )接( )
(2)整套装置安装完毕后,检验气密性的方法是 .
(3)仪器连接好后进行实验时,先点燃 处酒精灯,实验结束时应撤去熄灭
处酒精灯,且应 再熄灭 处的酒精灯,其理由是 .
(4)装置(B)的作用是 .
装置(C)的作用是 .
装置(E)的作用是 .
7.某种碱式碳酸铜是孔雀绿色固体粉末,其组成可表示为:Cu2(OH)2CO3·xH2O在加热
条件下,它在失去结晶水的同时发生分解,反应方程式为:
Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O
现取一定量的固体样品,不准确称量其质量,用两套仪器装置,先后进行两个实验:
实验(Ⅰ):测定该碱式碳酸铜粉末组成中x的值;
实验(Ⅱ):用实验(Ⅰ)结束后的残留固体与乙醇蒸气反应,并检验反应产物.
试回答下列问题:
(1) 现已装配好上面一套仪器装置(装置中必要的铁架台、铁夹、铁圈、酒精灯、石
棉网在图中已略去),套这装置是用来完成上述实验 的(填标号).
(2)用下面的仪器(必要的铁架台、铁夹、酒精灯均在图中略去)组装完成另一个实
验装置.组装时仪器按气流方向从左到右的连接顺序是: → → →
.在这套实验装置中,干燥管H的作用是: .
F
碱石灰 浓
硫
酸
E H G
(3)实验开始时,碱式碳酸铜放在仪器(填仪器对应字母) 中,乙醇放在仪
(填仪器对应字母) 中.
(4)这两套装置中,在实验时需要加热的仪器是(填对应字母) .
(5)实验结束后可见试管D内壁有银白色金属析出.实验中试管A内发生的反应的化
学方程式是: 从试管A通入试管D的导管中气体的成份是(写
名称、其中水蒸气不必填) .
(6)这两套装置中,在实验前后均要连同所盛试剂一起准确称量的仪器是(填对应字
母) ,若用托盘天平称量,其中某次称量记录的数据是51.12g,这样记录
是否合理 (填“合理”或“不合理”).
8.氨与灼热的氧化铜反应生成氮气、铜和化合物X,据此,在27℃和1.01×105Pa时,
将一定质量的氨与氧化铜充分反应,测定反应后生成的氮气的体积及X的质量可
推算出氨分子的组成.试从①浓氨水、②氧化铜、③熟石灰、④硝酸铵晶体、⑤
生石灰、⑥浓硫酸、⑦碱石灰、⑧五氧化磷、⑨水等九种试剂及下图所示的A-H
八种仪器中选出适当试剂和仪器(可重复使用)完成氮分子组成的测定实验.
a b d
e
c
A B C D E
h i
f
F G H
请回答以下有关问题:
(1)实验过程中至少要用到 等试剂(填序号,下同).
(2)应用仪器 组成氨气发生装置;用仪器 作为氨气氧化装置;用仪器
组成测定生成的氮气体积的装置.
(3)氨气发生装置后应连接仪器 ,其任务是 .氨气氧化装置后应连接
仪器 ,其任务是 .
(4)在实际测定过程中,除乳胶管外,不可缺少的仪器还有 ;在实验仪
器装配程序中,仪器G中的导管口i应与导管口 相连接.
(5)实验测得气体积为V L;测得化合物X的装置实验前后的质量分别为W1 g和W2 g,
则氨分子的组成,即氨分子中氮和氢原子个数比为 .
参 考 答 案
1.A、D
2.(A)(B)(D)(E)
3.(1)一定有HCl,因为CH3Cl不溶于水且不与水反应,不可能产生AgCl沉淀
(2)一定无NH3,因为HCl 与NH3不共存
4.(1) ③①④②.
(2) 浓盐酸、MnO2.
(3) 用CO2排尽装置中空气,防止TiCl4水解.
(4) 2、4、5、1、3.
(5) 防止水蒸气进入装置①,避免TiCl4水解.
(6) TiO 2+C+2Cl2 TiCl4+CO2
5.(1) ①②⑧③⑥.
(2) A-B-C-K-J-D.
(3) 氧气的体积,×100%.
(4) 100mL.
6.(1) bcfgdehijkl(其是f与g、d与e可交换).
(2) 点燃酒精灯A微热,若E中有气泡逸出,F中K导管水面上升,证明不漏气.
(3) A、D,冷却至室温,A,防止E中液体倒吸入C中.
(4) 吸收NH4HCO3反应生成的CO2和H2O,以得到纯净的NH3;吸收CuO反应后的水
蒸气;吸收CuO反应后剩余的NH3.
7.(1) Ⅱ.
(2) FGEH;吸收空气中的水蒸气和CO2.
(3) F、C.
(4) A、B、C、F.
(5) C2H5OH + CuO CH3CHO + H2O + CuO 乙醛、乙醇
(6) E、G;不合理.
8.(1) ①②⑤⑨或①②⑦⑨.
(2) C、E;A;D、F、G.
(3) B;干燥氨气;B;吸收生成的水.
(4) 托盘天平、铁架台(带铁夹);f.
(5) :.
△
△
△
⑦
⑥
④
①
→
干燥管Ⅰ 干燥管Ⅱ
③
②
⑤
结晶
加过量①
过滤
加②
加③
过滤
分离
加④
过滤
合并
Fe3+
Zn2+
Cu2+
Fe2+
Zn2+
Fe2+
H2O2
Zn2+
Fe3+
ZnO
ZnSO4
Fe(OH)3
皓矾
ZnSO4
FeSO4
Cu
H2SO4
Cu
Zn
(Fe)
Zn
B C
A
碱石灰
g
CuO
硅胶
△
碱石灰
j k
800℃
△
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
高三化学专题复习
——化学实验的方案设计
一、本周教学进度及主要内容:
第三册 第六章 化学实验的方案设计
本讲主要内容
1.掌握实验设计的一般原则、要领、步骤.
2.运用综合性实验多方位培养设计能力.
二、学习指导
(一)实验设计的一般要领、
1.目的:根据一定的条件和要求,运用有关的化学原理和实验技能,对实验的仪器、装置、步骤和方法进行规划和设想,提出可行方案.
2.原则:科学性、可行性、简约性、安全性.
3.步骤:①说明相关的理论根据和实验原理,写出对应的化学方程式.
②选择实验所必需的仪器和药品.
③注明装置的连接顺序和试剂加入的先后顺序及其它操作要领.
④描述有关实验现象,得出正确结论.
(二)实验设计中的仪器选择
根据设计好的方案,选择合适的仪器,必须考虑以下几方面:
1.反应物的状态和性质:
例如:实验室制取O2.
原料 装置 主要仪器
① KClO3、MnO2
固+固 气 大试管、单孔塞管、酒精灯
② KMnO4
③ H2O2、MnO2
液+固 气 烧瓶、分液漏斗、双孔塞导气管
④ H2O、Na2O2
2.反应条件
例如:实验室制Cl2
① MnO2 + 4HCl(浓) MnCl2 + H2O + Cl2↑ 需用酒精灯
② 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O 不用酒精灯
又如:加热需分清是直接还是间接加热或是水浴加热,这就决定了是否要用石棉网、烧杯.
另外,加热时温度是否有一定的限制,若有,则还需用到温度计,同时考虑温度计的水银球应放在何处,才是恰当的位置.
3.根据制取物质的需要量
制取少量气体,可用试管来代替烧瓶,启普发生器等大容量的气体发生装置.
量筒、容量瓶、烧杯等都有不同的规格,尽量要选择符合要求的最小规格的仪器.否则既浪费药品又带来误差.
4.是否要控制反应速率等
大多实验中分液漏斗和长颈漏斗选用时无严格区别,只需将长颈漏斗末端液封住,即可起到相同的作用.但是有时只能选择其一.
如用电石制乙炔时,因水与电石反应太激烈,为了控制液体滴加的速度,平缓反应,必须选用分液漏斗.
又如下列两种制H2装置,谁能起到随开随用,随关随停的作用呢?显然只能选择A.
5.生成物的性质
应考虑生成物的状态、溶解性、沸点高低等性质.例如用浓H2SO4、乙醇、溴化钠加热来制取的溴乙烷,蒸馏出的溴乙烷蒸气应通入到冰水浴中冷却.且导气管尽量长一些.
6.根据生成物的纯度要求
一般制取的物质常混有某些杂质,为提高其纯度则应加净化除杂装置.常用的有洗气瓶、干燥管、U型管,若要分离,则可能要用到过滤器、分液漏斗、蒸馏烧瓶等.
7.环境污染和保护
如有毒性、有刺激性的尾气应考虑吸收或其它处理方法.处理方法不同,所用到的仪器、装置也可能不同.
(三)实验设计中的试剂及反应原理的选择
为了实现实验目标,应根据提供的仪器及原料等考虑最佳方案.
例如制备氧气有多种方法,为何一般不用CO2和Na2O2反应来作为实验室制法呢?原因是用一种气体来制备另一种气体,一般会导致所制气体纯度不高,且CO2也要制取.同样,在测定Na2O和Na2O2混合物中Na2O2的质量分数时,采用加入足量水,测出Na2O2与水反应放出的O2体积的方法来测定.
想一想:若用通入CO2的方法来测定Na2O和Na2O2中Na2O2的质量分数,有何不妥?
另外,对试剂的种类、浓稀等问题均要根据具体的反应特点来考虑.
例如:HCl、H2SO4、HNO3在不同的实验中有不同的要求.
① 制NO2:用Cu和浓HNO3.
制NO:用Cu和稀HNO3.
用Cu和浓H2SO4(△)
② 制SO2
或用Na2SO3和稀H2SO4
用CaCO3和稀HCl(或HNO3)
③ 制CO2
或用Na2CO3和稀H2SO4(或HNO3)
用MnO2和浓HCl(稀到一定程度不反应)④ 制Cl2
也可用KMnO4和HCl
⑤ 制H2、H2S、糖类及酯的水解均要用稀H2SO4(否则,可发生其它反应,得不到相应产物或产率、纯度不高).
⑥ 用乙醇制乙烯、酯化反应、蒸糖脱水、乙醇的卤代、苯的硝化、磺化、纤维素的硝化均要用浓H2SO4.
(四)实验设计中有关顺序的选择
1.装置的排列顺序:按气流方向确定仪器的连接顺序.
一般遵循:气体的发生→除杂→干燥→主体实验→尾气处理.
2.接口连接顺序:导管的进出口方向及长短是连接的关键.
洗气装置
吸收气体装置
“长进短出” 水排气装置
一般的向上、向下排气集气装置
气排水装置
“短进长出”
反常的向上、向下排气集气装置
“大进小出”——通过干燥管的气流方向.
请注意气一固反应装置放置的方向不同,则气流方向有所不同.
除杂顺序:应遵循有序、互不干扰的原则.
3.操作顺序:
(1)气体发生:装置连接→气密性检查→装固体药品→加液体药品→其它操作.
(2)加热操作:
①在烧瓶或其它玻璃容器中,加入固体后不能先加热后加液体.原因:热的干的玻璃容器,遇到冷的液体,容器可能爆裂.
②凡用可燃性气体(如H2、PH3、C2H2、CH4等)与固体反应(需加热)时,应在加热前先通原料气驱赶尽装置中的空气,才能加热.若原料气本身有毒性或对环境有害的气体,应点燃尾气或改用其它无毒性气体驱赶,赶尽空气的目的是防止可燃性气体与空气混合受热爆炸.
例如:用H2、CO还原CuO,先通气体后试纯再加热,尾部用燃烧法除去多余H2、CO.
思考:制PH3(一种剧毒性气体易自燃)可用类似制NH3的方法反应为:
PH4I+NaOH PH3↑+NaI+H2 O实验开始时,先往气体发生装置中加入适量乙醚(沸点:34.5℃)并微热,其目的是什么?
提示:加热,乙醚易挥发,利用乙醚蒸气密度大,排尽装置中的空气,以防止PH3自燃或爆炸,影响实验结果及安全.
用反应气赶走空气的另一目的是保证产品的纯度.如用N2与Mg制Mg3N2.若有O2,则更易形成MgO.
④熄灭酒精灯时,一般遵循“先点后灭”的原则.目的是:
(ⅰ)防止产物再被空气氧化,使其在还原性气体中冷却.
(ⅱ)防止可能引起倒吸.
三、综合性实验的典型例析
例1.利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
(A) (B) (C)
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱
石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复
使用),请填写对应的序号:
① 、② 、③ 、④ 、⑤ 、⑥ 、⑦ .
(2)实验中使用了空气,其作用是 ;若通入空气的速度过
快或通入空气的量不足,则所测定Na2CO3的含量 (填“偏高”、“偏低”
或“准确”).
(3)干燥管Ⅱ的作用是 ,若缺乏干燥管Ⅱ,其后
果是 .
(4)若分液漏斗中④的滴液速度过快,将导致实验结果 (填“偏高”、“偏低”
和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量
分数的数学表达式为 .
解:
(1) g;f;d;b;a;e;e.
(2) 使反应产生的CO2气体充分排出,偏低.
(3) 防止空气中的CO2和H2O被吸入干燥管Ⅰ中,使测出的样品中Na2CO3的质量分
数偏大.
(4) 偏低.
(5) ×100%.
例2某小型化工厂生产皓矾(ZnSO4·7H2O),结晶前的酸性饱和溶液中含有少量的
Cu2+、Fe3+和Fe2+等杂质离子.为了除去杂质,获得纯净的皓矾晶体,该工厂设
计如下工艺流程:
滤液C 皓矾
滤液A 溶液B
沉淀C
酸性饱和溶液
滤液D
沉淀A
沉淀D
已知:开始生成氢氧化物沉淀到沉淀完全的pH值范围分别为:
Fe(OH)3:2.7~3.7; Fe(OH)2:7.6~9.6; Zn(OH)2:5.7~8.0
试回答下列有关问题:
(1)加入的试剂①应是 ,主要反应的离子方程式是:
.
(2)加入的试剂②,供选择使用的有:氯水、NaClO溶液、20%的H2O2、浓H2SO4、
浓HNO3等,应选用 ,其理由是 .
(3)加入试剂③的目的是 .
解:根据题意,可列出下列流程:
(1)加入过量的锌,Zn+2Fe3+=Zn2+ +2Fe2+ Zn+Cu2+=Zn2+ + Cu
(2) 20%的H2O2, H2O2具有强的氧化性,又不带入新的杂质
(3)加入ZnO促使Fe3+水解完全生成Fe(OH)3,增加Zn2+也不引入新杂质
例3. 在75℃左右,用HgSO4作催化剂,将乙炔通入含HgSO4的稀H2SO4溶液中,发生水化反应生成乙醛.但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S即是其中一种.现用含少量CaS杂质的电石、浓H2SO4、水、NaOH溶液、HgO粉末来制取乙醛.装置如下简图所示.
实验前应检查装置的气密性.实验开始时,打开夹子b,用活栓a控制x液体的流量,使A中反应放出的气流平稳、持续.当D中溶液褪色时,用b夹紧橡皮管,撤走D,使橡皮管与E中导管连接.然后点燃C处的酒精灯,同时打开夹b,使反应生成的乙醛蒸气通入E中.回答下列问题:
(1)实验前如何检查装置的气密性? .
(2)烧瓶中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括氧化汞在内的各试剂名称 .
(3)为了得到平稳的气流,液体x通常用 .
(4)B中盛放的试剂是 ,其作用是 ,发生反应的离子方程式 .
(5)为什么要等溴水褪色后才能给烧瓶加热? .
(6)为了使烧瓶受热均匀且控制较准的温度,还需用到 ,加热的方式为
.
(7)F装置的作用是 .
(8)检验E中含有乙醛的方法是 .
解析 (1)该装置较复杂,不能用手捂烧瓶的简单方法.检查该套装置气密性的方法是:
在A、B、D瓶中分别加入少量水,使水面刚浸没漏斗(或长玻导管)下端管口,打开a、b,对烧瓶稍加热,若A、B中导管内水面上升,且D中导管口有气泡逸出,表示装置不漏气.同理夹紧B、C间橡皮管,撤D,按E、F,可检查E、F是否漏气.
(2)HgO、H2O、浓H2SO4.注意:①一般应先加固体后加液体(防止固体粉末沾在潮湿的器壁上);②浓H2SO4稀释的操作顺序:在水中逐滴加入浓H2SO4.
(3)饱和食盐水
(4)NaOH溶液,吸收H2S.
H2S+2OH-=S2-+2H2O
(5)为把烧瓶中空气完全排出,避免乙炔与空气混合遇热发生爆炸.
(6)温度计,(因温度较明确),水浴.
(7)吸收尾气(多余的乙炔和未能冷却的乙醛蒸气),红色变浅,逐渐褪色.(因C2H2、CH3CHO均能与KMnO4溶液反应).
(8)取E中溶液少许,加入新制Cu(OH)2悬浊液,加热,若产生砖红色沉淀,则可证明含有乙醛.
例4 实验室里临时需要用NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体在通入NaOH溶液过程中极易过量生成NaHCO3,且无明显现象.
实验室有下列试剂:①未知浓度的NaOH溶液 ②37%的盐酸 ③37%的硫酸 ④14%的盐酸 ⑤大理石 ⑥ K2CO3固体 ⑦ Cu2(OH)2CO3.
实验室有下列仪器:铁架台、启普发生器、量筒、烧杯、橡皮管、玻璃导管、分液漏斗.
已知下表中各物质在常温时的溶解度(g/100g H2O)
Na2CO3 NaHCO3 NaCl Na2SO4 NaHSO4 NaOH
15.9 8.4 35 35.5 20 40
(1)本实验应选用的仪器:
除启普发生器、橡皮管、玻璃导管外,还需要 .
(2)为保证制得的Na2CO3溶液尽量纯,应选用的药品(填编号):
除①外,还需要:
(3)简要叙述实验步骤,直到制得纯Na2CO3溶液(仪器安装可省略).
(4)根据给出的溶解度表,求出当NaOH溶液中溶质的质量分数大于多少时,在配制过程中会有晶体析出?(写出计算步骤和必要的文字说明).
解析 这是一个设计性较强的实验题.从反应原理、试剂到仪器、步骤均要根据题意和已学知识一一分析,作出合理安排.
首先,考虑根据什么反应原理,制得纯净的Na2CO3溶液?
若在NaOH溶液中直接通入适量的CO2,使其只发生反应:CO2+NaOH=Na2CO3.
显然,“适量”两字是难以实际控制的,题干也明确指出此种方法的不足.
若在NaOH溶液中通入足量的CO2,使其生成NaHCO3溶液.再将其加热蒸干灼烧,使其分解为Na2CO3固体,最后溶于水.此方法步骤较多,操作复杂,且蒸干灼烧时也难以做到固体NaHCO3恰好完全分解,何况题中未给酒精灯.
合理的思路是:依据如下反应
CO2 + NaOH = NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
两反应中消耗的NaOH量相等.这是关键,因而必须取两等份的NaOH同种溶液,使其中一份完全转化为NaHCO3,然而再加入另一份NaOH溶液,又使NaHCO3刚好转化为Na2CO3.
其次,考虑怎样选择的合适的试剂和仪器?
欲制CO2,选用哪一种碳酸盐和哪一种酸?
因要用启普发生器,K2CO3固体可溶于水,不能选用.Cu2(OH)2CO3、大理石均为不溶于水的固体.但CaCO3、Cu2(OH)2CO3分别与HCl的反应产生等量的CO2,后者将消耗更多的HCl.故应选用CaCO3.
由于CaCO3和H2SO4反应生成CaSO4微溶物,覆盖在CaCO3固体表面,使反应速率降低.故应选择盐酸.但现有两种不同的盐酸,该选择浓的还是稀的?由于浓盐酸具有挥发性,使CO2中混有HCl,从而与NaOH反应将有NaCl生成,最终无法制得纯净的Na2CO3溶液.故应用稀HCl.
本题答案:
(1)烧杯、量筒(用于量取等体积的两份NaOH溶液).
(2)④、⑤
(3)①量取一定量的NaOH溶液,分成两等份.
②用稀HCl和CaCO 3反应制取CO2(启普发生器进行),向①其中一份NaOH溶液通入过量的CO2气体.
③将两份溶液混合、摇匀.
④从表中可知,NaHCO3常温下的溶解度为8.4g.
设常温下100g水中溶解的NaOH质量为x g时,NaHCO3达饱和
NaOH + CO2 = NaHCO3
40 84
x 8.4
x=4(g)
×100%=3.85%.
故溶液中NaOH的质量分数若大于3.85%,则在步骤②中会有NaHCO3晶体析出.
四、巩固练习
1.用以下三种途径来制取相等质量的硝酸铜:
(1)铜跟浓硝酸反应
(2)铜跟稀硝酸反应
(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应
以下叙述正确的是 _________ A.三种途径所消耗的铜的物质的量相等
B.三种途径所消耗的消酸的物质的量相等
C.所消耗的铜的物质的量是: 途径(3)>途径(1)>途径(2)
D.所消耗的硝酸的物质的量是: 途径(1)>途径(2)>途径(3)
2.已知某无色的混合气体,可能由NH3、HCl、O2、CH3Cl中一种或多种组成.通过如图装置后,洗瓶内有白色沉淀生成.请判断:
(1)原混合物中肯定有_______
原因__________________________(用化学方程表示)
(2)混合物中肯定没有_______
原因__________________________(用文字叙述)
3.现有右图所示装置,为实现下列实验目的,其中y端适合于作入口的是
(A)瓶内盛液体干燥剂,用以干燥气体
(B)瓶内盛液体洗涤剂,用以除去某气体中的杂质
(C)瓶内盛水,用以测量某难溶于水的气体的体积
(D)瓶内贮存气体,加水时气体可被排出
(E)收集密度比空气大的气体
(F)收集密度比空气小的气体
4.某无色混合气体,可能含有CO、CO2、NH3、H2、HCl和H2O(g)中的一种或几种,当混
合气体依次通过石灰水、Ba(OH)2溶液、浓H2SO4、灼热的CuO粉末和无水CuSO4时,
现象依次为澄清石灰水未见浑浊,Ba(OH)2溶液变浑浊,灼热的CuO变红,无水CuSO4
变蓝.由此可知原混合气体中一定含有_____________________.
1.TiCl4是工业上制取聚乙烯的催化剂,它是一种无色液体,沸点136.4℃,在潮湿的
空气中极易水解.工业上制取TiCl4在炭粉存在条件下,将TiO2进行高温氯化.现
利用下图中所给仪器(本题未画出CO2的发生装置)在实验室里制取TiCl4,主要
步骤有:
①连接好装置,在通Cl2前先通入CO2,并持续一段时间.
②锥形瓶中的TiCl4的量不再增加时停止加热,改通CO2,直到瓷管冷却.
③将TiO2、炭粉末混合均匀后,装入管式炉的瓷管中.
④将电炉升温到800℃,改通Cl2,同时在冷凝管中通入冷凝水.
一 二 三 四 五
装置图
管式电炉炭粉和TiO2
(1)正确的操作程序是(填写操作步骤的序号) .
(2)装置(2)中,分液漏斗中的液体是 ,烧瓶中的粉末是 .
(3)操作步骤①的目的是 .
(4)当气体从左向右流向时,图中仪器装置连接顺序是(填仪器序号) .
(5)装置(1)上端的干燥管的作用是 .
(6)上述制取TiCl4的化学方程式 .
5.过碳酸钠(Na2CO4)和HCl反应的化学方程式为:
2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
商品过碳酸钠中往往含有少量的碳酸钠,为了测定其纯度,现称取0.9克样品进
行实验.供实验选用的仪器、试剂如下:
E F
无水CuSO4
① ② ③ ④
G H J K L M
水
5% 饱和
NaOH Ca(OH)2
⑤ ⑥ ⑦ ⑧ ⑨
(1)为了使实验尽可能简单,应选用的装置是 (填编号).
(2)所选用的装置的连接顺序是 (填字母,胶管已略去).
(3)为了能通过实验和计算,求得样品的纯度.所需测定的物质名称和物理量
是 ,若所测定的物质的物理量以质量表示,且为m克,则样品的纯度为
.
(4)实验室有50mL、100mL、500mL三种规格的量筒,实验时选用的量筒的规格为
.
6.已知NH3和CuO反应可得较纯净的铜、氮气和水.现利用氨的还原性来测定氨分子
中各元素的质量分数,同时测定氨氧化的百分含量[在反应中生成的气体用排气法
测出其体积(假设水的体积为标准状况下气体的体积)].
f
d e
碱石灰
A B C D
h i k j l
水
浓 H2SO4
E F G
(1)用上述装置连接成整套实验装置(填写各接口代号与字母):
a接( )( )接( )( )接( )( )接( )( )
( )( )接( )
(2)整套装置安装完毕后,检验气密性的方法是 .
(3)仪器连接好后进行实验时,先点燃 处酒精灯,实验结束时应撤去熄灭
处酒精灯,且应 再熄灭 处的酒精灯,其理由是 .
(4)装置(B)的作用是 .
装置(C)的作用是 .
装置(E)的作用是 .
7.某种碱式碳酸铜是孔雀绿色固体粉末,其组成可表示为:Cu2(OH)2CO3·xH2O在加热
条件下,它在失去结晶水的同时发生分解,反应方程式为:
Cu2(OH)2CO3·xH2O 2CuO+CO2↑+(x+1)H2O
现取一定量的固体样品,不准确称量其质量,用两套仪器装置,先后进行两个实验:
实验(Ⅰ):测定该碱式碳酸铜粉末组成中x的值;
实验(Ⅱ):用实验(Ⅰ)结束后的残留固体与乙醇蒸气反应,并检验反应产物.
试回答下列问题:
(1) 现已装配好上面一套仪器装置(装置中必要的铁架台、铁夹、铁圈、酒精灯、石
棉网在图中已略去),套这装置是用来完成上述实验 的(填标号).
(2)用下面的仪器(必要的铁架台、铁夹、酒精灯均在图中略去)组装完成另一个实
验装置.组装时仪器按气流方向从左到右的连接顺序是: → → →
.在这套实验装置中,干燥管H的作用是: .
F
碱石灰 浓
硫
酸
E H G
(3)实验开始时,碱式碳酸铜放在仪器(填仪器对应字母) 中,乙醇放在仪
(填仪器对应字母) 中.
(4)这两套装置中,在实验时需要加热的仪器是(填对应字母) .
(5)实验结束后可见试管D内壁有银白色金属析出.实验中试管A内发生的反应的化
学方程式是: 从试管A通入试管D的导管中气体的成份是(写
名称、其中水蒸气不必填) .
(6)这两套装置中,在实验前后均要连同所盛试剂一起准确称量的仪器是(填对应字
母) ,若用托盘天平称量,其中某次称量记录的数据是51.12g,这样记录
是否合理 (填“合理”或“不合理”).
8.氨与灼热的氧化铜反应生成氮气、铜和化合物X,据此,在27℃和1.01×105Pa时,
将一定质量的氨与氧化铜充分反应,测定反应后生成的氮气的体积及X的质量可
推算出氨分子的组成.试从①浓氨水、②氧化铜、③熟石灰、④硝酸铵晶体、⑤
生石灰、⑥浓硫酸、⑦碱石灰、⑧五氧化磷、⑨水等九种试剂及下图所示的A-H
八种仪器中选出适当试剂和仪器(可重复使用)完成氮分子组成的测定实验.
a b d
e
c
A B C D E
h i
f
F G H
请回答以下有关问题:
(1)实验过程中至少要用到 等试剂(填序号,下同).
(2)应用仪器 组成氨气发生装置;用仪器 作为氨气氧化装置;用仪器
组成测定生成的氮气体积的装置.
(3)氨气发生装置后应连接仪器 ,其任务是 .氨气氧化装置后应连接
仪器 ,其任务是 .
(4)在实际测定过程中,除乳胶管外,不可缺少的仪器还有 ;在实验仪
器装配程序中,仪器G中的导管口i应与导管口 相连接.
(5)实验测得气体积为V L;测得化合物X的装置实验前后的质量分别为W1 g和W2 g,
则氨分子的组成,即氨分子中氮和氢原子个数比为 .
参 考 答 案
1.A、D
2.(A)(B)(D)(E)
3.(1)一定有HCl,因为CH3Cl不溶于水且不与水反应,不可能产生AgCl沉淀
(2)一定无NH3,因为HCl 与NH3不共存
4.(1) ③①④②.
(2) 浓盐酸、MnO2.
(3) 用CO2排尽装置中空气,防止TiCl4水解.
(4) 2、4、5、1、3.
(5) 防止水蒸气进入装置①,避免TiCl4水解.
(6) TiO 2+C+2Cl2 TiCl4+CO2
5.(1) ①②⑧③⑥.
(2) A-B-C-K-J-D.
(3) 氧气的体积,×100%.
(4) 100mL.
6.(1) bcfgdehijkl(其是f与g、d与e可交换).
(2) 点燃酒精灯A微热,若E中有气泡逸出,F中K导管水面上升,证明不漏气.
(3) A、D,冷却至室温,A,防止E中液体倒吸入C中.
(4) 吸收NH4HCO3反应生成的CO2和H2O,以得到纯净的NH3;吸收CuO反应后的水
蒸气;吸收CuO反应后剩余的NH3.
7.(1) Ⅱ.
(2) FGEH;吸收空气中的水蒸气和CO2.
(3) F、C.
(4) A、B、C、F.
(5) C2H5OH + CuO CH3CHO + H2O + CuO 乙醛、乙醇
(6) E、G;不合理.
8.(1) ①②⑤⑨或①②⑦⑨.
(2) C、E;A;D、F、G.
(3) B;干燥氨气;B;吸收生成的水.
(4) 托盘天平、铁架台(带铁夹);f.
(5) :.
△
△
△
⑦
⑥
④
①
→
干燥管Ⅰ 干燥管Ⅱ
③
②
⑤
结晶
加过量①
过滤
加②
加③
过滤
分离
加④
过滤
合并
Fe3+
Zn2+
Cu2+
Fe2+
Zn2+
Fe2+
H2O2
Zn2+
Fe3+
ZnO
ZnSO4
Fe(OH)3
皓矾
ZnSO4
FeSO4
Cu
H2SO4
Cu
Zn
(Fe)
Zn
B C
A
碱石灰
g
CuO
硅胶
△
碱石灰
j k
800℃
△
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
