高三复习专题讲座-元素及其化合物(1)
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
高三复习专题讲座
——氮及其化合物
1、 本讲教学进度及主要内容
第三部分 元素及其化合物
第3章 氮族元素
主要内容:
1.掌握N元素的知识网络结构
2.掌握单质磷、N2、NH3、NH4+、HNO3等重要物质的性质或检验
3.掌握主要铵盐的分解规律、硝酸的反应规律
二、学习指导
(1) 含氮物质间相互转化
NH4Cl NH3 N2 NO NO2 HNO3
NH4+ +OH— NH3·H2O Mg3N2 N2O4 NaNO3
注意:在上面转化中有3个典型的可逆反应
(1)NH3溶于水存在着下列平衡:
NH3+H2O NH3·H2O NH4++OH—
由此可分析氨水的成分。
分子:NH3、NH3·H2O、H2O
氨水
离子:NH4+、OH—、H+(极少量)
比一比:①氨水和氯水中所含的微粒种类谁多?
②铵盐与碱溶液的反应与之有何不同?
提示:②NH4+与OH—在溶液中不能大量共存,所发生的反应程度较大,一般用“===”表示,但要注意反应条件是否加热影响产物的形式。
NH4++OH—====NH3·H2O (常温)
NH4++OH— NH3↑+H2O (加热)
(2)用N2和H2合成氨反应是典型可逆反应
N2+3H2 NH3
而NH3转变成N2未必一定要通过此可逆反应,可通过其它反应获得,如
①2NH3+3O2 2N2+6H2O
②2NH3+3CuO Cu+N2+3H2O
利用反应②测定水的质量和产生N2的体积(换算成物质的量)可测定氨气的组成
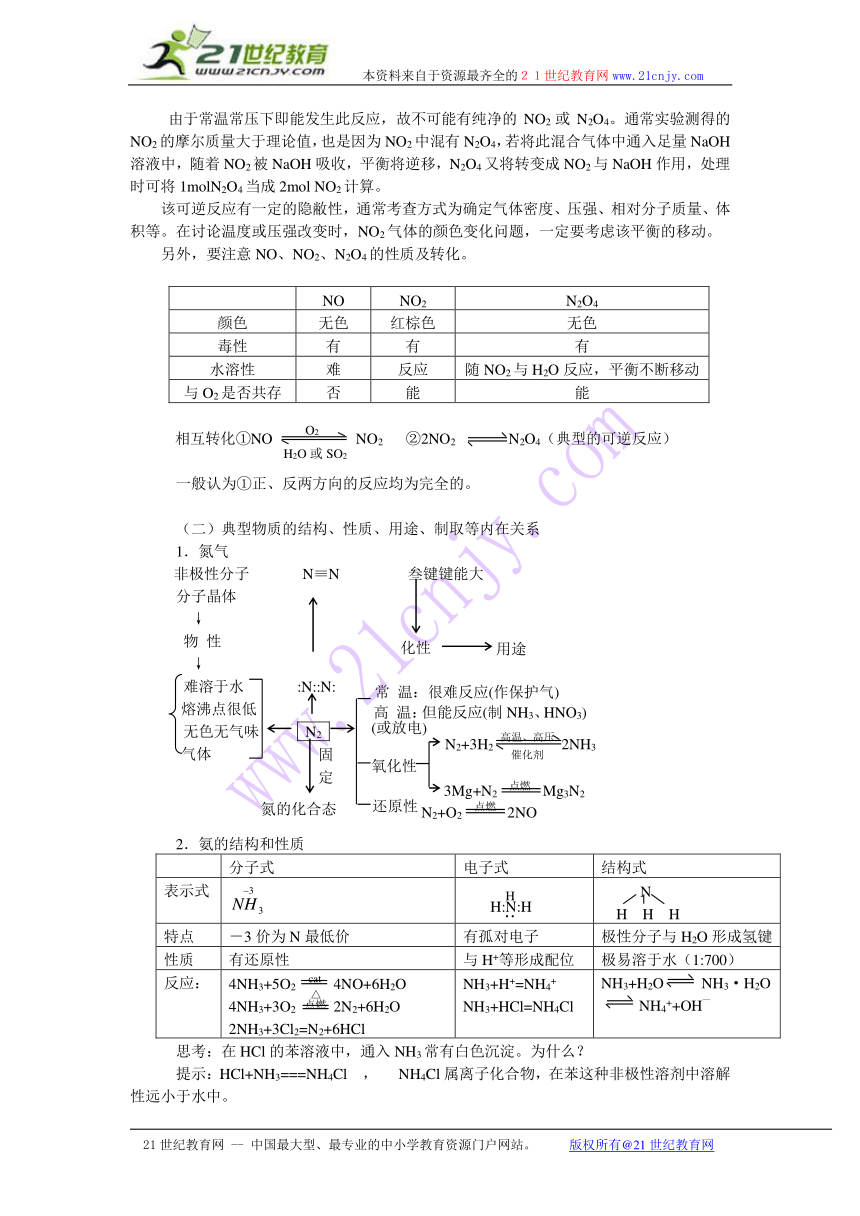
(3)NO2与N2O4的转化:
2NO2 N2O4
由于常温常压下即能发生此反应,故不可能有纯净的NO2或N2O4。通常实验测得的NO2的摩尔质量大于理论值,也是因为NO2中混有N2O4,若将此混合气体中通入足量NaOH溶液中,随着NO2被NaOH吸收,平衡将逆移,N2O4又将转变成NO2与NaOH作用,处理时可将1molN2O4当成2mol NO2计算。
该可逆反应有一定的隐敝性,通常考查方式为确定气体密度、压强、相对分子质量、体积等。在讨论温度或压强改变时,NO2气体的颜色变化问题,一定要考虑该平衡的移动。
另外,要注意NO、NO2、N2O4的性质及转化。
NO NO2 N2O4
颜色 无色 红棕色 无色
毒性 有 有 有
水溶性 难 反应 随NO2与H2O反应,平衡不断移动
与O2是否共存 否 能 能
相互转化①NO NO2 ②2NO2 N2O4(典型的可逆反应)
一般认为①正、反两方向的反应均为完全的。
(二)典型物质的结构、性质、用途、制取等内在关系
1.氮气
非极性分子 N≡N 叁键键能大
分子晶体
↓
物 性
↓
难溶于水 :N::N:
熔沸点很低
无色无气味 N2
气体
2.氨的结构和性质
分子式 电子式 结构式
表示式 NH H H
特点 -3价为N最低价 有孤对电子 极性分子与H2O形成氢键
性质 有还原性 与H+等形成配位 极易溶于水(1:700)
反应: 4NH3+5O2 4NO+6H2O4NH3+3O2 2N2+6H2O2NH3+3Cl2=N2+6HCl NH3+H+=NH4+NH3+HCl=NH 4Cl NH3+H2O NH3·H2O NH4++OH—
思考:在HCl的苯溶液中,通入NH3常有白色沉淀。为什么?
提示:HCl+NH3===NH4Cl , NH4Cl属离子化合物,在苯这种非极性溶剂中溶解性远小于水中。
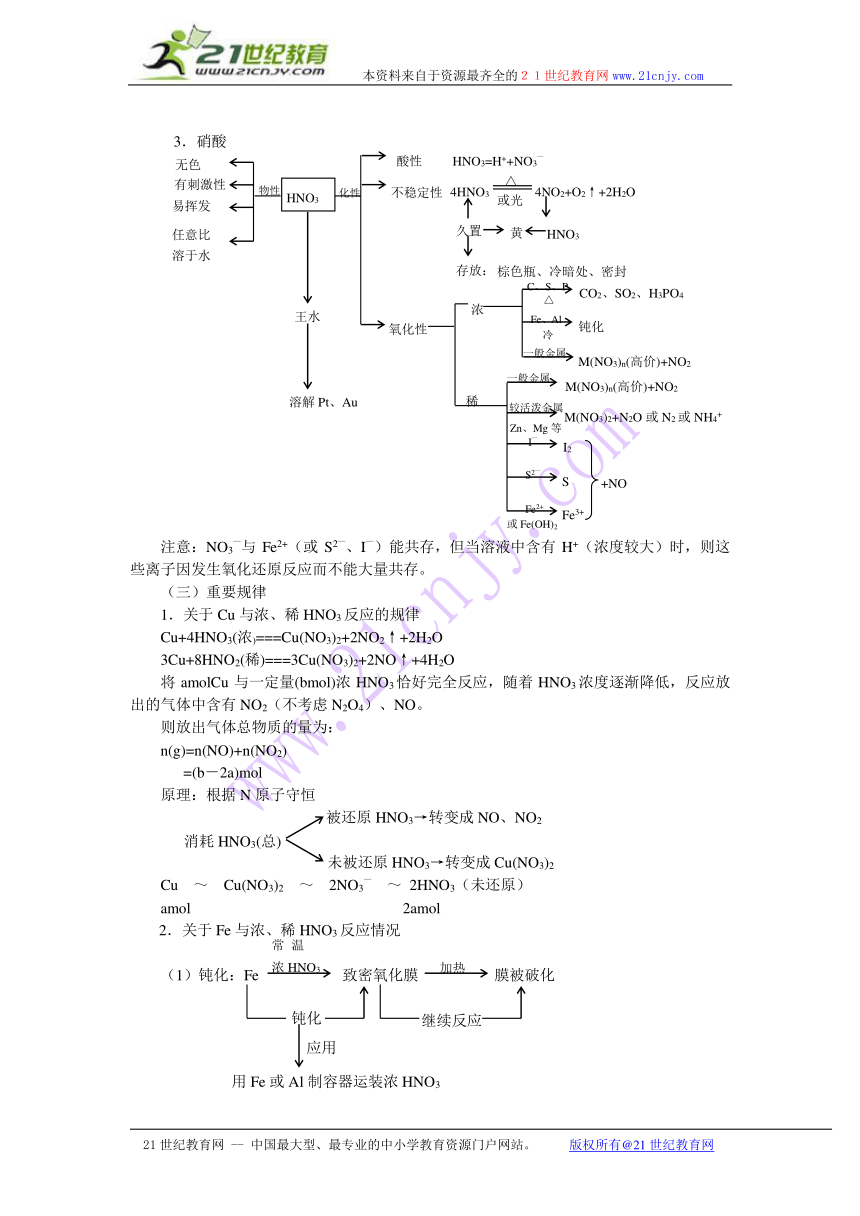
3.硝酸
注意:NO3—与Fe2+(或S2—、I—)能共存,但当溶液中含有H+(浓度较大)时,则这些离子因发生氧化还原反应而不能大量共存。
(三)重要规律
1.关于Cu与浓、稀HNO3反应的规律
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO2(稀)===3Cu(NO3)2+2NO↑+4H2O
将amolCu与一定量(bmol)浓HNO3恰好完全反应,随着HNO3浓度逐渐降低,反应放出的气体中含有NO2(不考虑N2O4)、NO。
则放出气体总物质的量为:
n(g)=n(NO)+n(NO2)
=(b-2a)mol
原理:根据N原子守恒
被还原HNO3→转变成NO、NO2
未被还原HNO3→转变成Cu(NO3)2
Cu ~ Cu(NO3)2 ~ 2NO3— ~ 2HNO3(未还原)
amol 2amol
2.关于Fe与浓、稀HNO3反应情况
(1)钝化:Fe 致密氧化膜 膜被破化
思考:下述“敲铁成铜”的原因是什么?
钝化铁片 无现象 红色Cu析出
(2)Fe Fe3+
若HNO3不足量,不论浓、稀,则生成Fe2+,不能误认为Fe遇浓HNO3反应生成Fe3+,而与稀HNO3反应生成Fe2+。其实不论浓、稀HNO3,它们均能将Fe氧化成Fe3+,若Fe过量 ,则又将Fe3+还原为Fe2+。即由Fe与HNO3的物质的量相对多少来决定生成Fe3+还是Fe2+。
(3)若amolFe投入到含bmolHNO3的稀硝酸中恰好反应,假设生成的还原产物均为NO,求所得气体的物质的量。
可能发生的化学反应有2个。
①3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O
②Fe+4HNO3===Fe(NO3)3+NO↑+2H2O
是否有必要讨论随着值不用,反应发生的情况?结论是不必。
分析上述2个反应,不难发现有共同特征
4HNO3(反应) ~ NO
4mol 1mol
bmol mol
即反应所得气体是HNO3总消耗量的1/4。
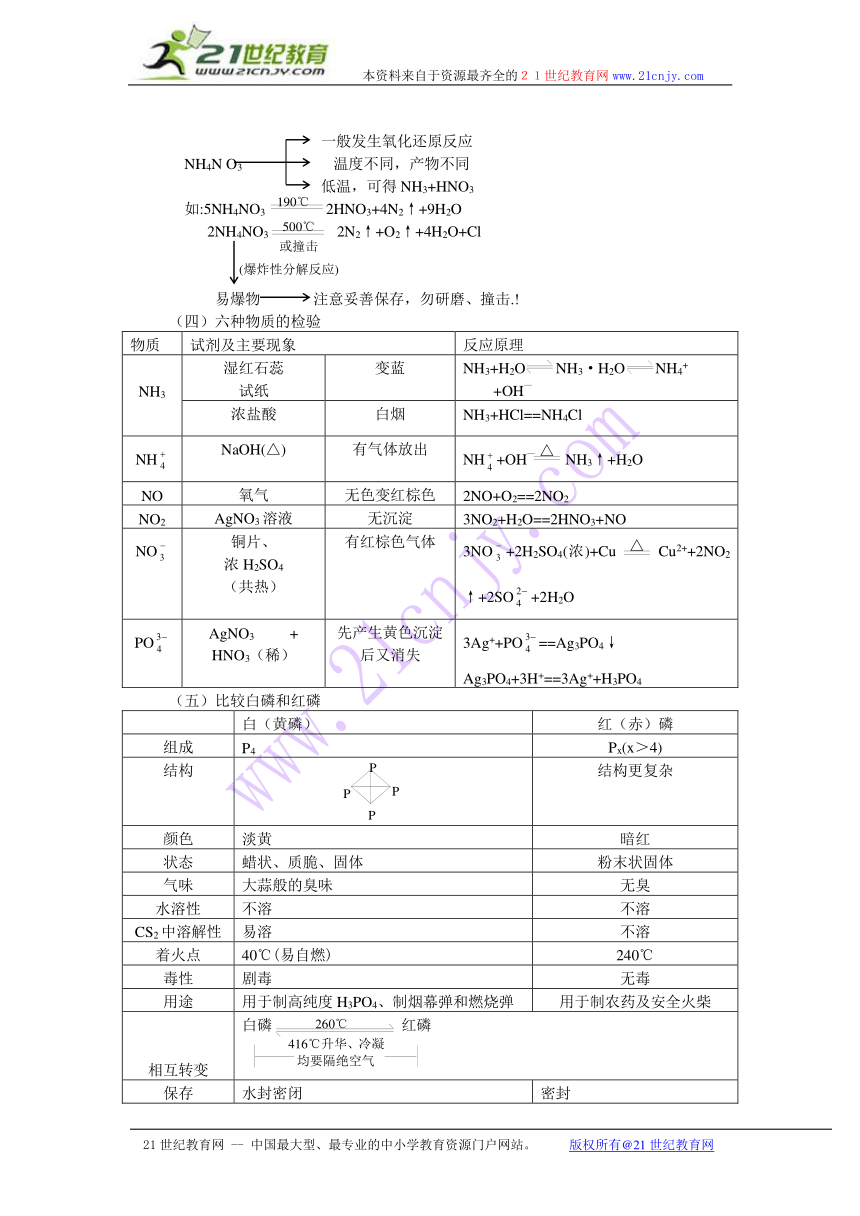
3.关于铵盐的分解规律
共性:铵盐不稳定,加热易分解
区别:①对应酸的稳定性、挥发性、氧化性不同,可影响产物的种类
②某些铵盐受热温度不同,产物可能不同。
常见的可分为以下几类:
(1)稳定且易挥发酸成的铵盐 NH3↑+酸的挥发物
如 NH4Cl NH3↑+HCl↑
NH4Cl
思考:①能用NH4Cl分解制NH3吗?
②NH4X与NH4Cl都类同吗?
③NaCl固体中含NH4Cl如何用简便方法除去?
提示:②NH4I受热时会有紫红色气体产生,是由于HI不稳定受热也分解。
(2)稳定难挥发酸成的铵盐 NH3↑+酸
如(NH4)SO4 2NH3↑+H2SO4
(3)不稳定且无强氧化性酸成的铵 NH3↑+酸的分解产物
如(NH4)2CO3 2NH3↑+H2O+CO2↑
NH4HCO3 NH3↑+H2O+CO2↑
NH4I NH3↑+I2↑+H2↑
(有色)
(4)由不稳定且有强氧化性酸(HNO3)成的盐
一般发生氧化还原反应
NH4N O3 温度不同,产物不同
低温,可得NH3+HNO3
如:5NH4NO3 2HNO3+4N2↑+9H2O
2NH4NO3 2N2↑+O2↑+4H2O+Cl
易爆物 注意妥善保存,勿研磨、撞击.!
(四)六种物质的检验
物质 试剂及主要现象 反应原理
NH3 湿红石蕊试纸 变蓝 NH3+H2O NH3·H2O NH4+ +OH—
浓盐酸 白烟 NH3+HCl==NH4Cl
NH NaOH(△) 有气体放出 NH+OH— NH3↑+H2O
NO 氧气 无色变红棕色 2NO+O2==2NO2
NO2 AgNO3溶液 无沉淀 3NO2+H2O==2HNO 3+NO
NO 铜片、浓H2SO4(共热) 有红棕色气体 3NO+2H2SO4(浓)+Cu Cu2++2NO2↑+2SO+2H2O
PO AgNO3 +HNO3(稀) 先产生黄色沉淀后又消失 3Ag++PO==Ag3PO4↓Ag3PO4+3H+==3Ag++H3PO4
(五)比较白磷和红磷
白(黄磷) 红(赤)磷
组成 P4 Px(x>4)
结构 结构更复杂
颜色 淡黄 暗红
状态 蜡状、质脆、固体 粉末状固体
气味 大蒜般的臭味 无臭
水溶性 不溶 不溶
CS2中溶解性 易溶 不溶
着火点 40℃(易自燃) 240℃
毒性 剧毒 无毒
用途 用于制高纯度H3PO4、制烟幕弹和燃烧弹 用于制农药及安全火柴
相互转变 白磷 红磷
保存 水封密闭 密封
(六)比较重要物质的制法(反应原理)
物质 实验室制法 工业制法
NH3 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O N2+3H2 2NH3
NO 3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O 4NH3+5O2 4NO+6H2
NO2 Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 2NO+O2==2NO2
HNO3 NaNO3+H2SO4(浓) NaHSO4+HNO3↑ NH3→NO→NO2→HNO3
注意
1.NH3的干燥剂选用
①氨是碱性气体(有水),故不能用酸性干燥剂,如浓H2SO4、P2O5等
②氨与CaCl2反应生成CaCl2·8NH3,故也不能用无水CaCl2
③氨只能用碱性干燥剂如碱石灰
三、典型例析
例1.1.92gCu投入到一定量浓HNO3中,铜完全溶解,生成的气休颜色由深变成浅(不考虑2NO2 N2O4),共收集到672mL气体(标况),通入一定体积的O2恰好使气体完全溶于水,求通入O2的体积(标况)。
解析:该题若按常规方法做还相当复杂,我们可换一种视角去观察,不追究具体过程,只关注起始和终了的状态。
HNO3 NO2、NO
O 2
HNO3总结果消耗,根据电子守恒得
Cu失电子数==O2得电子数
×2=×4
v=336(mL)
答:应通入O2336 mL
例2.加热硝酸铜结晶水合物和硝酸银的混和物1102克,使之完全分解,得到固体残渣48.4克。将反应产生的气体通过水充分吸收后,剩余气体为1.68升(S.T.P),求原混合物中硝酸铜结晶水合物的分子式。
已知:Cu(NO3)2和AgNO3受热分解的反应式为:
2Cu(NO3)2 2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
解析:4NO2+O2+2H2O==4HNO3
而Cu(NO3)2分解产生的NO2和O2的体积比为4 :1,被水完全吸收。AgNO3分解出的气体经与水反应后剩余1.68升。
设原混和物中Cu(NO3)2含x摩,AgNO3含y摩.则:
80·x+108·y=48.4
y·=
解之得x=0.2(摩)=0.3(摩)
设硝酸铜晶体为Cu(NO3)2·xH2O
Cu(NO3)2·xH2O ~ Cu(NO3)2
188+18x 1
110.2-0.3×170 0.2
=
答:硝酸铜晶体的分子式为Cu(NO3)2·6H2O
例3.下图表示的反应关系中,部分产物被略去,已知X为1mol固体,A、B、C各是1mol无色气体,B在常温下为液态,D、E、F为气态,G为液态,试推断各物质的化学式:
X________,A________,B________,C________,D________,E________,F________,G________,
解析:由于X既能与HCl又能与NaOH反应产生气体,且加热到200℃即可分解,说明X应为弱酸的铵盐,对应是何种弱酸?是酸式盐还是正盐?这需要进一步分析。
由于A(g)与Na2O2反应且有气体D生成,故可推得A应为CO2而不是SO2,否则由于发生反应:
SO2+Na2O2===Na2SO4
而无气体生成。
另外1molx固体,生成A、B、C各为1mol,说明它为NH4HCO3而不是(NH4)2CO3。
NH4HCO3 NH3↑+CO2↑+H2O
(NH4)2CO3 2NH3↑+CO2↑+H2O
再综合整个框图信息可知:
X—NH4HCO3,A—CO2, B—H2O,C—NH3 , D—O2,E—NO,F—NO2,G—HNO3
巩 固 练 习
(一)选择题
1.常温时能溶于浓HNO3的单质是( )
A.Al B.Fe C.Cu D.C
2.下列反应中HNO3既表现出酸性,又表现出强氧化性的是( )
A.Fe2O3+HNO3 B.Ca(OH)2+HNO3
C.C+HNO3 D.FeO+HNO3
3.下列制取物质的方法合适的是( )
A.硝酸和FeS反应制H2S B.硝酸和Cu(OH) 2反应制Cu(NO3)2
C.硝酸和Na2SO4反应制H2SO4 D.硝酸和KF反应制F2
4.下列对硝酸的认识不正确的是( )
A.打开浓硝酸的瓶盖会产生棕色的烟
B.锌跟稀硝酸的反应是置换反应
C.常用硝酸来制作炸药、化肥
D.稀硝酸也是一种强氧化性酸
5.氢化铵(NH4H)与NH4Cl结构相似,NH4H和水反应有H2生成,下列叙述不正确的是( )
A.NH4H溶于水时,NH4H是氧化剂 B.NH4H溶于水后所形成的溶液显酸性
C.NH4H为离子化合物 D.NH4H固体溶于水有两种气体生成
6.下列分子或离子的结构属于正四面体的是( )
A.氨分子 B.铵根离子 C.白磷分子 D.红磷
7.从液态空气中分离出来的稀有气体,常含有少量氮气和氧气,为了除去氮气和氧气,可把气体通过( )。
A.灼热的镁条 B.灼热的铜丝
C.浓H2ASO4 D.一氧化氮
8.下列过程属于人工固氮的是( )
A.分离液态空气制氮气 B.闪电时N2转化为NO
C.合成氨 D.豆科作物根瘤菌将N2转化为化合态氮
9.下列用途中,应用了氮气不活泼性质的是( )。
A.金属焊接时保护气,和氩气混合充填灯泡 B.用于合成氨气
C.工业上以氮气为原料之一制硝酸 D.保护粮食和水果
10.38.4mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4mL(标准状况下),反应消耗的HNO3的物质的量可能是( )
A.1.0×10—3mol B.1.6×10—3mol C.2.2×10—3mol D.2.4×10—3mol
11.相同湿度和压强的条件下,在体积相同的三个烧瓶中分别盛有NH3、HCl、NO2气体,并分别倒立在水槽里,充分溶解后,烧瓶内三种溶液的物质的量浓度之比为(设烧瓶中溶液未扩散到水槽里)(面 )
A.1 :1 :1 B.2 :2 :3 C.3:3 :2 D.2 :2 :1
12.下列各组气体①NO2+NO、②NO2+O2、③NH3+N2、④NO+N2等体积混合,分别通入体积相同的试管并立即倒立在足量的水中,试管内水面上升的高度分别为h1、h2、h3、h4。下列高度关系判断正确的是( )
A.h2>h3>h1>h4 B.h3>h2>h1>h4 C.h1=h2=h3=h4 D.h1>h2>h3>h4
13.下列各组中的两种物质,能直接相互转变的是( )
A.NH3、NO B.O2、F2 C.NO、NO2 D.H2S、SO2
14.铜与1mol/L的硝酸反应,如果NO浓度下降0.2mol/L,则溶液中[H+]同时下降( )
A.0.2mol/L B.0.4mol/L C.0.6mol/L D.0.8mol/L
15.25.6mgCu与含有1.4×10—3molHNO3的浓硝酸恰好完全反应,反应完全后收集到的气体在标准状况下的体积为( )
A.7.84mL B.13.44mL C.15.68mL D.17.92mL
16.常温下,将等物质的量铜片、铁片、铝片和银片分别置于四个小烧杯中,然后各加入足量的浓硝酸,放出NO2气体的体积最多的是( )
A.铜片 B.铁片 C.铝片 D.银片
17.甲、乙、丙、丁在常温下为四种气体,它们都是大气污染物。已知:甲的水溶液是一种无氧酸;乙是形成酸雨的主要物质;丙可与甲发生氧化还原反应;丁能与血红蛋白作用而使人体中毒,则甲、乙、丙、丁依次可能为( )
A.HBr、SO2、Cl2、CO B.H2S、SO3、Cl2、NO
C.H2S、SO2、Cl2、NO D.HCl、NO2、Cl2、NO
(二)填空
18.有下列6种物质:①钠 ②白磷 ③苛性钠溶液 ④硝酸银溶液 ⑤浓硝酸 ⑥浓氨水。其中应保存在棕色瓶中的是___________,应保存在煤油中的是___________,应保存在水中的是__________,应保存在胶塞的试剂瓶中的是__________。
19. 下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已删去)。
A B C D E
回答下列问题:
(1)A是__________,Y是__________,Z是_____________。
(2)当X是强酸时,A、B、C、D、E均含有同一种元素,E是_______________。
(3)当X是强碱时,A、B、C、D、E均含有同一种元素,E是_______________。
(4)写出X在两种情况下,B→C的化学方程式_____________________________,
________________________________。
(5)当X是强碱时,写出E的稀溶液与铜片发生反应的离子方程式:________________。
20.用下图装置制取和收集气体。根据装置分析后填下表(可不填满):
编号 A中的固体物质 B中的溶液 C中的气体
(1)
(2)
(3)
21.向一试管中用排空气法充入一定量气体后进
行如右图的实验:
(1)向度管中充入的气体是_________(填化学
式),理由是__________,滴入的指示剂是___
____________。
22.现有下列实验过程
(1)W的化学式是_____________________。
(2)应用上述途径制取Y气体,选择下列合适的发生装置___________(填标号)
(3)若用右上图装置收集气体X和Y,则进气管口合理的应是(填管口字母,下同)_______ ;若是收集气体Z,则进气管口合理的应是_________。
(4)用(3)中的装置以及量筒、导管和水等来粗略测定Y气体的体积,则进气管口合理的应是______________。若Y气体中混有少量的X气体,则对Y体积的测量结果有无影响?并说明理由______________________________________。
(5)若实验室制取气体X不用题(2)中所选的发生装置,请选出其它方法所用试剂(只举一例):__________________________________________。
(三)计算
23.取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470g。冷却后加入足量水,将反应产物加热蒸干并灼烧,得到的氧化镁质量为0.486g。
(1)写出氮化镁与水发生水解反应的方程式
(2)计算燃烧所得混合物中氮化镁的质量分数。
参 考 答 案
(一)1.C 2.D 3.B 4.A、B 5.A、B 6.B、C 7.A 8.C 9.AD
10.C 11.A 12.A 13.C 14.D 15.B 16.A 17.A、C
(二)18.④⑤,①,②,③
19.(1)(NH4)2S,O2,H2O
(2)H2SO4 (3)HNO3
(4)2H2S+O2 S+2H2O
4NH3+5O2 4NO+6H2O
(5)3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O
20.(1)Na2SO3固体、较浓H2SO4,SO2 (2)Cu ,浓HNO3, NO2
(3)KMnO4固体,浓HCl,Cl2
21.(1)NH3,)< ,酚酞
22.(1)CH3COONH4,(2)A (3)a,b (4)a,无影响,因 NH3极易溶于水
(5)浓氨水和固体NaOH
(三)23.(1)Mg3N2+6H2O==3Mg(OH)2↓+NH3↑
(2)设混合物中Mg3N2的质量分数为x
Mg3N2 ~ 3MgO ~△m
100g 120g 20g
0.470g·x (0.486-0.470)g
= x=0.17
答:Mg3N2的质量分数为17%
①浓酸、Cu
△
Ca(OH) 2△
HCl
H2、高温、高压
催化剂
O2
放电
O2
H2O
H2O
②见光或△
③浓酸、C
NaOH
参
与
有
机反 应
△H2SO4
Mg
点
燃
H2O
H2O
硝基苯
三硝基甲苯
硝酸乙酯
硝化甘油
硝化纤维
O2、催化剂、△
稀酸、Cu
△
高温高压
催化剂
点燃
△
O2
H2O或SO2
化性
用途
常 温:很难反应(作保护气)
高 温:但能反应(制NH3、HNO3)
(或放电)
氧化性
N2+3H2 2NH3
高温、高压
催化剂
3Mg+N2 Mg3N2
点燃
N2+O2 2NO
点燃
还原性
固
定
氮的化合态
H:N:H
H
‥
cat
△
点燃
无色
有刺激性
易挥发
任意比
溶于水
酸性
不稳定性
HNO3=H++NO3—
4HNO3 4NO2+O2↑+2H2O
△
或光
久置
黄
HNO3
存放:
棕色瓶、冷暗处、密封
氧化性
浓
CO2、SO2、H3PO4
C、S、P
△
Fe、Al
冷
一般金属
钝化
M(NO3)n(高价)+NO2
M(NO3)n(高价)+NO2
M(NO3)2+N2O或N2或NH4+
一般金属
较活泼金属
Zn、Mg等
I2
I—
S2—
Fe2+
或Fe(OH)2
S
Fe3+
+NO
王水
溶解Pt、Au
HNO3
物性
化性
稀
消耗HNO3(总)
常 温
浓HNO3
加热
钝化
继续反应
应用
用Fe或Al制容器运装浓HNO3
CuSO4溶液
敲击铁片
浓HNO3(足量)
或稀HNO3(足量)
△
△
冷
△
△
===
△
△
△
△
190℃
500℃
或撞击
(爆炸性分解反应)
△
△
P
P
P
P
260℃
416℃升华、冷凝
均要隔绝空气
△
高温高压
催化剂
△
微热
Cu
△
△
△
△
Y
XXC
Y
Z
点燃
催化剂
△
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
高三复习专题讲座
——氮及其化合物
1、 本讲教学进度及主要内容
第三部分 元素及其化合物
第3章 氮族元素
主要内容:
1.掌握N元素的知识网络结构
2.掌握单质磷、N2、NH3、NH4+、HNO3等重要物质的性质或检验
3.掌握主要铵盐的分解规律、硝酸的反应规律
二、学习指导
(1) 含氮物质间相互转化
NH4Cl NH3 N2 NO NO2 HNO3
NH4+ +OH— NH3·H2O Mg3N2 N2O4 NaNO3
注意:在上面转化中有3个典型的可逆反应
(1)NH3溶于水存在着下列平衡:
NH3+H2O NH3·H2O NH4++OH—
由此可分析氨水的成分。
分子:NH3、NH3·H2O、H2O
氨水
离子:NH4+、OH—、H+(极少量)
比一比:①氨水和氯水中所含的微粒种类谁多?
②铵盐与碱溶液的反应与之有何不同?
提示:②NH4+与OH—在溶液中不能大量共存,所发生的反应程度较大,一般用“===”表示,但要注意反应条件是否加热影响产物的形式。
NH4++OH—====NH3·H2O (常温)
NH4++OH— NH3↑+H2O (加热)
(2)用N2和H2合成氨反应是典型可逆反应
N2+3H2 NH3
而NH3转变成N2未必一定要通过此可逆反应,可通过其它反应获得,如
①2NH3+3O2 2N2+6H2O
②2NH3+3CuO Cu+N2+3H2O
利用反应②测定水的质量和产生N2的体积(换算成物质的量)可测定氨气的组成
(3)NO2与N2O4的转化:
2NO2 N2O4
由于常温常压下即能发生此反应,故不可能有纯净的NO2或N2O4。通常实验测得的NO2的摩尔质量大于理论值,也是因为NO2中混有N2O4,若将此混合气体中通入足量NaOH溶液中,随着NO2被NaOH吸收,平衡将逆移,N2O4又将转变成NO2与NaOH作用,处理时可将1molN2O4当成2mol NO2计算。
该可逆反应有一定的隐敝性,通常考查方式为确定气体密度、压强、相对分子质量、体积等。在讨论温度或压强改变时,NO2气体的颜色变化问题,一定要考虑该平衡的移动。
另外,要注意NO、NO2、N2O4的性质及转化。
NO NO2 N2O4
颜色 无色 红棕色 无色
毒性 有 有 有
水溶性 难 反应 随NO2与H2O反应,平衡不断移动
与O2是否共存 否 能 能
相互转化①NO NO2 ②2NO2 N2O4(典型的可逆反应)
一般认为①正、反两方向的反应均为完全的。
(二)典型物质的结构、性质、用途、制取等内在关系
1.氮气
非极性分子 N≡N 叁键键能大
分子晶体
↓
物 性
↓
难溶于水 :N::N:
熔沸点很低
无色无气味 N2
气体
2.氨的结构和性质
分子式 电子式 结构式
表示式 NH H H
特点 -3价为N最低价 有孤对电子 极性分子与H2O形成氢键
性质 有还原性 与H+等形成配位 极易溶于水(1:700)
反应: 4NH3+5O2 4NO+6H2O4NH3+3O2 2N2+6H2O2NH3+3Cl2=N2+6HCl NH3+H+=NH4+NH3+HCl=NH 4Cl NH3+H2O NH3·H2O NH4++OH—
思考:在HCl的苯溶液中,通入NH3常有白色沉淀。为什么?
提示:HCl+NH3===NH4Cl , NH4Cl属离子化合物,在苯这种非极性溶剂中溶解性远小于水中。
3.硝酸
注意:NO3—与Fe2+(或S2—、I—)能共存,但当溶液中含有H+(浓度较大)时,则这些离子因发生氧化还原反应而不能大量共存。
(三)重要规律
1.关于Cu与浓、稀HNO3反应的规律
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO2(稀)===3Cu(NO3)2+2NO↑+4H2O
将amolCu与一定量(bmol)浓HNO3恰好完全反应,随着HNO3浓度逐渐降低,反应放出的气体中含有NO2(不考虑N2O4)、NO。
则放出气体总物质的量为:
n(g)=n(NO)+n(NO2)
=(b-2a)mol
原理:根据N原子守恒
被还原HNO3→转变成NO、NO2
未被还原HNO3→转变成Cu(NO3)2
Cu ~ Cu(NO3)2 ~ 2NO3— ~ 2HNO3(未还原)
amol 2amol
2.关于Fe与浓、稀HNO3反应情况
(1)钝化:Fe 致密氧化膜 膜被破化
思考:下述“敲铁成铜”的原因是什么?
钝化铁片 无现象 红色Cu析出
(2)Fe Fe3+
若HNO3不足量,不论浓、稀,则生成Fe2+,不能误认为Fe遇浓HNO3反应生成Fe3+,而与稀HNO3反应生成Fe2+。其实不论浓、稀HNO3,它们均能将Fe氧化成Fe3+,若Fe过量 ,则又将Fe3+还原为Fe2+。即由Fe与HNO3的物质的量相对多少来决定生成Fe3+还是Fe2+。
(3)若amolFe投入到含bmolHNO3的稀硝酸中恰好反应,假设生成的还原产物均为NO,求所得气体的物质的量。
可能发生的化学反应有2个。
①3Fe+8HNO3===3Fe(NO3)2+2NO↑+4H2O
②Fe+4HNO3===Fe(NO3)3+NO↑+2H2O
是否有必要讨论随着值不用,反应发生的情况?结论是不必。
分析上述2个反应,不难发现有共同特征
4HNO3(反应) ~ NO
4mol 1mol
bmol mol
即反应所得气体是HNO3总消耗量的1/4。
3.关于铵盐的分解规律
共性:铵盐不稳定,加热易分解
区别:①对应酸的稳定性、挥发性、氧化性不同,可影响产物的种类
②某些铵盐受热温度不同,产物可能不同。
常见的可分为以下几类:
(1)稳定且易挥发酸成的铵盐 NH3↑+酸的挥发物
如 NH4Cl NH3↑+HCl↑
NH4Cl
思考:①能用NH4Cl分解制NH3吗?
②NH4X与NH4Cl都类同吗?
③NaCl固体中含NH4Cl如何用简便方法除去?
提示:②NH4I受热时会有紫红色气体产生,是由于HI不稳定受热也分解。
(2)稳定难挥发酸成的铵盐 NH3↑+酸
如(NH4)SO4 2NH3↑+H2SO4
(3)不稳定且无强氧化性酸成的铵 NH3↑+酸的分解产物
如(NH4)2CO3 2NH3↑+H2O+CO2↑
NH4HCO3 NH3↑+H2O+CO2↑
NH4I NH3↑+I2↑+H2↑
(有色)
(4)由不稳定且有强氧化性酸(HNO3)成的盐
一般发生氧化还原反应
NH4N O3 温度不同,产物不同
低温,可得NH3+HNO3
如:5NH4NO3 2HNO3+4N2↑+9H2O
2NH4NO3 2N2↑+O2↑+4H2O+Cl
易爆物 注意妥善保存,勿研磨、撞击.!
(四)六种物质的检验
物质 试剂及主要现象 反应原理
NH3 湿红石蕊试纸 变蓝 NH3+H2O NH3·H2O NH4+ +OH—
浓盐酸 白烟 NH3+HCl==NH4Cl
NH NaOH(△) 有气体放出 NH+OH— NH3↑+H2O
NO 氧气 无色变红棕色 2NO+O2==2NO2
NO2 AgNO3溶液 无沉淀 3NO2+H2O==2HNO 3+NO
NO 铜片、浓H2SO4(共热) 有红棕色气体 3NO+2H2SO4(浓)+Cu Cu2++2NO2↑+2SO+2H2O
PO AgNO3 +HNO3(稀) 先产生黄色沉淀后又消失 3Ag++PO==Ag3PO4↓Ag3PO4+3H+==3Ag++H3PO4
(五)比较白磷和红磷
白(黄磷) 红(赤)磷
组成 P4 Px(x>4)
结构 结构更复杂
颜色 淡黄 暗红
状态 蜡状、质脆、固体 粉末状固体
气味 大蒜般的臭味 无臭
水溶性 不溶 不溶
CS2中溶解性 易溶 不溶
着火点 40℃(易自燃) 240℃
毒性 剧毒 无毒
用途 用于制高纯度H3PO4、制烟幕弹和燃烧弹 用于制农药及安全火柴
相互转变 白磷 红磷
保存 水封密闭 密封
(六)比较重要物质的制法(反应原理)
物质 实验室制法 工业制法
NH3 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O N2+3H2 2NH3
NO 3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O 4NH3+5O2 4NO+6H2
NO2 Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 2NO+O2==2NO2
HNO3 NaNO3+H2SO4(浓) NaHSO4+HNO3↑ NH3→NO→NO2→HNO3
注意
1.NH3的干燥剂选用
①氨是碱性气体(有水),故不能用酸性干燥剂,如浓H2SO4、P2O5等
②氨与CaCl2反应生成CaCl2·8NH3,故也不能用无水CaCl2
③氨只能用碱性干燥剂如碱石灰
三、典型例析
例1.1.92gCu投入到一定量浓HNO3中,铜完全溶解,生成的气休颜色由深变成浅(不考虑2NO2 N2O4),共收集到672mL气体(标况),通入一定体积的O2恰好使气体完全溶于水,求通入O2的体积(标况)。
解析:该题若按常规方法做还相当复杂,我们可换一种视角去观察,不追究具体过程,只关注起始和终了的状态。
HNO3 NO2、NO
O 2
HNO3总结果消耗,根据电子守恒得
Cu失电子数==O2得电子数
×2=×4
v=336(mL)
答:应通入O2336 mL
例2.加热硝酸铜结晶水合物和硝酸银的混和物1102克,使之完全分解,得到固体残渣48.4克。将反应产生的气体通过水充分吸收后,剩余气体为1.68升(S.T.P),求原混合物中硝酸铜结晶水合物的分子式。
已知:Cu(NO3)2和AgNO3受热分解的反应式为:
2Cu(NO3)2 2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
解析:4NO2+O2+2H2O==4HNO3
而Cu(NO3)2分解产生的NO2和O2的体积比为4 :1,被水完全吸收。AgNO3分解出的气体经与水反应后剩余1.68升。
设原混和物中Cu(NO3)2含x摩,AgNO3含y摩.则:
80·x+108·y=48.4
y·=
解之得x=0.2(摩)=0.3(摩)
设硝酸铜晶体为Cu(NO3)2·xH2O
Cu(NO3)2·xH2O ~ Cu(NO3)2
188+18x 1
110.2-0.3×170 0.2
=
答:硝酸铜晶体的分子式为Cu(NO3)2·6H2O
例3.下图表示的反应关系中,部分产物被略去,已知X为1mol固体,A、B、C各是1mol无色气体,B在常温下为液态,D、E、F为气态,G为液态,试推断各物质的化学式:
X________,A________,B________,C________,D________,E________,F________,G________,
解析:由于X既能与HCl又能与NaOH反应产生气体,且加热到200℃即可分解,说明X应为弱酸的铵盐,对应是何种弱酸?是酸式盐还是正盐?这需要进一步分析。
由于A(g)与Na2O2反应且有气体D生成,故可推得A应为CO2而不是SO2,否则由于发生反应:
SO2+Na2O2===Na2SO4
而无气体生成。
另外1molx固体,生成A、B、C各为1mol,说明它为NH4HCO3而不是(NH4)2CO3。
NH4HCO3 NH3↑+CO2↑+H2O
(NH4)2CO3 2NH3↑+CO2↑+H2O
再综合整个框图信息可知:
X—NH4HCO3,A—CO2, B—H2O,C—NH3 , D—O2,E—NO,F—NO2,G—HNO3
巩 固 练 习
(一)选择题
1.常温时能溶于浓HNO3的单质是( )
A.Al B.Fe C.Cu D.C
2.下列反应中HNO3既表现出酸性,又表现出强氧化性的是( )
A.Fe2O3+HNO3 B.Ca(OH)2+HNO3
C.C+HNO3 D.FeO+HNO3
3.下列制取物质的方法合适的是( )
A.硝酸和FeS反应制H2S B.硝酸和Cu(OH) 2反应制Cu(NO3)2
C.硝酸和Na2SO4反应制H2SO4 D.硝酸和KF反应制F2
4.下列对硝酸的认识不正确的是( )
A.打开浓硝酸的瓶盖会产生棕色的烟
B.锌跟稀硝酸的反应是置换反应
C.常用硝酸来制作炸药、化肥
D.稀硝酸也是一种强氧化性酸
5.氢化铵(NH4H)与NH4Cl结构相似,NH4H和水反应有H2生成,下列叙述不正确的是( )
A.NH4H溶于水时,NH4H是氧化剂 B.NH4H溶于水后所形成的溶液显酸性
C.NH4H为离子化合物 D.NH4H固体溶于水有两种气体生成
6.下列分子或离子的结构属于正四面体的是( )
A.氨分子 B.铵根离子 C.白磷分子 D.红磷
7.从液态空气中分离出来的稀有气体,常含有少量氮气和氧气,为了除去氮气和氧气,可把气体通过( )。
A.灼热的镁条 B.灼热的铜丝
C.浓H2ASO4 D.一氧化氮
8.下列过程属于人工固氮的是( )
A.分离液态空气制氮气 B.闪电时N2转化为NO
C.合成氨 D.豆科作物根瘤菌将N2转化为化合态氮
9.下列用途中,应用了氮气不活泼性质的是( )。
A.金属焊接时保护气,和氩气混合充填灯泡 B.用于合成氨气
C.工业上以氮气为原料之一制硝酸 D.保护粮食和水果
10.38.4mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4mL(标准状况下),反应消耗的HNO3的物质的量可能是( )
A.1.0×10—3mol B.1.6×10—3mol C.2.2×10—3mol D.2.4×10—3mol
11.相同湿度和压强的条件下,在体积相同的三个烧瓶中分别盛有NH3、HCl、NO2气体,并分别倒立在水槽里,充分溶解后,烧瓶内三种溶液的物质的量浓度之比为(设烧瓶中溶液未扩散到水槽里)(面 )
A.1 :1 :1 B.2 :2 :3 C.3:3 :2 D.2 :2 :1
12.下列各组气体①NO2+NO、②NO2+O2、③NH3+N2、④NO+N2等体积混合,分别通入体积相同的试管并立即倒立在足量的水中,试管内水面上升的高度分别为h1、h2、h3、h4。下列高度关系判断正确的是( )
A.h2>h3>h1>h4 B.h3>h2>h1>h4 C.h1=h2=h3=h4 D.h1>h2>h3>h4
13.下列各组中的两种物质,能直接相互转变的是( )
A.NH3、NO B.O2、F2 C.NO、NO2 D.H2S、SO2
14.铜与1mol/L的硝酸反应,如果NO浓度下降0.2mol/L,则溶液中[H+]同时下降( )
A.0.2mol/L B.0.4mol/L C.0.6mol/L D.0.8mol/L
15.25.6mgCu与含有1.4×10—3molHNO3的浓硝酸恰好完全反应,反应完全后收集到的气体在标准状况下的体积为( )
A.7.84mL B.13.44mL C.15.68mL D.17.92mL
16.常温下,将等物质的量铜片、铁片、铝片和银片分别置于四个小烧杯中,然后各加入足量的浓硝酸,放出NO2气体的体积最多的是( )
A.铜片 B.铁片 C.铝片 D.银片
17.甲、乙、丙、丁在常温下为四种气体,它们都是大气污染物。已知:甲的水溶液是一种无氧酸;乙是形成酸雨的主要物质;丙可与甲发生氧化还原反应;丁能与血红蛋白作用而使人体中毒,则甲、乙、丙、丁依次可能为( )
A.HBr、SO2、Cl2、CO B.H2S、SO3、Cl2、NO
C.H2S、SO2、Cl2、NO D.HCl、NO2、Cl2、NO
(二)填空
18.有下列6种物质:①钠 ②白磷 ③苛性钠溶液 ④硝酸银溶液 ⑤浓硝酸 ⑥浓氨水。其中应保存在棕色瓶中的是___________,应保存在煤油中的是___________,应保存在水中的是__________,应保存在胶塞的试剂瓶中的是__________。
19. 下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已删去)。
A B C D E
回答下列问题:
(1)A是__________,Y是__________,Z是_____________。
(2)当X是强酸时,A、B、C、D、E均含有同一种元素,E是_______________。
(3)当X是强碱时,A、B、C、D、E均含有同一种元素,E是_______________。
(4)写出X在两种情况下,B→C的化学方程式_____________________________,
________________________________。
(5)当X是强碱时,写出E的稀溶液与铜片发生反应的离子方程式:________________。
20.用下图装置制取和收集气体。根据装置分析后填下表(可不填满):
编号 A中的固体物质 B中的溶液 C中的气体
(1)
(2)
(3)
21.向一试管中用排空气法充入一定量气体后进
行如右图的实验:
(1)向度管中充入的气体是_________(填化学
式),理由是__________,滴入的指示剂是___
____________。
22.现有下列实验过程
(1)W的化学式是_____________________。
(2)应用上述途径制取Y气体,选择下列合适的发生装置___________(填标号)
(3)若用右上图装置收集气体X和Y,则进气管口合理的应是(填管口字母,下同)_______ ;若是收集气体Z,则进气管口合理的应是_________。
(4)用(3)中的装置以及量筒、导管和水等来粗略测定Y气体的体积,则进气管口合理的应是______________。若Y气体中混有少量的X气体,则对Y体积的测量结果有无影响?并说明理由______________________________________。
(5)若实验室制取气体X不用题(2)中所选的发生装置,请选出其它方法所用试剂(只举一例):__________________________________________。
(三)计算
23.取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470g。冷却后加入足量水,将反应产物加热蒸干并灼烧,得到的氧化镁质量为0.486g。
(1)写出氮化镁与水发生水解反应的方程式
(2)计算燃烧所得混合物中氮化镁的质量分数。
参 考 答 案
(一)1.C 2.D 3.B 4.A、B 5.A、B 6.B、C 7.A 8.C 9.AD
10.C 11.A 12.A 13.C 14.D 15.B 16.A 17.A、C
(二)18.④⑤,①,②,③
19.(1)(NH4)2S,O2,H2O
(2)H2SO4 (3)HNO3
(4)2H2S+O2 S+2H2O
4NH3+5O2 4NO+6H2O
(5)3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O
20.(1)Na2SO3固体、较浓H2SO4,SO2 (2)Cu ,浓HNO3, NO2
(3)KMnO4固体,浓HCl,Cl2
21.(1)NH3,)< ,酚酞
22.(1)CH3COONH4,(2)A (3)a,b (4)a,无影响,因 NH3极易溶于水
(5)浓氨水和固体NaOH
(三)23.(1)Mg3N2+6H2O==3Mg(OH)2↓+NH3↑
(2)设混合物中Mg3N2的质量分数为x
Mg3N2 ~ 3MgO ~△m
100g 120g 20g
0.470g·x (0.486-0.470)g
= x=0.17
答:Mg3N2的质量分数为17%
①浓酸、Cu
△
Ca(OH) 2△
HCl
H2、高温、高压
催化剂
O2
放电
O2
H2O
H2O
②见光或△
③浓酸、C
NaOH
参
与
有
机反 应
△H2SO4
Mg
点
燃
H2O
H2O
硝基苯
三硝基甲苯
硝酸乙酯
硝化甘油
硝化纤维
O2、催化剂、△
稀酸、Cu
△
高温高压
催化剂
点燃
△
O2
H2O或SO2
化性
用途
常 温:很难反应(作保护气)
高 温:但能反应(制NH3、HNO3)
(或放电)
氧化性
N2+3H2 2NH3
高温、高压
催化剂
3Mg+N2 Mg3N2
点燃
N2+O2 2NO
点燃
还原性
固
定
氮的化合态
H:N:H
H
‥
cat
△
点燃
无色
有刺激性
易挥发
任意比
溶于水
酸性
不稳定性
HNO3=H++NO3—
4HNO3 4NO2+O2↑+2H2O
△
或光
久置
黄
HNO3
存放:
棕色瓶、冷暗处、密封
氧化性
浓
CO2、SO2、H3PO4
C、S、P
△
Fe、Al
冷
一般金属
钝化
M(NO3)n(高价)+NO2
M(NO3)n(高价)+NO2
M(NO3)2+N2O或N2或NH4+
一般金属
较活泼金属
Zn、Mg等
I2
I—
S2—
Fe2+
或Fe(OH)2
S
Fe3+
+NO
王水
溶解Pt、Au
HNO3
物性
化性
稀
消耗HNO3(总)
常 温
浓HNO3
加热
钝化
继续反应
应用
用Fe或Al制容器运装浓HNO3
CuSO4溶液
敲击铁片
浓HNO3(足量)
或稀HNO3(足量)
△
△
冷
△
△
===
△
△
△
△
190℃
500℃
或撞击
(爆炸性分解反应)
△
△
P
P
P
P
260℃
416℃升华、冷凝
均要隔绝空气
△
高温高压
催化剂
△
微热
Cu
△
△
△
△
Y
XXC
Y
Z
点燃
催化剂
△
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
