(特别免费资料)高二化学暑假专题-非金属及其化合物
文档属性
| 名称 | (特别免费资料)高二化学暑假专题-非金属及其化合物 |  | |
| 格式 | rar | ||
| 文件大小 | 47.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-22 09:24:00 | ||
图片预览



文档简介
高二化学暑假专题
——非金属及其化合物
测试时限:120分钟 试卷分值:150分
学校____________班级_________学号_______姓名______________
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 Mg 24 Al 27 Fe 56 C 12
S 32 Cu 64 Ag 108
第Ⅰ卷 (选择题 共72分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.在日光照射下,颜色将变浅的是 ( )
A.?AgCl B.?HI C.?氯水 D.?浓HNO3
2. 用铜锌合金制成假金元宝骗人的事件屡有发生。下列不易区别其真伪的方法是( )
A.测定密度 B.放入硝酸中 C.放入盐酸中 D.观察外观
3. 硫化氢和浓硫酸能发生如下反应: 3H2S+H2SO4==4S+4H2O,下列说法正确的是 ( )
A. 硫化氢气体被氧化成硫 B. 硫酸被氧化成硫
C. 硫酸被还原成水 D. 硫化氢气体被还原成水
4.下列物质不属于同素异形体的是 ( )
A. 金刚石和石墨 B. 水晶和石英 C. 红磷和白磷 D. C60和金刚石
5.取2.8g某元素的单质X在一定条件下与氧气充分反应,得到6g化合物XO2。该元素在周期表中的位置属于 ( )
A.第三周期 B.第二周期 C.第Ⅳ主族 D.第Ⅴ主族
6.常用氯气给自来水消毒。某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是 ( )
A.石蕊 B.硝酸银 C.亚硫酸钠 D.氯化铝
7.将等体积的SO2和Cl2气混和后通入含有石蕊的水中,溶液的颜色将 ( )
A. 褪色 B. 仍为紫色 C. 变红 D. 变蓝
8. 把N2、O2、CO2按体积比为2:1:1混合后, 通过很厚的灼热炭层, 使其充分反应, 所得混合气体中CO占总体积的 ( )
A. 1/2 B. 1/3 C. 2/3 D. 1/4
二.选择题(本题包括16小题,每小题3分,共48分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9. 在下列反应里,氧化剂和还原剂的物质的量之比与质量之比不一致的是 ( )
A. Cl2+H2O==HClO+HCl B. 3NO2+H2O==2HNO3+NO
C. SiO2+3CSiC+2CO D. Si+O2SiO2
10. 在4FeS2十11O22Fe2O 3+8SO2的反应中,被氧化的元素是 ( )
A.铁 B.硫 C.铁和硫 D.氧和铁
11. 如右图所示中四条直线,分别表示钠、 w金属
镁、铝、铁和足量Cl2反应消耗金属质量(纵 d
轴)与反应掉氯气质量(横轴)的关系,其中代 c b a
表铁和氯气反应的直线是( )
A.a B.b C.c D.d wCl2
12. X(盐)+Y(酸)反应, 可放出有气味的气体Z, Z跟过量NaOH反应又得到X; Z氧化的最终产物为W气, W气溶于水又得到Y, 则X和Y是 ( )
A. Na2S和稀H2SO4 B. Na2SO3和盐酸
C. Na2S和盐酸 D. Na2SO3和稀H2SO4
13. 高温下用碳还原某金属氧化物MO2,在标准状况下,得到400mLCO、100mLCO2和0.978g金属M。则M的相对原子质量为 ( )
A. 40 B. 73 C. 118 D. 207
14. 将配平后,离子方程式中H2O的系数是
( )
A.2 B.4 C.6 D.8
15.接触室里装一个热交换器,其主要目的是 ( )
A.冷却反应后的混合气体
B.给催化剂加热
C.把反应放出的热量传递给需要预热的反应混合气体
D.降低接触室的温度,以免温度过高烧坏设备
16.氰气分子式为(CN)2,它的性质和卤素类似,称为拟卤素。下列对其特性和有关化合物的性质的叙述正确的是 ( )A.?(CN)2与氢氧化钠能反应,方程式为:2NaOH+(CN)2===NaCN+NaCNO+H2O
B.?(CN)2易溶于水且与水反应
C.?KCN是剧毒物质
D.?NaCN和AgCN都易溶于水
17. 下列离子方程式不正确的是 ( )
A. 碳酸氢钙溶液和盐酸反应: HCO3-+H+==CO2↑+H2O
B. 硫化钠溶液中加入盐酸: S2-+2H+==H2S↑
C. 氯气通入水中: Cl2+H2O==2H++Cl-+ClO-
D. 碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH-==CO32-+NH3+H2O+H2O
18.将充有m mL NO和n mL N02气体的试管倒立于水槽中,然后通入m mL O2。若已知n>m,则充分反应后,试管中的气体在同温、同压下的体积为 ( )
A.(4n-1)/12mL B.(n-m)/3mL C.(3m+n)/3mL D.3(n-m)mL、
19.关于新制的氯水和久置的氯水,说法不正确的是 ( )
A.?新制的氯水呈黄绿色,久置的氯水无色
B.?新制的氯水漂白作用强,久置的氯水漂白作用很弱或消失
C.?新制的氯水中没有氯离子,久置的氯水中才含有氯离子
D.?新制的氯水中含氯气多,久置的氯水中含有极少量的氯气或不含氯气
20.下列说法不正确的是 ( )
A.硫是一种淡黄色的能溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫与氧属于同一主族
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
21.下列试剂:①浓氨水、②氯水、③硝酸银、④浓硝酸、⑤浓盐酸、⑥溴化银,
其中必须用棕色试剂瓶装的有 ( )
(A)①②③④⑤⑥ (B)②③④⑥ (C)②③⑤⑥ (D)①③④⑥
22. 用氨水处理硫酸工业的废气,主要是为了 ( )
A.利用废气中的热量 B.保护环境,防止空气污染
C.充分利用原料 D.以上说法都对
23. 某雨水样品刚采集时测得pH为4.82,放在烧杯中经2 h后,再次测得pH为4.68。以下叙述正确的是 ( )
A.雨水样品酸度逐渐减小
B.雨水样品酸度没有变化
C.雨水样品继续吸收空气中的CO2
D.雨水样品中的H2SO3逐渐被空气中的氧气氧化成H2SO4
24.某无色混合气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下连续处理(假定每步处理均反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清石灰水时,溶液变浑浊。由此可以确定原混合气体中 ( )
A.一定含有CO2、H2O,至少含有H2、CO中的一种
B.一定含有H2O、CO,至少含有CO2、H2中的一种
C.一定含有CO、CO2,至少含有H2O、H2中的一种
D.一定含有CO、H2,至少含有H2O、CO2中的一种
第Ⅱ卷 (非选择题 共78分)
三.(本题包括2小题,共19分)
25. (10分)工业上把黄铁矿粉碎成细小矿粒后,才放入_________内进行燃烧,其目的是_______________________________。出来的炉气含有____________________等杂质以及水蒸气,因此在进行氧化反应以前必须使炉气通过除尘、洗涤、干燥等净化设备,其目的是_______________。工业上用___________的硫酸而不直接用水或稀硫酸来吸收三氧化硫,其目的是________________________________________。从吸收塔上部出气管排出的尾气其主要成分是________,这种尾气在空气中形成“酸雾”的主要成分是_________。
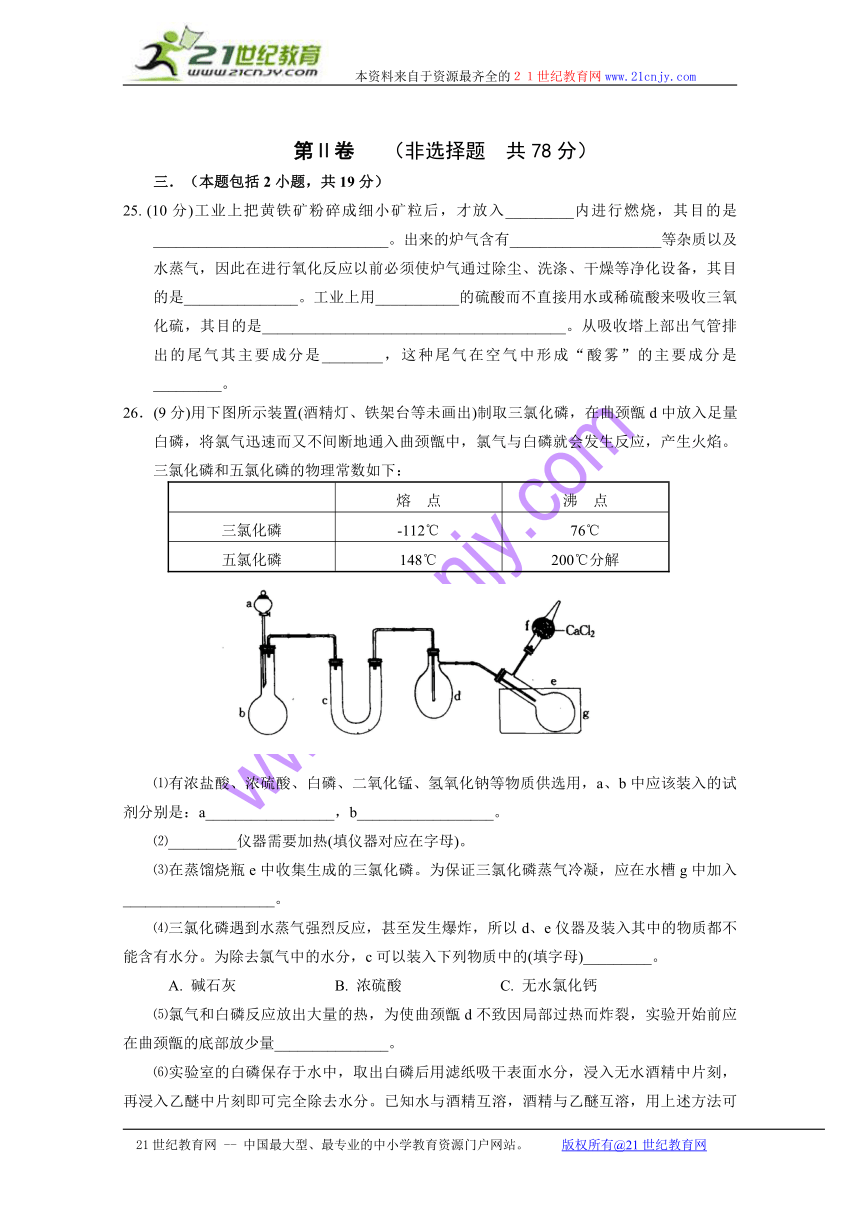
26.(9分)用下图所示装置(酒精灯、铁架台等未画出)制取三氯化磷,在曲颈甑d中放入足量白磷,将氯气迅速而又不间断地通入曲颈甑中,氯气与白磷就会发生反应,产生火焰。三氯化磷和五氯化磷的物理常数如下:
熔 点
沸 点
三氯化磷
-112℃
76℃
五氯化磷
148℃
200℃分解
⑴有浓盐酸、浓硫酸、白磷、二氧化锰、氢氧化钠等物质供选用,a、b中应该装入的试剂分别是:a_________________,b__________________。
⑵_________仪器需要加热(填仪器对应在字母)。
⑶在蒸馏烧瓶e中收集生成的三氯化磷。为保证三氯化磷蒸气冷凝,应在水槽g中加入____________________。
⑷三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d、e仪器及装入其中的物质都不能含有水分。为除去氯气中的水分,c可以装入下列物质中的(填字母)_________。
A. 碱石灰 B. 浓硫酸 C. 无水氯化钙
⑸氯气和白磷反应放出大量的热,为使曲颈甑d不致因局部过热而炸裂,实验开始前应在曲颈甑的底部放少量_______________。
⑹实验室的白磷保存于水中,取出白磷后用滤纸吸干表面水分,浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知水与酒精互溶,酒精与乙醚互溶,用上述方法可除去水分的原因是______________________________________________________________。
⑺为防止氯气污染空气,装置末端导出的气体最好用_______(填字母)进行净化处理。
A. NaOH溶液 B. Ca(OH)2溶液 C. 饱和食盐水
四.(本题包括2小题,共20分)
27.(10分)山区某工厂,在山坡坑道的仓库里贮有氯气钢瓶。某一天,一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取以下措施。请选择填充并简述理由。
(1)处理钢瓶的正确方法是__________________________。
(A)把钢瓶推到山坡下小河里 (B)把钢瓶丢到深坑里,用石灰填埋 (C)把钢瓶扔到农田里
简述理由_____________________________________________________________________。
(2)钢瓶处理后,工人转移的方法正确的是___________________。
(A)转移到坡上 (B)转移到坡下
简述理由____________________________________________________________________。
28. (10分) 在盛有淀粉KI溶液(用H2SO4酸化)的试管中,滴加少量的次氯酸钠溶液,会立即看到溶液变在蓝色,这是因为___________________________________________________的缘故,相应的离子方程式为________________________________________________。在盛有淀粉和碘形成的蓝色溶液中,滴加Na2SO3溶液,又发现蓝色溶液逐渐消失,这是因为_______________________________________________________的缘故,相应的离子方程式为_________________________________________________________。对比上述两组实验所得结果,可得出ClO-、I2、SO42-的氧化性由强到弱的顺序为_________________________________。
五.(本题包括2小题,共20分)
29.(10分)锗是ⅣA族元素,它的单质晶体是一种良好的半导体材料,被广泛地应用在电子工业上。锗可以从燃烧的烟道灰中提取,其过程可表示如下:
烟道灰中所含锗 锗 的 锗 纯净的锗
的氧化物(高价) 氯化物 酸 的氧化物
根据以上实验过程,写出各步反应的化学方程式:
①_______________________________________;
②_______________________________________;
③_______________________________________;
④_______________________________________。
30.(10分)酸雨是由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4和HNO3(主要是H2SO4)随雨水降落而形成的。为防止污染,硫酸厂用氨水来吸收二氧化硫,离子方程式为_____________________________________;硝酸厂可用烧碱溶液来吸收氮的氧化物,如NO2被烧碱吸收生成NaNO2和NaNO3,离子方程式为_____________________________;也可用氨的催化还原法把氮的氧化物变成氮气,还原1体积NOx需要________体积氨气。对酸雨地区的治理,目前一种比较有效的方法是用直升飞机喷撒白垩粉,降解酸雨污染,其离子方程式是(分别写出与硫酸与硝酸的反应)_________________________________________
____________________________________________________________________________。
六.(本题包括2小题,共19分)
31.(9分)某硫酸厂每天用含FeS260%的硫铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%。每天能生产98%的硫酸多少吨?
32.(10分)为了测定某铜银合金的成分,将30.0 g该合金溶于80 mL13.5mol/L的浓HNO3中,待合金完全溶解后,收集到气体6.72 L(标准状况),并测得溶液的c(H+)=1mol/L。假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
参考答案
1?C
2.D [解题思路] 本题要求学生综合运用物质物理性质、化学性质解决现实生活中的问题。强调理论与实际相结合,学以致用,侧重考查学科“双基”解决实际问题
铜锌合金通常说的是黄铜,颜色和黄金相似,其密度明显小于黄金,而放人HNO3或HCl中,黄铜会发生反应而黄金不会发生反应。故区别其真伪可用A、B、C,
3. A 4. B 5.AC
6.D [解题思路]氯水是一种由多种分子(Cl2、H2O、HClO)和多种离子(H+、Cl-、ClO-等)组成的混合物,在涉及氯水的化学反应时,既要考虑分子具有的性质,又要考虑离子具有的性质。Cl2溶于水会部分发生下列反应:Cl2+H2O=HCl+HClO。HClO可使石蕊氧化褪色;HCl跟AgNO3反应: AgNO3+HCl=AgCl↓+HNO3;Cl2氧化Na2SO3:Cl2+Na2SO3+H2O=2HCl+Na2SO4;Cl2不能跟AlCl3反应。
7. C 8. C 9. D 10.C
11.C [解题思路] 本题较复杂,必须逐个分析比较,获得题解
(1)2Na+Cl22NaCl (2)Mg+Cl2MgCl2
(3)2A1+3Cl22AlCl3 (4)2Fe十3Cl22FeCl3
为了便于比较,将(3)、(4)改写为:
Al十Cl2AlCl3 Fe十Cl2FeCl3
假设反应掉的Cl2的质量为71g,即在横坐标上取一点向纵坐标作垂线,则需要钠、镁、铝、铁的质量分别为:
WNa=2×23=46(g) WMg=24(g)
WAl=×27=18(g) WFe=×56=37.3(g)
由此可知,d为(1)反应,c为(4)反应,b为(2)反应,a为(3)反应,故答案为C。
12. AD 13.B
14.C [解题思路] 此题考查的是氧化还原反应离子方程式的配平方法。由得失电子数目守恒可配平NO3-、Zn、NH3、Zn(OH)42-的系数分别为1、4、1、4,再由电荷守恒可知OH-的系数为7,最后由原子守恒得H2O的系数为6。
15.C 16.?AC 17. CD
18.B [解题思路]据反应3NO2+H2O=2HNO3+NO知,nmL溶于水可得n/3mL的NO,所以共有NO为(m+)mL通入mmLO2后发生反应
4NO + 3O2 + 2H2O = 4HNO3
4 3
(m+)mL m mL
因为n>m,所以NO过量,共过量m+-=-=(n-m)/3mL
19.C 20.AD 21.B 22.BC 23.D
24.D [解题思路]通过碱石灰时,CO2和H2O都能被其吸收,体积变小,说明至少含其中一种;通过碱石灰后的气体只能为H2、CO中的一种或两种,通过热的氧化铜后的气体能使无水硫酸铜变蓝说明原气体中一定有H2,能使石灰水变浑浊,说明一定有CO。
25.(10分)沸腾炉(1分);增大接触面积(1分);提高反应物利用率(1分);砷、硒化合物(1分);防止催化剂中毒(1分);98.3%(1分);防止形成酸雾,有利于SO3的吸收(2分);N2、SO2、O2等(1分);SO2(1分)
26.(9分)⑴浓盐酸(1分)、MnO2 (1分) ⑵b (1分) ⑶冷水(1分) ⑷C (1分) ⑸干燥的沙子(1分) ⑹白磷上残留的水溶解在酒精中,残留的酒精又溶解在乙醚中(2分) ⑺A (1分)
27. (10分) (1)B(2分) 因为泄漏的氯气会与石灰发生反应可防止氯气扩散(3分)
(2)A (2分) 因为氯气密度比空气大,易向坡下扩散,在坡上相对较安全 (3分)
28.(10分)I-被ClO-氧化为I2,I2遇淀粉变蓝色(2分);ClO-+2I-+2H+==Cl-+I2+H2O(2分);I2被SO32-还原为I-(2分);I2+SO32-+H2O=2H++SO42-+2I-(2分);ClO->I2>SO42-(2分)
29. (10分)①GeO2+4HCl==GeCl4+2H2O(2分) ②GeCl4+3H2O==H2GeO3+4HCl(2分)
③H2GeO3GeO2+H2O(2分) ④GeO2+2H2Ge+2H2O(2分)
30.(10分)2NH3·H2O+SO2=2NH4++SO32-+H2O(2分);2NO2+2OH-=NO3-+NO2-+H2O(2分);2x/3(2分);CaCO3+2H++SO42-=CaSO4+CO2↑+H2O(2分);CaCO3+2H+=Ca2++CO2↑+H2O(2分)。
31.(9分)[解题思路] 沸腾炉中损失5%的硫,SO2转化率为90%这些都可转化为S元素的损失,进而转化为FeS2的损失。所以设生产98%的硫酸x吨。则由关系式:
FeS2————————————2H2SO4 (2分)
120 2×98
500t×60%×(1-5%) ×90% x×98% (4分)
即:120t:[500×60%×(1-5%) ×90%]=2×98: x×98%
解得 x=427.5吨 (3分)
32.(10分)[解题思路](1)硝酸被还原后的产物是NO或N02,因为1 molHN03被还原得到1molNO或N02,因此产生气体的物质的量即是被还原的HNO3的物质的量==0.3mol。(5分)
(2)因为反应后c(H+)=1mol/L ,说明硝酸过量。参加反应的硝酸为
13.5mol/L×0.080L-1mol/L×0.080L=1mol。
设合金中Ag的物质的量为x,Cu的物质的量为y。
根据质量为30.0g,可建立方程式:
108g/mol·x+64g/mol·y=30.0g……①。
1mol参加反应的HNO3中有0.3mol被还原,有0.7mol起酸的作用生成硝酸盐,据此有
x十2y=0.7mol……②。
联立①、②式,解得:x=0.1mol,y=0.3mol。
w(Ag)=×100%=36.0%。(5分)
21世纪教育网
本试卷由21世纪教育网http://www.21cnjy.com/供稿,下载更多教学资源,请登录21世纪教育网
——非金属及其化合物
测试时限:120分钟 试卷分值:150分
学校____________班级_________学号_______姓名______________
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 Mg 24 Al 27 Fe 56 C 12
S 32 Cu 64 Ag 108
第Ⅰ卷 (选择题 共72分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.在日光照射下,颜色将变浅的是 ( )
A.?AgCl B.?HI C.?氯水 D.?浓HNO3
2. 用铜锌合金制成假金元宝骗人的事件屡有发生。下列不易区别其真伪的方法是( )
A.测定密度 B.放入硝酸中 C.放入盐酸中 D.观察外观
3. 硫化氢和浓硫酸能发生如下反应: 3H2S+H2SO4==4S+4H2O,下列说法正确的是 ( )
A. 硫化氢气体被氧化成硫 B. 硫酸被氧化成硫
C. 硫酸被还原成水 D. 硫化氢气体被还原成水
4.下列物质不属于同素异形体的是 ( )
A. 金刚石和石墨 B. 水晶和石英 C. 红磷和白磷 D. C60和金刚石
5.取2.8g某元素的单质X在一定条件下与氧气充分反应,得到6g化合物XO2。该元素在周期表中的位置属于 ( )
A.第三周期 B.第二周期 C.第Ⅳ主族 D.第Ⅴ主族
6.常用氯气给自来水消毒。某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是 ( )
A.石蕊 B.硝酸银 C.亚硫酸钠 D.氯化铝
7.将等体积的SO2和Cl2气混和后通入含有石蕊的水中,溶液的颜色将 ( )
A. 褪色 B. 仍为紫色 C. 变红 D. 变蓝
8. 把N2、O2、CO2按体积比为2:1:1混合后, 通过很厚的灼热炭层, 使其充分反应, 所得混合气体中CO占总体积的 ( )
A. 1/2 B. 1/3 C. 2/3 D. 1/4
二.选择题(本题包括16小题,每小题3分,共48分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
9. 在下列反应里,氧化剂和还原剂的物质的量之比与质量之比不一致的是 ( )
A. Cl2+H2O==HClO+HCl B. 3NO2+H2O==2HNO3+NO
C. SiO2+3CSiC+2CO D. Si+O2SiO2
10. 在4FeS2十11O22Fe2O 3+8SO2的反应中,被氧化的元素是 ( )
A.铁 B.硫 C.铁和硫 D.氧和铁
11. 如右图所示中四条直线,分别表示钠、 w金属
镁、铝、铁和足量Cl2反应消耗金属质量(纵 d
轴)与反应掉氯气质量(横轴)的关系,其中代 c b a
表铁和氯气反应的直线是( )
A.a B.b C.c D.d wCl2
12. X(盐)+Y(酸)反应, 可放出有气味的气体Z, Z跟过量NaOH反应又得到X; Z氧化的最终产物为W气, W气溶于水又得到Y, 则X和Y是 ( )
A. Na2S和稀H2SO4 B. Na2SO3和盐酸
C. Na2S和盐酸 D. Na2SO3和稀H2SO4
13. 高温下用碳还原某金属氧化物MO2,在标准状况下,得到400mLCO、100mLCO2和0.978g金属M。则M的相对原子质量为 ( )
A. 40 B. 73 C. 118 D. 207
14. 将配平后,离子方程式中H2O的系数是
( )
A.2 B.4 C.6 D.8
15.接触室里装一个热交换器,其主要目的是 ( )
A.冷却反应后的混合气体
B.给催化剂加热
C.把反应放出的热量传递给需要预热的反应混合气体
D.降低接触室的温度,以免温度过高烧坏设备
16.氰气分子式为(CN)2,它的性质和卤素类似,称为拟卤素。下列对其特性和有关化合物的性质的叙述正确的是 ( )A.?(CN)2与氢氧化钠能反应,方程式为:2NaOH+(CN)2===NaCN+NaCNO+H2O
B.?(CN)2易溶于水且与水反应
C.?KCN是剧毒物质
D.?NaCN和AgCN都易溶于水
17. 下列离子方程式不正确的是 ( )
A. 碳酸氢钙溶液和盐酸反应: HCO3-+H+==CO2↑+H2O
B. 硫化钠溶液中加入盐酸: S2-+2H+==H2S↑
C. 氯气通入水中: Cl2+H2O==2H++Cl-+ClO-
D. 碳酸氢铵溶液中加入足量氢氧化钡溶液: NH4++HCO3-+2OH-==CO32-+NH3+H2O+H2O
18.将充有m mL NO和n mL N02气体的试管倒立于水槽中,然后通入m mL O2。若已知n>m,则充分反应后,试管中的气体在同温、同压下的体积为 ( )
A.(4n-1)/12mL B.(n-m)/3mL C.(3m+n)/3mL D.3(n-m)mL、
19.关于新制的氯水和久置的氯水,说法不正确的是 ( )
A.?新制的氯水呈黄绿色,久置的氯水无色
B.?新制的氯水漂白作用强,久置的氯水漂白作用很弱或消失
C.?新制的氯水中没有氯离子,久置的氯水中才含有氯离子
D.?新制的氯水中含氯气多,久置的氯水中含有极少量的氯气或不含氯气
20.下列说法不正确的是 ( )
A.硫是一种淡黄色的能溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫与氧属于同一主族
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
21.下列试剂:①浓氨水、②氯水、③硝酸银、④浓硝酸、⑤浓盐酸、⑥溴化银,
其中必须用棕色试剂瓶装的有 ( )
(A)①②③④⑤⑥ (B)②③④⑥ (C)②③⑤⑥ (D)①③④⑥
22. 用氨水处理硫酸工业的废气,主要是为了 ( )
A.利用废气中的热量 B.保护环境,防止空气污染
C.充分利用原料 D.以上说法都对
23. 某雨水样品刚采集时测得pH为4.82,放在烧杯中经2 h后,再次测得pH为4.68。以下叙述正确的是 ( )
A.雨水样品酸度逐渐减小
B.雨水样品酸度没有变化
C.雨水样品继续吸收空气中的CO2
D.雨水样品中的H2SO3逐渐被空气中的氧气氧化成H2SO4
24.某无色混合气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下连续处理(假定每步处理均反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清石灰水时,溶液变浑浊。由此可以确定原混合气体中 ( )
A.一定含有CO2、H2O,至少含有H2、CO中的一种
B.一定含有H2O、CO,至少含有CO2、H2中的一种
C.一定含有CO、CO2,至少含有H2O、H2中的一种
D.一定含有CO、H2,至少含有H2O、CO2中的一种
第Ⅱ卷 (非选择题 共78分)
三.(本题包括2小题,共19分)
25. (10分)工业上把黄铁矿粉碎成细小矿粒后,才放入_________内进行燃烧,其目的是_______________________________。出来的炉气含有____________________等杂质以及水蒸气,因此在进行氧化反应以前必须使炉气通过除尘、洗涤、干燥等净化设备,其目的是_______________。工业上用___________的硫酸而不直接用水或稀硫酸来吸收三氧化硫,其目的是________________________________________。从吸收塔上部出气管排出的尾气其主要成分是________,这种尾气在空气中形成“酸雾”的主要成分是_________。
26.(9分)用下图所示装置(酒精灯、铁架台等未画出)制取三氯化磷,在曲颈甑d中放入足量白磷,将氯气迅速而又不间断地通入曲颈甑中,氯气与白磷就会发生反应,产生火焰。三氯化磷和五氯化磷的物理常数如下:
熔 点
沸 点
三氯化磷
-112℃
76℃
五氯化磷
148℃
200℃分解
⑴有浓盐酸、浓硫酸、白磷、二氧化锰、氢氧化钠等物质供选用,a、b中应该装入的试剂分别是:a_________________,b__________________。
⑵_________仪器需要加热(填仪器对应在字母)。
⑶在蒸馏烧瓶e中收集生成的三氯化磷。为保证三氯化磷蒸气冷凝,应在水槽g中加入____________________。
⑷三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d、e仪器及装入其中的物质都不能含有水分。为除去氯气中的水分,c可以装入下列物质中的(填字母)_________。
A. 碱石灰 B. 浓硫酸 C. 无水氯化钙
⑸氯气和白磷反应放出大量的热,为使曲颈甑d不致因局部过热而炸裂,实验开始前应在曲颈甑的底部放少量_______________。
⑹实验室的白磷保存于水中,取出白磷后用滤纸吸干表面水分,浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。已知水与酒精互溶,酒精与乙醚互溶,用上述方法可除去水分的原因是______________________________________________________________。
⑺为防止氯气污染空气,装置末端导出的气体最好用_______(填字母)进行净化处理。
A. NaOH溶液 B. Ca(OH)2溶液 C. 饱和食盐水
四.(本题包括2小题,共20分)
27.(10分)山区某工厂,在山坡坑道的仓库里贮有氯气钢瓶。某一天,一只贮有氯气的钢瓶损坏,造成氯气泄漏,在场工人采取以下措施。请选择填充并简述理由。
(1)处理钢瓶的正确方法是__________________________。
(A)把钢瓶推到山坡下小河里 (B)把钢瓶丢到深坑里,用石灰填埋 (C)把钢瓶扔到农田里
简述理由_____________________________________________________________________。
(2)钢瓶处理后,工人转移的方法正确的是___________________。
(A)转移到坡上 (B)转移到坡下
简述理由____________________________________________________________________。
28. (10分) 在盛有淀粉KI溶液(用H2SO4酸化)的试管中,滴加少量的次氯酸钠溶液,会立即看到溶液变在蓝色,这是因为___________________________________________________的缘故,相应的离子方程式为________________________________________________。在盛有淀粉和碘形成的蓝色溶液中,滴加Na2SO3溶液,又发现蓝色溶液逐渐消失,这是因为_______________________________________________________的缘故,相应的离子方程式为_________________________________________________________。对比上述两组实验所得结果,可得出ClO-、I2、SO42-的氧化性由强到弱的顺序为_________________________________。
五.(本题包括2小题,共20分)
29.(10分)锗是ⅣA族元素,它的单质晶体是一种良好的半导体材料,被广泛地应用在电子工业上。锗可以从燃烧的烟道灰中提取,其过程可表示如下:
烟道灰中所含锗 锗 的 锗 纯净的锗
的氧化物(高价) 氯化物 酸 的氧化物
根据以上实验过程,写出各步反应的化学方程式:
①_______________________________________;
②_______________________________________;
③_______________________________________;
④_______________________________________。
30.(10分)酸雨是由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4和HNO3(主要是H2SO4)随雨水降落而形成的。为防止污染,硫酸厂用氨水来吸收二氧化硫,离子方程式为_____________________________________;硝酸厂可用烧碱溶液来吸收氮的氧化物,如NO2被烧碱吸收生成NaNO2和NaNO3,离子方程式为_____________________________;也可用氨的催化还原法把氮的氧化物变成氮气,还原1体积NOx需要________体积氨气。对酸雨地区的治理,目前一种比较有效的方法是用直升飞机喷撒白垩粉,降解酸雨污染,其离子方程式是(分别写出与硫酸与硝酸的反应)_________________________________________
____________________________________________________________________________。
六.(本题包括2小题,共19分)
31.(9分)某硫酸厂每天用含FeS260%的硫铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%。每天能生产98%的硫酸多少吨?
32.(10分)为了测定某铜银合金的成分,将30.0 g该合金溶于80 mL13.5mol/L的浓HNO3中,待合金完全溶解后,收集到气体6.72 L(标准状况),并测得溶液的c(H+)=1mol/L。假设反应后溶液的体积仍为80mL,试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
参考答案
1?C
2.D [解题思路] 本题要求学生综合运用物质物理性质、化学性质解决现实生活中的问题。强调理论与实际相结合,学以致用,侧重考查学科“双基”解决实际问题
铜锌合金通常说的是黄铜,颜色和黄金相似,其密度明显小于黄金,而放人HNO3或HCl中,黄铜会发生反应而黄金不会发生反应。故区别其真伪可用A、B、C,
3. A 4. B 5.AC
6.D [解题思路]氯水是一种由多种分子(Cl2、H2O、HClO)和多种离子(H+、Cl-、ClO-等)组成的混合物,在涉及氯水的化学反应时,既要考虑分子具有的性质,又要考虑离子具有的性质。Cl2溶于水会部分发生下列反应:Cl2+H2O=HCl+HClO。HClO可使石蕊氧化褪色;HCl跟AgNO3反应: AgNO3+HCl=AgCl↓+HNO3;Cl2氧化Na2SO3:Cl2+Na2SO3+H2O=2HCl+Na2SO4;Cl2不能跟AlCl3反应。
7. C 8. C 9. D 10.C
11.C [解题思路] 本题较复杂,必须逐个分析比较,获得题解
(1)2Na+Cl22NaCl (2)Mg+Cl2MgCl2
(3)2A1+3Cl22AlCl3 (4)2Fe十3Cl22FeCl3
为了便于比较,将(3)、(4)改写为:
Al十Cl2AlCl3 Fe十Cl2FeCl3
假设反应掉的Cl2的质量为71g,即在横坐标上取一点向纵坐标作垂线,则需要钠、镁、铝、铁的质量分别为:
WNa=2×23=46(g) WMg=24(g)
WAl=×27=18(g) WFe=×56=37.3(g)
由此可知,d为(1)反应,c为(4)反应,b为(2)反应,a为(3)反应,故答案为C。
12. AD 13.B
14.C [解题思路] 此题考查的是氧化还原反应离子方程式的配平方法。由得失电子数目守恒可配平NO3-、Zn、NH3、Zn(OH)42-的系数分别为1、4、1、4,再由电荷守恒可知OH-的系数为7,最后由原子守恒得H2O的系数为6。
15.C 16.?AC 17. CD
18.B [解题思路]据反应3NO2+H2O=2HNO3+NO知,nmL溶于水可得n/3mL的NO,所以共有NO为(m+)mL通入mmLO2后发生反应
4NO + 3O2 + 2H2O = 4HNO3
4 3
(m+)mL m mL
因为n>m,所以NO过量,共过量m+-=-=(n-m)/3mL
19.C 20.AD 21.B 22.BC 23.D
24.D [解题思路]通过碱石灰时,CO2和H2O都能被其吸收,体积变小,说明至少含其中一种;通过碱石灰后的气体只能为H2、CO中的一种或两种,通过热的氧化铜后的气体能使无水硫酸铜变蓝说明原气体中一定有H2,能使石灰水变浑浊,说明一定有CO。
25.(10分)沸腾炉(1分);增大接触面积(1分);提高反应物利用率(1分);砷、硒化合物(1分);防止催化剂中毒(1分);98.3%(1分);防止形成酸雾,有利于SO3的吸收(2分);N2、SO2、O2等(1分);SO2(1分)
26.(9分)⑴浓盐酸(1分)、MnO2 (1分) ⑵b (1分) ⑶冷水(1分) ⑷C (1分) ⑸干燥的沙子(1分) ⑹白磷上残留的水溶解在酒精中,残留的酒精又溶解在乙醚中(2分) ⑺A (1分)
27. (10分) (1)B(2分) 因为泄漏的氯气会与石灰发生反应可防止氯气扩散(3分)
(2)A (2分) 因为氯气密度比空气大,易向坡下扩散,在坡上相对较安全 (3分)
28.(10分)I-被ClO-氧化为I2,I2遇淀粉变蓝色(2分);ClO-+2I-+2H+==Cl-+I2+H2O(2分);I2被SO32-还原为I-(2分);I2+SO32-+H2O=2H++SO42-+2I-(2分);ClO->I2>SO42-(2分)
29. (10分)①GeO2+4HCl==GeCl4+2H2O(2分) ②GeCl4+3H2O==H2GeO3+4HCl(2分)
③H2GeO3GeO2+H2O(2分) ④GeO2+2H2Ge+2H2O(2分)
30.(10分)2NH3·H2O+SO2=2NH4++SO32-+H2O(2分);2NO2+2OH-=NO3-+NO2-+H2O(2分);2x/3(2分);CaCO3+2H++SO42-=CaSO4+CO2↑+H2O(2分);CaCO3+2H+=Ca2++CO2↑+H2O(2分)。
31.(9分)[解题思路] 沸腾炉中损失5%的硫,SO2转化率为90%这些都可转化为S元素的损失,进而转化为FeS2的损失。所以设生产98%的硫酸x吨。则由关系式:
FeS2————————————2H2SO4 (2分)
120 2×98
500t×60%×(1-5%) ×90% x×98% (4分)
即:120t:[500×60%×(1-5%) ×90%]=2×98: x×98%
解得 x=427.5吨 (3分)
32.(10分)[解题思路](1)硝酸被还原后的产物是NO或N02,因为1 molHN03被还原得到1molNO或N02,因此产生气体的物质的量即是被还原的HNO3的物质的量==0.3mol。(5分)
(2)因为反应后c(H+)=1mol/L ,说明硝酸过量。参加反应的硝酸为
13.5mol/L×0.080L-1mol/L×0.080L=1mol。
设合金中Ag的物质的量为x,Cu的物质的量为y。
根据质量为30.0g,可建立方程式:
108g/mol·x+64g/mol·y=30.0g……①。
1mol参加反应的HNO3中有0.3mol被还原,有0.7mol起酸的作用生成硝酸盐,据此有
x十2y=0.7mol……②。
联立①、②式,解得:x=0.1mol,y=0.3mol。
w(Ag)=×100%=36.0%。(5分)
21世纪教育网
本试卷由21世纪教育网http://www.21cnjy.com/供稿,下载更多教学资源,请登录21世纪教育网
同课章节目录
