化学:1.3《化学反应热的计算》教案(新人教版选修4)
文档属性
| 名称 | 化学:1.3《化学反应热的计算》教案(新人教版选修4) |

|
|
| 格式 | rar | ||
| 文件大小 | 112.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-31 13:30:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
教 案
课题:第三节 化学反应热的计算(一) 授课班级
课 时 1
教学目的 知识与技能 理解盖斯定律
过程与方法 通过运用盖斯定律求有关的反应热,进一步理解反应热的概念
情感态度价值观 通过实例感受盖斯定律,并以此说明盖斯定律在科学研究中的重要作用
重 点 盖斯定律
难 点 盖斯定律的涵义
知识结构与板书设计 第三节 化学反应热计算一、盖斯定律1、 盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。2、盖斯定律在生产和科学研究中有很重要的意义
教学过程
教学步骤、内容 教学方法、手段、师生活动
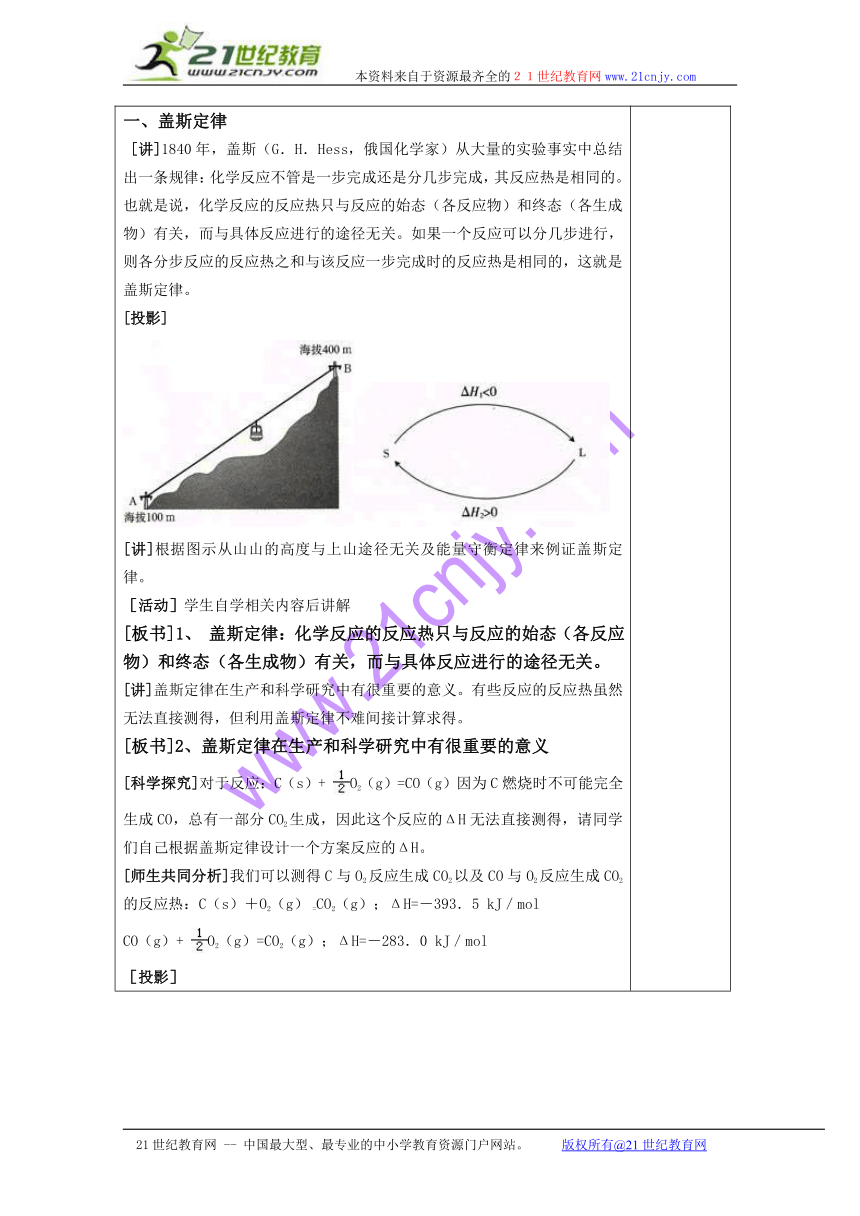
[引入]在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,也需要反应热计算,为方便反应热计算,我们来学习盖斯定律。[板书] 第三节 化学反应热计算一、盖斯定律 [讲]1840年,盖斯(G.H.Hess,俄国化学家)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这就是盖斯定律。[投影] [讲]根据图示从山山的高度与上山途径无关及能量守衡定律来例证盖斯定律。[活动]学生自学相关内容后讲解[板书]1、 盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。[讲]盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但利用盖斯定律不难间接计算求得。[板书]2、盖斯定律在生产和科学研究中有很重要的意义[科学探究]对于反应:C(s)+ O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案反应的ΔH。[师生共同分析]我们可以测得C与O2反应生成CO2以及CO与O2反应生成CO2的反应热:C(s)+O2(g) =CO2(g);ΔH=-393.5 kJ/molCO(g)+ O2(g)=CO2(g);ΔH=-283.0 kJ/mol[投影][讲]根据盖斯定律.可以很容易求算出C(s)+ O2(g)=CO(g)的ΔH。∵ΔH1=ΔH2+ΔH3∴ΔH2=ΔH1-ΔH3=-393.5kJ/mol-(-283.0kJ/mol)=-110.5 kJ/mol即:C(s)+ O2(g)=CO(g)的ΔH=-110.5 kJ/mol [投影][点击试题]例1、通过计算求的氢气的燃烧热:可以通过两种途径来完成如上图表:已知:H2(g)+O2(g)=H2O(g);△H1=-241.8kJ/molH2O(g)=H2O(l);△H2=-44.0kJ/mol根据盖斯定律,则△H=△H1+△H2=-241.8kJ/mol+(-44.0kJ/mol)=-285.8kJ/mol[点击试题]例2、实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH1=-890.3kJ·mol-1 (1)C(石墨)+O2(g)=CO2(g);ΔH2=-393·5kJ·mol-1 (2)H2(g)+O2(g)=H2O(l);ΔH3=-285.8kJ·mol-1 (3)C(石墨)+2H2(g)=CH4(g);ΔH4 (4)[投影][讲]利用盖斯定律时,可以通过已知反应经过简单的代数运算得到所求反应,以此来算得所求反应的热效应。也可以设计一个途径,使反应物经过一些中间步骤最后回复到产物:因为反应式(1),(2),(3)和(4)之间有以下关系: (2)+(3)×2-(1)=(4)所以 ΔH4=ΔH2+2ΔH3-ΔH1=-393.5 kJ·mol-1+2(-285.8) kJ·mol-1-(-890.3) kJ·mol-1=-74.8kJ·mol-1[小结]可间接计算求得某些无法直接测得的反应热,如 C 与O2 生成 CO 的△H。[点击试题]例3、物质的生成热可定义为由稳定单质生成1 mol物质所放出的热量,如二氧化碳气体的生成热就是的反应热.已知下列几种物质的生成热:葡萄糖(C6H12O6):1259kJ/mol H2O (1):285.8kJ/mol CO2:393.5kJ/mol试计算1kg葡萄糖在人体内完全氧化生成二氧化碳气体和液态水,最多可提供的能量.先求出1 mol 氧化时放出的热量.即:;△H=?根据已知条件得知[随堂练习]已知下列热化学方程式:①;△H=-25kJ/mol②;△H=-47kJ/mol③;△H=+19kJ/mol写出FeO(s)与CO反应生成Fe(s)和的热化学方程式:____________________________.
教学回顾:
教 案
课题:第三节 化学反应热的计算(二) ---典型题专题 授课班级
课 时 1
教学目的 知识与技能 1、理解反应热2、了解反应热的计算
过程与方法 综合运用反应热和盖斯定律的知识解决能量变化的实际问题
情感态度价值观 通过计算某些物质燃烧时的△H数值,进一步认识煤、石油、天然气是当今世界上最重要的化石燃料,唤起学生对资源利用和环境保护的意识和责任感
重 点 反应热的计算
难 点 盖斯定律的应用
教学过程
教学步骤、内容 教学方法、手段、师生活动
题型一: 已知一定量的物质参加反应放出的热量,计算反应热,写出其热化学反应方程式。例1、将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。解析:0.3mol乙硼烷完全燃烧生成液态水放出649.5kJ热量,则1mol乙硼烷完全燃烧放出的热量为:因此乙硼烷燃烧的热化学反应方程式为:。由于1mol水汽化需吸热44kJ,则3mol液态水全部汽化应吸热:,所以1mol乙硼烷完全燃烧产生气态水时放热:,则11.2L(标准状况)乙硼烷完全燃烧产生气态水放出热量是:。[随堂练习]已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是 A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-2b kJ / molB. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l); ΔH=2b kJ / molC. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-4b kJ / molD. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=b kJ / mol题型二:利用盖斯定律求反应热例2、科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。(1)(s,白磷)+ (2) 则白磷转化为红磷的热化学方程式_____________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”)。 解析:依题意求:;可设计如下反应过程:;据盖斯定律有=(-2983.2+4×738.5)kJ/mol=-29.2kJ/mol,即;。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。[随堂练习]由金红石TiO2制取单质Ti,涉及到的步骤为::TiO2TiCl4Ti 已知:① Cs+O2g=CO2g; H=3935 kJ·mol1 ② 2COg+O2g=2CO2g; H=566 kJ·mol1 ③ TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1 则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H= 。 题型三:根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。例3、已知下列两个热化学方程式:H2 (g) + 1/2 O2(g) == H2O (l) H=285.8 kJ·mol1 C3H8(g)+5O2(g) == 3 CO2(g) +4H2O (l) H=2220.0 kJ·mol1实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3847kJ,则混合气体中氢气和丙烷的体积比是_______,两者放出的热量之比约为_____A、1:3 B、3:1 C、1:4 D、5:13解法一:十字交叉法解法二:估算排除法答案:BD[随堂练习]已知:;;欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为A. 2:3.25 B. 12:3.25 C. 1:1 D. 393.5:241.8解析:由题意可列得方程 答案: B题型四:反应热大小比较 例4、在同温同压下,下列各组热化学方程式中,的是A. B. C. D. 解析:反应热数值的大小与反应物、生成物的种类有关,与反应物物质的量的多少有关,与反应物和生成物的聚集状态有关,还与反应时的外界条件有关。A选项:生成物的状态不同,由于从气态水到液态水会放热,所以生成液态水比生成气态水放出的热多即;B选项:反应物的状态不同,由于从固态硫到气态硫要吸热,所以气态硫燃烧放出的热量比固态硫燃烧放出的热量多,即;C选项:生成物的种类不同,由于CO与O2反应生成CO2要放出热量,故;D选项:反应物的物质的量不同,前一反应的物质的量是后一反应的物质的量的2倍,故,即。答案选A、C。[随堂练习]氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:H2(g)+1/2O2(g)=H2O(l); △H=-285.8kJ/molCO(g)+1/2O2(g)=CO2(g); △H=-283.0kJ/molC8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=-5518kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-89.3kJ/mol相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是A H2(g) B CO(g) C C8H18(l) D CH4(g)题型五:利用键能计算反应热
方法:ΔH=∑E(反应物)-∑E(生成物),即反应热等于反应物的键能总和跟生成物的键能总和之差。常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能常用E表示,单位是kJ/mol。
例5.CH3—CH3→CH2=CH2+H2;有关化学键的键能如下。
化学键 C-H C=C C-C H-H
键能(kJ/mol) 414.4 615.3 347.4 435.3试计算该反应的反应热
解析:ΔH =[6E(C-H)+E(C-C)]-[E(C=C)+4E(C-H)+E(H-H)]=(6×414.4+347.4)kJ/mol-(615.3+4×414.4+435.3)kJ/mol=+125.6 kJ/mol 这表明,上述反应是吸热的,吸收的热量为125.6 kJ/mol。 (2005全国理综Ⅰ·13).解析:以上各式中化学计量数及物质状态标注都正确;该反应放热,△H应为负值;生成1mol二氧化碳气体,放出热量 bkJ,则又生成4mol二氧化碳气体,放出热量4bkJ 。 答案:A。2005广东22·4答案:80 kJ·mol1
教学回顾:
21世纪教育网
www.
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
教 案
课题:第三节 化学反应热的计算(一) 授课班级
课 时 1
教学目的 知识与技能 理解盖斯定律
过程与方法 通过运用盖斯定律求有关的反应热,进一步理解反应热的概念
情感态度价值观 通过实例感受盖斯定律,并以此说明盖斯定律在科学研究中的重要作用
重 点 盖斯定律
难 点 盖斯定律的涵义
知识结构与板书设计 第三节 化学反应热计算一、盖斯定律1、 盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。2、盖斯定律在生产和科学研究中有很重要的意义
教学过程
教学步骤、内容 教学方法、手段、师生活动
[引入]在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,也需要反应热计算,为方便反应热计算,我们来学习盖斯定律。[板书] 第三节 化学反应热计算一、盖斯定律 [讲]1840年,盖斯(G.H.Hess,俄国化学家)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这就是盖斯定律。[投影] [讲]根据图示从山山的高度与上山途径无关及能量守衡定律来例证盖斯定律。[活动]学生自学相关内容后讲解[板书]1、 盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。[讲]盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但利用盖斯定律不难间接计算求得。[板书]2、盖斯定律在生产和科学研究中有很重要的意义[科学探究]对于反应:C(s)+ O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案反应的ΔH。[师生共同分析]我们可以测得C与O2反应生成CO2以及CO与O2反应生成CO2的反应热:C(s)+O2(g) =CO2(g);ΔH=-393.5 kJ/molCO(g)+ O2(g)=CO2(g);ΔH=-283.0 kJ/mol[投影][讲]根据盖斯定律.可以很容易求算出C(s)+ O2(g)=CO(g)的ΔH。∵ΔH1=ΔH2+ΔH3∴ΔH2=ΔH1-ΔH3=-393.5kJ/mol-(-283.0kJ/mol)=-110.5 kJ/mol即:C(s)+ O2(g)=CO(g)的ΔH=-110.5 kJ/mol [投影][点击试题]例1、通过计算求的氢气的燃烧热:可以通过两种途径来完成如上图表:已知:H2(g)+O2(g)=H2O(g);△H1=-241.8kJ/molH2O(g)=H2O(l);△H2=-44.0kJ/mol根据盖斯定律,则△H=△H1+△H2=-241.8kJ/mol+(-44.0kJ/mol)=-285.8kJ/mol[点击试题]例2、实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH1=-890.3kJ·mol-1 (1)C(石墨)+O2(g)=CO2(g);ΔH2=-393·5kJ·mol-1 (2)H2(g)+O2(g)=H2O(l);ΔH3=-285.8kJ·mol-1 (3)C(石墨)+2H2(g)=CH4(g);ΔH4 (4)[投影][讲]利用盖斯定律时,可以通过已知反应经过简单的代数运算得到所求反应,以此来算得所求反应的热效应。也可以设计一个途径,使反应物经过一些中间步骤最后回复到产物:因为反应式(1),(2),(3)和(4)之间有以下关系: (2)+(3)×2-(1)=(4)所以 ΔH4=ΔH2+2ΔH3-ΔH1=-393.5 kJ·mol-1+2(-285.8) kJ·mol-1-(-890.3) kJ·mol-1=-74.8kJ·mol-1[小结]可间接计算求得某些无法直接测得的反应热,如 C 与O2 生成 CO 的△H。[点击试题]例3、物质的生成热可定义为由稳定单质生成1 mol物质所放出的热量,如二氧化碳气体的生成热就是的反应热.已知下列几种物质的生成热:葡萄糖(C6H12O6):1259kJ/mol H2O (1):285.8kJ/mol CO2:393.5kJ/mol试计算1kg葡萄糖在人体内完全氧化生成二氧化碳气体和液态水,最多可提供的能量.先求出1 mol 氧化时放出的热量.即:;△H=?根据已知条件得知[随堂练习]已知下列热化学方程式:①;△H=-25kJ/mol②;△H=-47kJ/mol③;△H=+19kJ/mol写出FeO(s)与CO反应生成Fe(s)和的热化学方程式:____________________________.
教学回顾:
教 案
课题:第三节 化学反应热的计算(二) ---典型题专题 授课班级
课 时 1
教学目的 知识与技能 1、理解反应热2、了解反应热的计算
过程与方法 综合运用反应热和盖斯定律的知识解决能量变化的实际问题
情感态度价值观 通过计算某些物质燃烧时的△H数值,进一步认识煤、石油、天然气是当今世界上最重要的化石燃料,唤起学生对资源利用和环境保护的意识和责任感
重 点 反应热的计算
难 点 盖斯定律的应用
教学过程
教学步骤、内容 教学方法、手段、师生活动
题型一: 已知一定量的物质参加反应放出的热量,计算反应热,写出其热化学反应方程式。例1、将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。解析:0.3mol乙硼烷完全燃烧生成液态水放出649.5kJ热量,则1mol乙硼烷完全燃烧放出的热量为:因此乙硼烷燃烧的热化学反应方程式为:。由于1mol水汽化需吸热44kJ,则3mol液态水全部汽化应吸热:,所以1mol乙硼烷完全燃烧产生气态水时放热:,则11.2L(标准状况)乙硼烷完全燃烧产生气态水放出热量是:。[随堂练习]已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是 A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-2b kJ / molB. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l); ΔH=2b kJ / molC. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-4b kJ / molD. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=b kJ / mol题型二:利用盖斯定律求反应热例2、科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。(1)(s,白磷)+ (2) 则白磷转化为红磷的热化学方程式_____________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”)。 解析:依题意求:;可设计如下反应过程:;据盖斯定律有=(-2983.2+4×738.5)kJ/mol=-29.2kJ/mol,即;。白磷转化为红磷是放热反应,稳定性比红磷低(能量越低越稳定)。[随堂练习]由金红石TiO2制取单质Ti,涉及到的步骤为::TiO2TiCl4Ti 已知:① Cs+O2g=CO2g; H=3935 kJ·mol1 ② 2COg+O2g=2CO2g; H=566 kJ·mol1 ③ TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1 则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H= 。 题型三:根据一定量的物质参加反应放出的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。例3、已知下列两个热化学方程式:H2 (g) + 1/2 O2(g) == H2O (l) H=285.8 kJ·mol1 C3H8(g)+5O2(g) == 3 CO2(g) +4H2O (l) H=2220.0 kJ·mol1实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3847kJ,则混合气体中氢气和丙烷的体积比是_______,两者放出的热量之比约为_____A、1:3 B、3:1 C、1:4 D、5:13解法一:十字交叉法解法二:估算排除法答案:BD[随堂练习]已知:;;欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为A. 2:3.25 B. 12:3.25 C. 1:1 D. 393.5:241.8解析:由题意可列得方程 答案: B题型四:反应热大小比较 例4、在同温同压下,下列各组热化学方程式中,的是A. B. C. D. 解析:反应热数值的大小与反应物、生成物的种类有关,与反应物物质的量的多少有关,与反应物和生成物的聚集状态有关,还与反应时的外界条件有关。A选项:生成物的状态不同,由于从气态水到液态水会放热,所以生成液态水比生成气态水放出的热多即;B选项:反应物的状态不同,由于从固态硫到气态硫要吸热,所以气态硫燃烧放出的热量比固态硫燃烧放出的热量多,即;C选项:生成物的种类不同,由于CO与O2反应生成CO2要放出热量,故;D选项:反应物的物质的量不同,前一反应的物质的量是后一反应的物质的量的2倍,故,即。答案选A、C。[随堂练习]氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:H2(g)+1/2O2(g)=H2O(l); △H=-285.8kJ/molCO(g)+1/2O2(g)=CO2(g); △H=-283.0kJ/molC8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=-5518kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-89.3kJ/mol相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是A H2(g) B CO(g) C C8H18(l) D CH4(g)题型五:利用键能计算反应热
方法:ΔH=∑E(反应物)-∑E(生成物),即反应热等于反应物的键能总和跟生成物的键能总和之差。常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能常用E表示,单位是kJ/mol。
例5.CH3—CH3→CH2=CH2+H2;有关化学键的键能如下。
化学键 C-H C=C C-C H-H
键能(kJ/mol) 414.4 615.3 347.4 435.3试计算该反应的反应热
解析:ΔH =[6E(C-H)+E(C-C)]-[E(C=C)+4E(C-H)+E(H-H)]=(6×414.4+347.4)kJ/mol-(615.3+4×414.4+435.3)kJ/mol=+125.6 kJ/mol 这表明,上述反应是吸热的,吸收的热量为125.6 kJ/mol。 (2005全国理综Ⅰ·13).解析:以上各式中化学计量数及物质状态标注都正确;该反应放热,△H应为负值;生成1mol二氧化碳气体,放出热量 bkJ,则又生成4mol二氧化碳气体,放出热量4bkJ 。 答案:A。2005广东22·4答案:80 kJ·mol1
教学回顾:
21世纪教育网
www.
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
