第一节 共价键
图片预览




文档简介
教 案
课题:第二章 第一节 共价键(1) 授课班级
课 时
教学目的 知识与技能 1、复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程。2、知道共价键的主要类型δ键和π键。3、说出δ键和π键的明显差别和一般规律。
过程与方法 学习抽象概念的方法:可以运用类比、归纳、判断、推理的方法,注意各概念的区别与联系,熟悉掌握各知识点的共性和差异性。
情感态度价值观 使学生感受到:在分子水平上进一步形成有关物质结构的基本观念,能从物质结构决定性质的视角解释分子的某些性质,并预测物质的有关性质,体验科学的魅力,进一步形成科学的价值观。
重 点 σ键和Π键的特征和性质
难 点 σ键和Π键的特征
知识结构与板书设计 第二章 分子结构与性质 第一节 共价键一、共价键1、共价键的形成条件:(1) 两原子电负性相同或相近(2) 一般成键原子有未成对电子(3) 成键原子的原子轨道在空间上发生重叠2、共价键的本质:成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子云密度增加,体系能量降低3、共价键的类型(1)σ键:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。如H-H键。类型:s—sσ、s—pσ、p—pσ等特点:肩并肩、两块组成、镜像对称、容易断裂。(2)π键:由两个原子的p电子“肩并肩”重叠形成。(3)价键轨道:由原子轨道相互重叠形成的σ键和π键 (4)判断共价键类型规律:共价单键是σ键;而共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键组成4、共价键的特征(1)饱和性 (2)方向性
教学过程
教学步骤、内容 教学方法、手段、师生活动
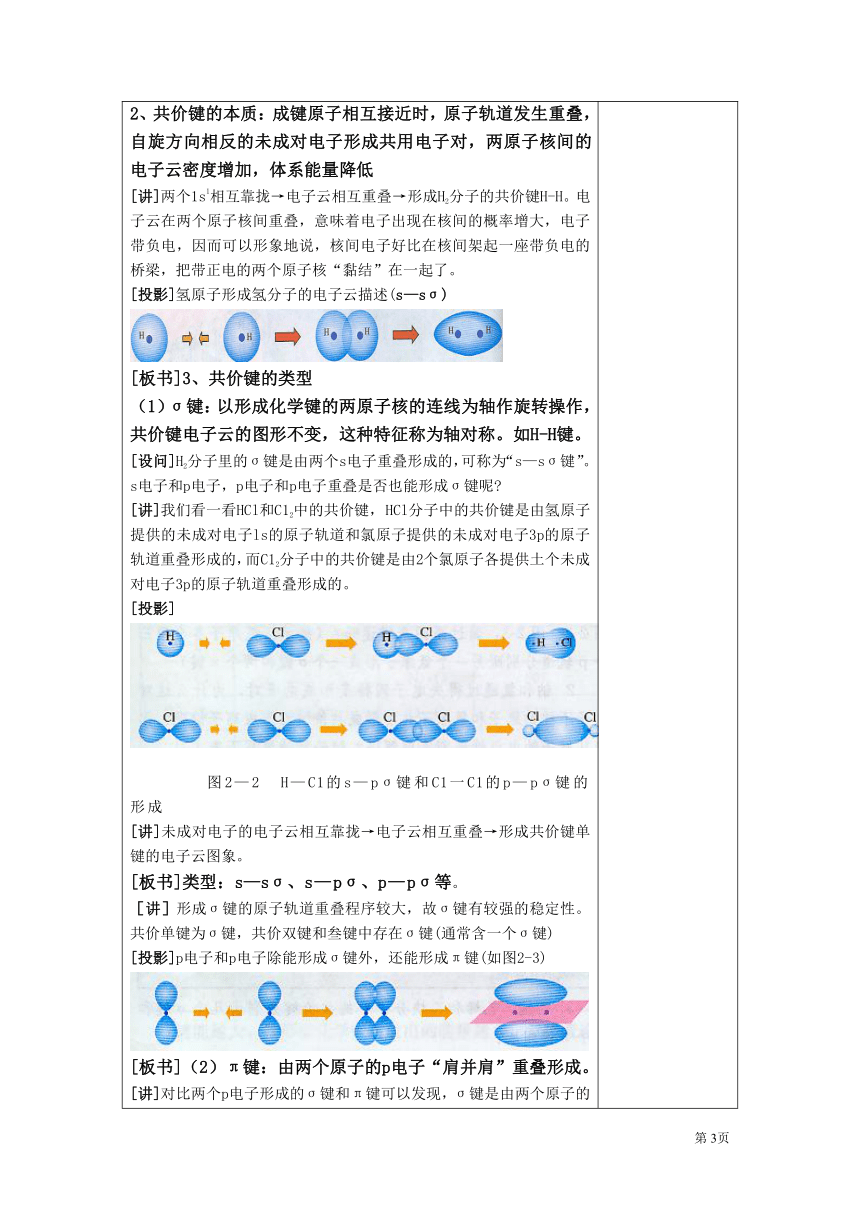
[复习]1、必修中学过共价键概念。 2、原子轨道、电子云概念。[过渡]通过已学过的知识,我们知道元素原子形成共价键时,共用电子对,因为电子在核外一定空间运动,所以电子云要发生重叠,它们又是通过怎样方式重叠,形成共价键的呢?[板书] 第二章 分子结构与性质第一节 共价键[随堂练习]共价键是常见化学键之一,它的本质是在原子之间形成共用电子对你能用电子式表示H2、HCl、C12分子的形成过程吗 [投影]HCl的形成过程:[讲]按共价键的共用电子对理论,不可能有H3。、H2Cl和Cl3分子,这表明共价键具有饱和性。我们学过电子云和原子轨道。如何用电子云和原子轨道的概念来进一步理解共价键呢用电子云描述氢原子形成氢分子的过程如图2—l所示[探究]两个成键原子为什么能通过共用电子对相结合呢?[板书]一、共价键[投影][板书]1、共价键的形成条件:(1) 两原子电负性相同或相近(2) 一般成键原子有未成对电子(3) 成键原子的原子轨道在空间上发生重叠2、共价键的本质:成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子云密度增加,体系能量降低[讲]两个1s1相互靠拢→电子云相互重叠→形成H2分子的共价键H-H。电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象地说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。[投影]氢原子形成氢分子的电子云描述(s—sσ)[板书]3、共价键的类型(1)σ键:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。如H-H键。[设问]H2分子里的σ键是由两个s电子重叠形成的,可称为“s—sσ键”。s电子和p电子,p电子和p电子重叠是否也能形成σ键呢 [讲]我们看一看HCl和C12中的共价键, HCl分子中的共价键是由氢原子提供的未成对电子ls的原子轨道和氯原子提供的未成对电子3p的原子轨道重叠形成的,而C12分子中的共价键是由2个氯原子各提供土个未成对电子3p的原子轨道重叠形成的。[投影] 图2—2 H—C1的s—pσ键和C1一C1的p—pσ键的形成[讲]未成对电子的电子云相互靠拢→电子云相互重叠→形成共价键单键的电子云图象。[板书]类型:s—sσ、s—pσ、p—pσ等。[讲]形成σ键的原子轨道重叠程序较大,故σ键有较强的稳定性。共价单键为σ键,共价双键和叁键中存在σ键(通常含一个σ键)[投影]p电子和p电子除能形成σ键外,还能形成π键(如图2-3)[板书](2)π键:由两个原子的p电子“肩并肩”重叠形成。[讲]对比两个p电子形成的σ键和π键可以发现,σ键是由两个原子的p电子“头碰头”重叠形成的;而π键是由两个原子的p电子“肩并肩”重叠形成的π键的电子云形状与σ键的电子云形状有明显差别:每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征称为镜像对称。π键与σ键不同,σ键的强度较大,π键不如σ键牢固,比较容易断裂。因而含有π键的化合物与只有σ键的化合物的化学性质不同,如我们熟悉的乙烷和乙烯的性质不同。[板书] 特点:肩并肩、两块组成、镜像对称、容易断裂。[讲] π键通常存在于双键或叁键中[讲]以上由原子轨道相互重叠形成的σ键和π键总称价键轨道,是分子结构的价键理论中最基本的组成部分。[板书](3)价键轨道:由原子轨道相互重叠形成的σ键和π键 (4)判断共价键类型规律:共价单键是σ键;而共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键组成[科学探究]1、已知氮分子的共价键是三键(N三N),你能模仿图2—1、图2—2、图2—3,通过画图来描述吗 (提示:氮原子各自用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键)2、钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢 你能从原子的电负性差别来理解吗 讨论后请填表。3、乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?[交流汇报] 1、 2、原子Na ClH ClC O电负性0.9 3.02.1 3.02.5 3.5电负性之差(绝对值)2.10.91.0结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是离子键;而共价键是电负性相差不大的原子之间形成的化学键。3、乙烷:7个σ键 乙烯 :5个σ键一个π键 乙炔:3个σ键两个π键[小结]电子配对理论:如果两个原子之间共用两个电子,一般情况下,这两个电子必须配对才能形成化学键[投影][过]下面,让我们总结一下,共价键都具有哪些特征[板书]4、共价键的特征[讲]按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋方向相反的电子配对成键,这就是共价键的饱和性。H原子、CL原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3等分子。[板书] (1)饱和性[讲]共价键的饱和性决定了共价化合物的分子组成 [讲]共价键形成时,两个叁数与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现概率越多,形成的共价键越牢固。电子所在的原子轨道都是有一定的形状,所以要取得最大重叠,共价键必然有方向性。[板书](2)方向性[讲]同种分子(如HX)中成键原子电子云(原子轨道)重叠程度越大,形成的共价键越牢固,分子结构越稳定。如HX的稳定性:HF>HCl>HBr>HI。[小结]键型项目σ键π键成键方向沿轴方向“头碰头”平行或“肩并肩”电子云形状轴对称镜像对称牢固程度键强度大,不易断裂x键强度较小,容易断裂成键判断规律共价单键全是σ键,共价双键中一个是σ键,另一个是π键;共价叁键中一个σ键,另两个为π键[随堂练习]1、关于乙醇分子的说法正确的是 ( ) A.分子中共含有8个极性键 B.分子中不含非极性键 C.分子中只含σ键 D.分子中含有1个π键(解析)乙醇的结构简式为:CH3CH2OH。共有有8个共价键,其中C—H、C—O、O—H键为极性键,共7个,C—C键为非极性键,由于全为单键,故无π键。 (答案) C(点评) 通过物质的结构式,可以快速有效地判断键的种类及数目,判断成键方式时,需掌握规律:共价单键全是σ键,共价双键中一个是σ键,另一个是π键;共价叁键中一个σ键,另两个为π键。
教学回顾:本节课的内容非常抽象,学生学习和接受都较困难。通过本节课的教学,我觉得要使本节教学成功的关键有三点:(1)布置学生课前预习,使其了解教材的基本内容,找出难点,对不理解的地方做上标记,温习有关基础知识,作为学习新课知识的铺垫。(2)学生的自身体验和探究是非常重要。本节课我以小组合作的学习形式让学生用泡沫自制模型,感悟σ键的形成特点。同时通过课本中的科学探究进一步理解σ键和π键以及和离子键形成的区别。(3)利用多媒体辅助教学,使本来很难理解的过程变得易接受。本节课我用多媒体电脑播放有关电子云轨道重叠成键的过程,既使学生易理解,又提高课堂效率,保证有足够的时间完成本节课的教学任务。使本节课收到很好的教学效果。
教 案
长春市第二实验中学 李佳惠
课题:第二章 第一节 共价键(2) 授课班级
课 时
教学目的 知识与技能 1.认识键能、键长、键角等键参数的概念2.能用键参数――键能、键长、键角说明简单分子的某些性质3.知道等电子原理,结合实例说明“等电子原理的应用
过程与方法
情感态度价值观
重 点 用键能、键长、键角等说明简单分子的某些性质
难 点 键角
知识结构与板书设计 二、键参数—键能、键长与键角1、键能:气态基态原子形成l mol化学键释放的最低能量。通常取正值。键能越大,化学键越稳定。2、键长:形成共价键的两个原子之间的核间距。键长越短,键能越大,共价键越稳定。3、键角:在原子数超过2的分子中,两个共价键间的夹角称为键角。键角决定了分子的空间构型三、等电子原理等电子原理:原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。
教学过程
教学步骤、内容 教学方法、手段、师生活动
[创设问题情境]N2与H2在常温下很难反应,必须在高温下才能发生反应,而F2与H2在冷暗处就能发生化学反应,为什么?[复习]σ键、π键的形成条件及特点。[过渡]今节课我们继续研究共价键的三个参数。[板书]二、键参数—键能、键长与键角[问]电离能概念。[讲]在第一章讨论过原子的电离能,我们知道,原子失去电子要吸收能量。反过来,原子吸引电子,要放出能量。因此,原子形成共价键相互结合,放出能量,由此形成了键能的概念。键能是气态基态原子形成l mol化学键释放的最低能量。例如,形成l mol H—H键释放的最低能量为436.0 kJ,形成1 molN三N键释放的最低能量为946 kJ,这些能量就是相应化学键的键能,通常取正值。[板书]1、键能:气态基态原子形成l mol化学键释放的最低能量。通常取正值。[讲]单位kJ/mol,大家要注意的是,应为气态原子,以确保释放能量最低。[投影]表2-1某些共价键键能[思考与交流]键能大小与化学键稳定性的关系?[讲]键能越大,即形成化学键时放出的能量越多,意味着这个化学键越稳定,越不容易被打断。结构相似的分子中,化学键键能越大,分子越稳定。[板书] 键能越大,化学键越稳定。[讲]键长是衡量共价键稳定性的另一个参数,是形成共价键的两个原子之间的核间距。[板书]2、键长:形成共价键的两个原子之间的核间距。[投影]表2-2 某些共价键的键长[讲]1pm=10-12m。因成键时原子轨道发生重叠,键长小于成键原子的原子半径各。是衡量共价键稳定性的另一个叁数。[投影]资料卡片---共价半径:相同原子的共价键键长的一半称为共价半径。[思考与交流]键长与键能的关系?[板书]键长越短,键能越大,共价键越稳定。[过渡]分子的形状有共价键之间的夹角决定,下面我们学习键角。[板书]3、键角:在原子数超过2的分子中,两个共价键间的夹角称为键角。[讲]在原子数超过2的分子中,两个共价键之间的夹角称为键角。例如,三原子分子CO-的结构式为O=C=O,它的键角为180°,是一种直线形分子;又如,三原子分子H20的H—O—H键角为105°,是一种角形(V形)分子。多原子分子的键角一定,表明共价键具有方向性。键角是描述分子立体结构的重要参数,分子的许多性质都与键角有关。[板书] 键角决定了分子的空间构型[讲]多原子分子中共价键形成的键角,表明共价键具有方向性。[投影小结]分子空间构型键角实 例正四面体109°28′CH4、CCl4、(NH4+)60°白磷:P4平面型120°苯、乙烯、SO3、BF3等三角锥型107°18′NH3折线型104°30′H2O直线型180°CO2、CS2、CH≡CH[思考与交流]1、试利用表2—l的数据进行计算,1 mo1 H2分别跟l molCl2、lmolBr2(蒸气)反应,分别形成2 mo1HCl分子和2molHBr分子,哪一个反应释放的能量更多 如何用计算的结果说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?2.N2、02、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实 3.通过上述例子,你认为键长、键能对分子的化学性质有什么影响?[汇报]1、形成2 mo1HCl释放能量:2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ形成2 mo1HBr释放能量:2×366kJ -(436.0kJ+193.7kJ)= 102.97kJHCl释放能量比HBr释放能量多,因而生成的HCl更稳定,即HBr更容易发生热分解生成相应的单质.2、键能大小是:F-H>O-H>N-H3、键长越长,键能越小,键越易断裂,化学性质越活泼。[投影]表2—3:CO分子和N2分子的某些性质[讲]表2—3数据表明,CO分子和N2分子在许多性质上十分相似,这些相似性,可以归结为它们具有相等的价电子总数,导致它们具有相似的化学结构,由此形成了等电子原理的概念一一原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。[板书]三、等电子原理等电子原理:原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。[讲]等电子体的价电子总数相同,而组成原子核外电子总数不一定相同。[思考]我们学过的等电子物质还有哪些?试举例。[投影小结]常见的等电子体类型实例空间构型二原子10电子的等电子体N2、CO、NO+、C22-、CN-直线型 三原子16电子的等电子体CO2、CS2、N2O、NCO-、NO2+、N3-、NCS-、BeCl2 直线型三原子18电子的等电子体NO2-、O3、SO2 V型四原子24电子的等电子体NO3―、CO32-、BO33-、CS33-、BF3、SO3 平面三角形五原子32电子的等电子体SiF4、CCl4、BF4-、SO42-、PO43-四个σ键,正四面体形七原子48电子的等电子体SF6、PF6-、SiF62-、AlF63-六个σ键,正八面体[讲]等电子体的应用:判断一些简单分子或离子的立体构型 ;利用等电子体在性质上的相似性制造新材料;利用等电子原理针对某物质找等电子体。[自学]科学视野:用质谱仪测定分子结构现代化学常利用质谱仪测定分子的结构。它的基本原理是在质谱仪中使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的分子离子、碎片离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场分析器得到分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的结构。例如,图2—7的纵坐标是相对丰度(与粒子的浓度成正比),横坐标是粒子的质量与电荷之比(m/e),简称质荷比。化学家通过分析得知,m/e=92的峰是甲苯分子的正离子(C6H5CH3+),m/e=91的峰是丢失一个氢原子的的C6H5CH2+ ,m/e=65的峰是分子碎片……因此,化学家便可推测被测物是甲苯。
教学回顾:本节课,主要目的是让学生通过学习键参数的内容来了解影响物质结构的一些因素。教学中,教师不能一味顺从学生的探究欲望,要做教学的向导,当学生提出很难对学生解释清楚的问题时,教师要果断的导向。教师又是学生的指导者,教师的指导直接影响着教学的效果。教学中,有些问题要引导学生提出,有些话要留给学生讲,有些事要让学生做。这节课完成的比较顺利,从学生的精神面貌可以看出他们对键参数非常感兴趣而且对自己的表现很满意,享受到了探究学习的乐趣。老师作为辅导者,为学生提供自主学习的机会,通过提问、总结、讨论、归纳等教学活动,使每个学生的个性都得以充分的展现。课后有学生说:“我知道怎样学化学了,得把自己想象成微粒那么小,进入物质里面,去感受物质间的变化。” 新课程需要教师在教学中重新寻找自己的位置,设计出以学生为主体的教学过程。教师怎样才能起到设计者、指导者,乃至于学生的助手作用?是需要教师更新教育理念,痛苦洗脑。
PAGE
第1页
课题:第二章 第一节 共价键(1) 授课班级
课 时
教学目的 知识与技能 1、复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程。2、知道共价键的主要类型δ键和π键。3、说出δ键和π键的明显差别和一般规律。
过程与方法 学习抽象概念的方法:可以运用类比、归纳、判断、推理的方法,注意各概念的区别与联系,熟悉掌握各知识点的共性和差异性。
情感态度价值观 使学生感受到:在分子水平上进一步形成有关物质结构的基本观念,能从物质结构决定性质的视角解释分子的某些性质,并预测物质的有关性质,体验科学的魅力,进一步形成科学的价值观。
重 点 σ键和Π键的特征和性质
难 点 σ键和Π键的特征
知识结构与板书设计 第二章 分子结构与性质 第一节 共价键一、共价键1、共价键的形成条件:(1) 两原子电负性相同或相近(2) 一般成键原子有未成对电子(3) 成键原子的原子轨道在空间上发生重叠2、共价键的本质:成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子云密度增加,体系能量降低3、共价键的类型(1)σ键:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。如H-H键。类型:s—sσ、s—pσ、p—pσ等特点:肩并肩、两块组成、镜像对称、容易断裂。(2)π键:由两个原子的p电子“肩并肩”重叠形成。(3)价键轨道:由原子轨道相互重叠形成的σ键和π键 (4)判断共价键类型规律:共价单键是σ键;而共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键组成4、共价键的特征(1)饱和性 (2)方向性
教学过程
教学步骤、内容 教学方法、手段、师生活动
[复习]1、必修中学过共价键概念。 2、原子轨道、电子云概念。[过渡]通过已学过的知识,我们知道元素原子形成共价键时,共用电子对,因为电子在核外一定空间运动,所以电子云要发生重叠,它们又是通过怎样方式重叠,形成共价键的呢?[板书] 第二章 分子结构与性质第一节 共价键[随堂练习]共价键是常见化学键之一,它的本质是在原子之间形成共用电子对你能用电子式表示H2、HCl、C12分子的形成过程吗 [投影]HCl的形成过程:[讲]按共价键的共用电子对理论,不可能有H3。、H2Cl和Cl3分子,这表明共价键具有饱和性。我们学过电子云和原子轨道。如何用电子云和原子轨道的概念来进一步理解共价键呢用电子云描述氢原子形成氢分子的过程如图2—l所示[探究]两个成键原子为什么能通过共用电子对相结合呢?[板书]一、共价键[投影][板书]1、共价键的形成条件:(1) 两原子电负性相同或相近(2) 一般成键原子有未成对电子(3) 成键原子的原子轨道在空间上发生重叠2、共价键的本质:成键原子相互接近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子云密度增加,体系能量降低[讲]两个1s1相互靠拢→电子云相互重叠→形成H2分子的共价键H-H。电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象地说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。[投影]氢原子形成氢分子的电子云描述(s—sσ)[板书]3、共价键的类型(1)σ键:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。如H-H键。[设问]H2分子里的σ键是由两个s电子重叠形成的,可称为“s—sσ键”。s电子和p电子,p电子和p电子重叠是否也能形成σ键呢 [讲]我们看一看HCl和C12中的共价键, HCl分子中的共价键是由氢原子提供的未成对电子ls的原子轨道和氯原子提供的未成对电子3p的原子轨道重叠形成的,而C12分子中的共价键是由2个氯原子各提供土个未成对电子3p的原子轨道重叠形成的。[投影] 图2—2 H—C1的s—pσ键和C1一C1的p—pσ键的形成[讲]未成对电子的电子云相互靠拢→电子云相互重叠→形成共价键单键的电子云图象。[板书]类型:s—sσ、s—pσ、p—pσ等。[讲]形成σ键的原子轨道重叠程序较大,故σ键有较强的稳定性。共价单键为σ键,共价双键和叁键中存在σ键(通常含一个σ键)[投影]p电子和p电子除能形成σ键外,还能形成π键(如图2-3)[板书](2)π键:由两个原子的p电子“肩并肩”重叠形成。[讲]对比两个p电子形成的σ键和π键可以发现,σ键是由两个原子的p电子“头碰头”重叠形成的;而π键是由两个原子的p电子“肩并肩”重叠形成的π键的电子云形状与σ键的电子云形状有明显差别:每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征称为镜像对称。π键与σ键不同,σ键的强度较大,π键不如σ键牢固,比较容易断裂。因而含有π键的化合物与只有σ键的化合物的化学性质不同,如我们熟悉的乙烷和乙烯的性质不同。[板书] 特点:肩并肩、两块组成、镜像对称、容易断裂。[讲] π键通常存在于双键或叁键中[讲]以上由原子轨道相互重叠形成的σ键和π键总称价键轨道,是分子结构的价键理论中最基本的组成部分。[板书](3)价键轨道:由原子轨道相互重叠形成的σ键和π键 (4)判断共价键类型规律:共价单键是σ键;而共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键组成[科学探究]1、已知氮分子的共价键是三键(N三N),你能模仿图2—1、图2—2、图2—3,通过画图来描述吗 (提示:氮原子各自用三个p轨道分别跟另一个氮原子形成一个σ键和两个π键)2、钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢 你能从原子的电负性差别来理解吗 讨论后请填表。3、乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?[交流汇报] 1、 2、原子Na ClH ClC O电负性0.9 3.02.1 3.02.5 3.5电负性之差(绝对值)2.10.91.0结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是离子键;而共价键是电负性相差不大的原子之间形成的化学键。3、乙烷:7个σ键 乙烯 :5个σ键一个π键 乙炔:3个σ键两个π键[小结]电子配对理论:如果两个原子之间共用两个电子,一般情况下,这两个电子必须配对才能形成化学键[投影][过]下面,让我们总结一下,共价键都具有哪些特征[板书]4、共价键的特征[讲]按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋方向相反的电子配对成键,这就是共价键的饱和性。H原子、CL原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3等分子。[板书] (1)饱和性[讲]共价键的饱和性决定了共价化合物的分子组成 [讲]共价键形成时,两个叁数与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现概率越多,形成的共价键越牢固。电子所在的原子轨道都是有一定的形状,所以要取得最大重叠,共价键必然有方向性。[板书](2)方向性[讲]同种分子(如HX)中成键原子电子云(原子轨道)重叠程度越大,形成的共价键越牢固,分子结构越稳定。如HX的稳定性:HF>HCl>HBr>HI。[小结]键型项目σ键π键成键方向沿轴方向“头碰头”平行或“肩并肩”电子云形状轴对称镜像对称牢固程度键强度大,不易断裂x键强度较小,容易断裂成键判断规律共价单键全是σ键,共价双键中一个是σ键,另一个是π键;共价叁键中一个σ键,另两个为π键[随堂练习]1、关于乙醇分子的说法正确的是 ( ) A.分子中共含有8个极性键 B.分子中不含非极性键 C.分子中只含σ键 D.分子中含有1个π键(解析)乙醇的结构简式为:CH3CH2OH。共有有8个共价键,其中C—H、C—O、O—H键为极性键,共7个,C—C键为非极性键,由于全为单键,故无π键。 (答案) C(点评) 通过物质的结构式,可以快速有效地判断键的种类及数目,判断成键方式时,需掌握规律:共价单键全是σ键,共价双键中一个是σ键,另一个是π键;共价叁键中一个σ键,另两个为π键。
教学回顾:本节课的内容非常抽象,学生学习和接受都较困难。通过本节课的教学,我觉得要使本节教学成功的关键有三点:(1)布置学生课前预习,使其了解教材的基本内容,找出难点,对不理解的地方做上标记,温习有关基础知识,作为学习新课知识的铺垫。(2)学生的自身体验和探究是非常重要。本节课我以小组合作的学习形式让学生用泡沫自制模型,感悟σ键的形成特点。同时通过课本中的科学探究进一步理解σ键和π键以及和离子键形成的区别。(3)利用多媒体辅助教学,使本来很难理解的过程变得易接受。本节课我用多媒体电脑播放有关电子云轨道重叠成键的过程,既使学生易理解,又提高课堂效率,保证有足够的时间完成本节课的教学任务。使本节课收到很好的教学效果。
教 案
长春市第二实验中学 李佳惠
课题:第二章 第一节 共价键(2) 授课班级
课 时
教学目的 知识与技能 1.认识键能、键长、键角等键参数的概念2.能用键参数――键能、键长、键角说明简单分子的某些性质3.知道等电子原理,结合实例说明“等电子原理的应用
过程与方法
情感态度价值观
重 点 用键能、键长、键角等说明简单分子的某些性质
难 点 键角
知识结构与板书设计 二、键参数—键能、键长与键角1、键能:气态基态原子形成l mol化学键释放的最低能量。通常取正值。键能越大,化学键越稳定。2、键长:形成共价键的两个原子之间的核间距。键长越短,键能越大,共价键越稳定。3、键角:在原子数超过2的分子中,两个共价键间的夹角称为键角。键角决定了分子的空间构型三、等电子原理等电子原理:原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。
教学过程
教学步骤、内容 教学方法、手段、师生活动
[创设问题情境]N2与H2在常温下很难反应,必须在高温下才能发生反应,而F2与H2在冷暗处就能发生化学反应,为什么?[复习]σ键、π键的形成条件及特点。[过渡]今节课我们继续研究共价键的三个参数。[板书]二、键参数—键能、键长与键角[问]电离能概念。[讲]在第一章讨论过原子的电离能,我们知道,原子失去电子要吸收能量。反过来,原子吸引电子,要放出能量。因此,原子形成共价键相互结合,放出能量,由此形成了键能的概念。键能是气态基态原子形成l mol化学键释放的最低能量。例如,形成l mol H—H键释放的最低能量为436.0 kJ,形成1 molN三N键释放的最低能量为946 kJ,这些能量就是相应化学键的键能,通常取正值。[板书]1、键能:气态基态原子形成l mol化学键释放的最低能量。通常取正值。[讲]单位kJ/mol,大家要注意的是,应为气态原子,以确保释放能量最低。[投影]表2-1某些共价键键能[思考与交流]键能大小与化学键稳定性的关系?[讲]键能越大,即形成化学键时放出的能量越多,意味着这个化学键越稳定,越不容易被打断。结构相似的分子中,化学键键能越大,分子越稳定。[板书] 键能越大,化学键越稳定。[讲]键长是衡量共价键稳定性的另一个参数,是形成共价键的两个原子之间的核间距。[板书]2、键长:形成共价键的两个原子之间的核间距。[投影]表2-2 某些共价键的键长[讲]1pm=10-12m。因成键时原子轨道发生重叠,键长小于成键原子的原子半径各。是衡量共价键稳定性的另一个叁数。[投影]资料卡片---共价半径:相同原子的共价键键长的一半称为共价半径。[思考与交流]键长与键能的关系?[板书]键长越短,键能越大,共价键越稳定。[过渡]分子的形状有共价键之间的夹角决定,下面我们学习键角。[板书]3、键角:在原子数超过2的分子中,两个共价键间的夹角称为键角。[讲]在原子数超过2的分子中,两个共价键之间的夹角称为键角。例如,三原子分子CO-的结构式为O=C=O,它的键角为180°,是一种直线形分子;又如,三原子分子H20的H—O—H键角为105°,是一种角形(V形)分子。多原子分子的键角一定,表明共价键具有方向性。键角是描述分子立体结构的重要参数,分子的许多性质都与键角有关。[板书] 键角决定了分子的空间构型[讲]多原子分子中共价键形成的键角,表明共价键具有方向性。[投影小结]分子空间构型键角实 例正四面体109°28′CH4、CCl4、(NH4+)60°白磷:P4平面型120°苯、乙烯、SO3、BF3等三角锥型107°18′NH3折线型104°30′H2O直线型180°CO2、CS2、CH≡CH[思考与交流]1、试利用表2—l的数据进行计算,1 mo1 H2分别跟l molCl2、lmolBr2(蒸气)反应,分别形成2 mo1HCl分子和2molHBr分子,哪一个反应释放的能量更多 如何用计算的结果说明氯化氢分子和溴化氢分子哪个更容易发生热分解生成相应的单质?2.N2、02、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实 3.通过上述例子,你认为键长、键能对分子的化学性质有什么影响?[汇报]1、形成2 mo1HCl释放能量:2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ形成2 mo1HBr释放能量:2×366kJ -(436.0kJ+193.7kJ)= 102.97kJHCl释放能量比HBr释放能量多,因而生成的HCl更稳定,即HBr更容易发生热分解生成相应的单质.2、键能大小是:F-H>O-H>N-H3、键长越长,键能越小,键越易断裂,化学性质越活泼。[投影]表2—3:CO分子和N2分子的某些性质[讲]表2—3数据表明,CO分子和N2分子在许多性质上十分相似,这些相似性,可以归结为它们具有相等的价电子总数,导致它们具有相似的化学结构,由此形成了等电子原理的概念一一原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。[板书]三、等电子原理等电子原理:原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。[讲]等电子体的价电子总数相同,而组成原子核外电子总数不一定相同。[思考]我们学过的等电子物质还有哪些?试举例。[投影小结]常见的等电子体类型实例空间构型二原子10电子的等电子体N2、CO、NO+、C22-、CN-直线型 三原子16电子的等电子体CO2、CS2、N2O、NCO-、NO2+、N3-、NCS-、BeCl2 直线型三原子18电子的等电子体NO2-、O3、SO2 V型四原子24电子的等电子体NO3―、CO32-、BO33-、CS33-、BF3、SO3 平面三角形五原子32电子的等电子体SiF4、CCl4、BF4-、SO42-、PO43-四个σ键,正四面体形七原子48电子的等电子体SF6、PF6-、SiF62-、AlF63-六个σ键,正八面体[讲]等电子体的应用:判断一些简单分子或离子的立体构型 ;利用等电子体在性质上的相似性制造新材料;利用等电子原理针对某物质找等电子体。[自学]科学视野:用质谱仪测定分子结构现代化学常利用质谱仪测定分子的结构。它的基本原理是在质谱仪中使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的分子离子、碎片离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场分析器得到分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的结构。例如,图2—7的纵坐标是相对丰度(与粒子的浓度成正比),横坐标是粒子的质量与电荷之比(m/e),简称质荷比。化学家通过分析得知,m/e=92的峰是甲苯分子的正离子(C6H5CH3+),m/e=91的峰是丢失一个氢原子的的C6H5CH2+ ,m/e=65的峰是分子碎片……因此,化学家便可推测被测物是甲苯。
教学回顾:本节课,主要目的是让学生通过学习键参数的内容来了解影响物质结构的一些因素。教学中,教师不能一味顺从学生的探究欲望,要做教学的向导,当学生提出很难对学生解释清楚的问题时,教师要果断的导向。教师又是学生的指导者,教师的指导直接影响着教学的效果。教学中,有些问题要引导学生提出,有些话要留给学生讲,有些事要让学生做。这节课完成的比较顺利,从学生的精神面貌可以看出他们对键参数非常感兴趣而且对自己的表现很满意,享受到了探究学习的乐趣。老师作为辅导者,为学生提供自主学习的机会,通过提问、总结、讨论、归纳等教学活动,使每个学生的个性都得以充分的展现。课后有学生说:“我知道怎样学化学了,得把自己想象成微粒那么小,进入物质里面,去感受物质间的变化。” 新课程需要教师在教学中重新寻找自己的位置,设计出以学生为主体的教学过程。教师怎样才能起到设计者、指导者,乃至于学生的助手作用?是需要教师更新教育理念,痛苦洗脑。
PAGE
第1页
