高一化学新课程上学期期末复习:非金属元素化合物课件
文档属性
| 名称 | 高一化学新课程上学期期末复习:非金属元素化合物课件 |  | |
| 格式 | rar | ||
| 文件大小 | 518.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-08-04 20:32:00 | ||
图片预览






文档简介
课件17张PPT。非金属元素化合物复习非金属元素化合物主要物质:
单质→氧化物→含氧酸→含氧酸盐Cl2→HClO Ca(ClO)2S→SO2 SO3 → H2SO3 H2SO4→ Na2SO3 Na2SO4N2 →NO NO2 →HNO3(浓或稀)
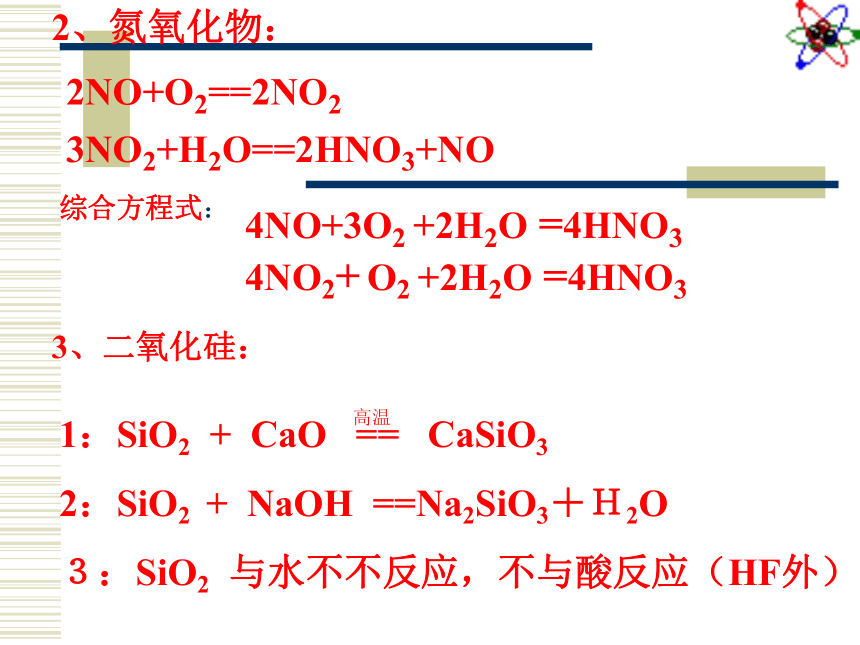
Si →SiO2 → Na2SiO3 →H2SiO3 H4SiO4氢化物:HCl NH3一、非金属单质主要化学性质二、非金属氧化物主要化学性质:1、二氧化硫:2NO+O2==2NO23NO2+H2O==2HNO3+NO2、氮氧化物:综合方程式:
4NO+3O2 +2H2O =4HNO3 4NO2+ O2 +2H2O =4HNO3 3、二氧化硅: 硫酸具有多种性质:①呈强酸性 ②具有高沸点 ③浓硫酸具有吸水性 ④浓硫酸具有脱水性 ⑤浓硫酸具有强氧化性。在下列变化中硫酸体现的性质为:
⑴铜与浓硫酸共热,产生二氧化硫气体
⑵亚硫酸钠中加入硫酸,产生二氧化硫
⑶氯化钠固体跟浓硫酸的混合物共热时产生氯化氢气体
⑷浓硫酸能用来干燥氯气、氢气等,但不能干燥氨气、碘化气等
⑸纸张、布片、蔗糖等遇浓硫酸会慢慢变黑
⑹浓硫酸与红热木炭反应时产生混合气体
⑺可以用铁制容器装运浓硫酸 (1)呈酸性 氧化性(2)强酸性 (3)难挥发性 (4)吸水性酸性氧化性 (5)脱水性(6)具有强氧化性(7)钝化。
思考?答案:三、含氧酸化学性质:
1 、硫酸:(1)高沸点酸,难挥发性——制备易挥发性酸
(2)吸水性——做干燥(3)脱水性——使有机物脱水炭化
⑷强氧化性——与不活泼金属、非金属、还原性物质反应
⑸强酸性
注意稀硫酸与浓硫酸性质的区别2、主要化学反应:强氧化性酸性
2HBr + H2SO4(浓)= Br2↑+ SO2↑+ 2H2O
2HI + H2SO4(浓)= I2↑+ SO2↑+ 2H2O
H2S + H2SO4(浓)= S↓+ SO2↑+ 2H2O(1)氧化金属单质(3)氧化还原性化合物2、 硝酸的化学性质1 )硝酸的不稳定性
4 HNO3==2H2O+4NO2 ↑ +O2 ↑
2)硝酸的氧化性
3Mg+8HNO3(稀)=3Mg(NO3)2+2NO ↑ +4H2O
3Cu +8HNO3(稀)=3Cu(NO3)2+2NO ↑ +4H2O
Cu +4HNO3(浓)=Cu(NO3)2+2NO2 ↑ +2H2O
Al、Fe等在浓硝酸中发生钝化现象
C+4HNO3=2H2O+4NO2 ↑ +CO2 ↑
浓硫酸和硝酸氧化性的对比3、硅酸:硅酸、原硅酸都不溶于水,属于弱酸,其酸性比碳酸弱:Na2SiO3+CO2+H2O=Na2CO3+H4SiO4↓H4SiO4===H2SiO3+H2O(易)Na2SiO3+2HCl+H2O=2NaCl+H4SiO4↓四、氯水与氨水
1、氯水成分及性质
(1)Cl2+H2O == H++Cl-+HClO
分子: Cl2、H2O、HClO
离子: H+、Cl-、ClO- 、OH-2019/2/2612
(2)各成分性质及应用:①Cl2--与Na、Mg、Al、Fe、Zn、Cu等大多数金属反应;②Cl2与NaOH、Ca(OH)2…强碱反应;③HClO——漂白、杀菌、消毒;④H+——石蕊试液(呈红色)(若氯水过量则漂白;⑤Cl-——与Ag+沉淀。
2、氨水成分及性质(1)与水反应:NH3+H2O NH3·H2O NH4++OHˉ(2)成分: NH3 H2O NH3·H2O ;NH4+ OHˉ
(3)主要性质:弱碱性2019/2/2613
漂白粉
⑴制备:2Ca(OH)2+2Cl2= CaCl2+Ca(ClO)2 +2H2O
⑵成分: CaCl2,Ca(ClO)2 ,少量水⑶漂白作用:Ca(ClO)2+2H+= Ca2++2HClO
⑷失效:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 要求:掌握Ca(ClO)2的漂白原理,及其与SO2、HClO、Na2O2等漂白原理 的差异,并对所出现过的具有漂白能力的物质进行归纳:五、几种常见漂白剂氧化漂白—将有色物
质氧化分解,不可逆与有色物质结合生成
不稳定的无色物质。永久性漂白暂时性漂白2019/2/2615六、实验室制取气体1、制氯气
(1) MnO2+4HCl=MnCl2+Cl2 ↑ +H2O
利用强氧化剂将HCl氧化成Cl2
(2)制气装置选择:固+液 → △-1加热 (3)Cl2的收集:用向上排气法(排饱和食盐水除HCl)。干燥:除碱石灰外均可。检验:用湿润的KI-淀粉试纸,试纸变蓝。
尾气:用NaOH溶液吸收。2019/2/2616
(4)替代强氧化剂MnO2可用:
KMnO4、KClO3、K2Cr2O7、Ca(ClO)2……
(5)浓盐酸作用:还原性、酸性
(6)浓度要求:该反应必须用浓盐酸,因稀盐酸几乎无还原性,随着反应进行,浓盐酸将渐稀,一定程度时,会自动停止,HCl不可能消耗尽。2、氨气制取:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
△同学们 再见祝同学们学习进步
再见
单质→氧化物→含氧酸→含氧酸盐Cl2→HClO Ca(ClO)2S→SO2 SO3 → H2SO3 H2SO4→ Na2SO3 Na2SO4N2 →NO NO2 →HNO3(浓或稀)
Si →SiO2 → Na2SiO3 →H2SiO3 H4SiO4氢化物:HCl NH3一、非金属单质主要化学性质二、非金属氧化物主要化学性质:1、二氧化硫:2NO+O2==2NO23NO2+H2O==2HNO3+NO2、氮氧化物:综合方程式:
4NO+3O2 +2H2O =4HNO3 4NO2+ O2 +2H2O =4HNO3 3、二氧化硅: 硫酸具有多种性质:①呈强酸性 ②具有高沸点 ③浓硫酸具有吸水性 ④浓硫酸具有脱水性 ⑤浓硫酸具有强氧化性。在下列变化中硫酸体现的性质为:
⑴铜与浓硫酸共热,产生二氧化硫气体
⑵亚硫酸钠中加入硫酸,产生二氧化硫
⑶氯化钠固体跟浓硫酸的混合物共热时产生氯化氢气体
⑷浓硫酸能用来干燥氯气、氢气等,但不能干燥氨气、碘化气等
⑸纸张、布片、蔗糖等遇浓硫酸会慢慢变黑
⑹浓硫酸与红热木炭反应时产生混合气体
⑺可以用铁制容器装运浓硫酸 (1)呈酸性 氧化性(2)强酸性 (3)难挥发性 (4)吸水性酸性氧化性 (5)脱水性(6)具有强氧化性(7)钝化。
思考?答案:三、含氧酸化学性质:
1 、硫酸:(1)高沸点酸,难挥发性——制备易挥发性酸
(2)吸水性——做干燥(3)脱水性——使有机物脱水炭化
⑷强氧化性——与不活泼金属、非金属、还原性物质反应
⑸强酸性
注意稀硫酸与浓硫酸性质的区别2、主要化学反应:强氧化性酸性
2HBr + H2SO4(浓)= Br2↑+ SO2↑+ 2H2O
2HI + H2SO4(浓)= I2↑+ SO2↑+ 2H2O
H2S + H2SO4(浓)= S↓+ SO2↑+ 2H2O(1)氧化金属单质(3)氧化还原性化合物2、 硝酸的化学性质1 )硝酸的不稳定性
4 HNO3==2H2O+4NO2 ↑ +O2 ↑
2)硝酸的氧化性
3Mg+8HNO3(稀)=3Mg(NO3)2+2NO ↑ +4H2O
3Cu +8HNO3(稀)=3Cu(NO3)2+2NO ↑ +4H2O
Cu +4HNO3(浓)=Cu(NO3)2+2NO2 ↑ +2H2O
Al、Fe等在浓硝酸中发生钝化现象
C+4HNO3=2H2O+4NO2 ↑ +CO2 ↑
浓硫酸和硝酸氧化性的对比3、硅酸:硅酸、原硅酸都不溶于水,属于弱酸,其酸性比碳酸弱:Na2SiO3+CO2+H2O=Na2CO3+H4SiO4↓H4SiO4===H2SiO3+H2O(易)Na2SiO3+2HCl+H2O=2NaCl+H4SiO4↓四、氯水与氨水
1、氯水成分及性质
(1)Cl2+H2O == H++Cl-+HClO
分子: Cl2、H2O、HClO
离子: H+、Cl-、ClO- 、OH-2019/2/2612
(2)各成分性质及应用:①Cl2--与Na、Mg、Al、Fe、Zn、Cu等大多数金属反应;②Cl2与NaOH、Ca(OH)2…强碱反应;③HClO——漂白、杀菌、消毒;④H+——石蕊试液(呈红色)(若氯水过量则漂白;⑤Cl-——与Ag+沉淀。
2、氨水成分及性质(1)与水反应:NH3+H2O NH3·H2O NH4++OHˉ(2)成分: NH3 H2O NH3·H2O ;NH4+ OHˉ
(3)主要性质:弱碱性2019/2/2613
漂白粉
⑴制备:2Ca(OH)2+2Cl2= CaCl2+Ca(ClO)2 +2H2O
⑵成分: CaCl2,Ca(ClO)2 ,少量水⑶漂白作用:Ca(ClO)2+2H+= Ca2++2HClO
⑷失效:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 要求:掌握Ca(ClO)2的漂白原理,及其与SO2、HClO、Na2O2等漂白原理 的差异,并对所出现过的具有漂白能力的物质进行归纳:五、几种常见漂白剂氧化漂白—将有色物
质氧化分解,不可逆与有色物质结合生成
不稳定的无色物质。永久性漂白暂时性漂白2019/2/2615六、实验室制取气体1、制氯气
(1) MnO2+4HCl=MnCl2+Cl2 ↑ +H2O
利用强氧化剂将HCl氧化成Cl2
(2)制气装置选择:固+液 → △-1加热 (3)Cl2的收集:用向上排气法(排饱和食盐水除HCl)。干燥:除碱石灰外均可。检验:用湿润的KI-淀粉试纸,试纸变蓝。
尾气:用NaOH溶液吸收。2019/2/2616
(4)替代强氧化剂MnO2可用:
KMnO4、KClO3、K2Cr2O7、Ca(ClO)2……
(5)浓盐酸作用:还原性、酸性
(6)浓度要求:该反应必须用浓盐酸,因稀盐酸几乎无还原性,随着反应进行,浓盐酸将渐稀,一定程度时,会自动停止,HCl不可能消耗尽。2、氨气制取:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
△同学们 再见祝同学们学习进步
再见
