微观结构与物质的多样性 总复习
图片预览




文档简介
课件21张PPT。 专题一
微观结构与物质的多样性
总复习
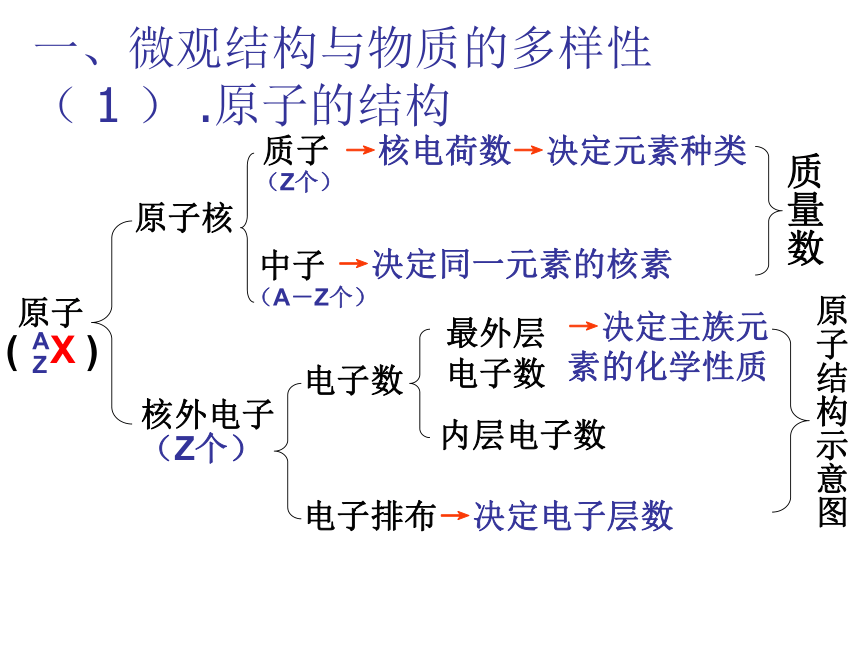
一、微观结构与物质的多样性 ( 1 ) .原子的结构→核电荷数→决定元素种类→决定同一元素的核素→决定主族元素的化学性质→决定电子层数 ( 2) 、核外电子排布的规律:
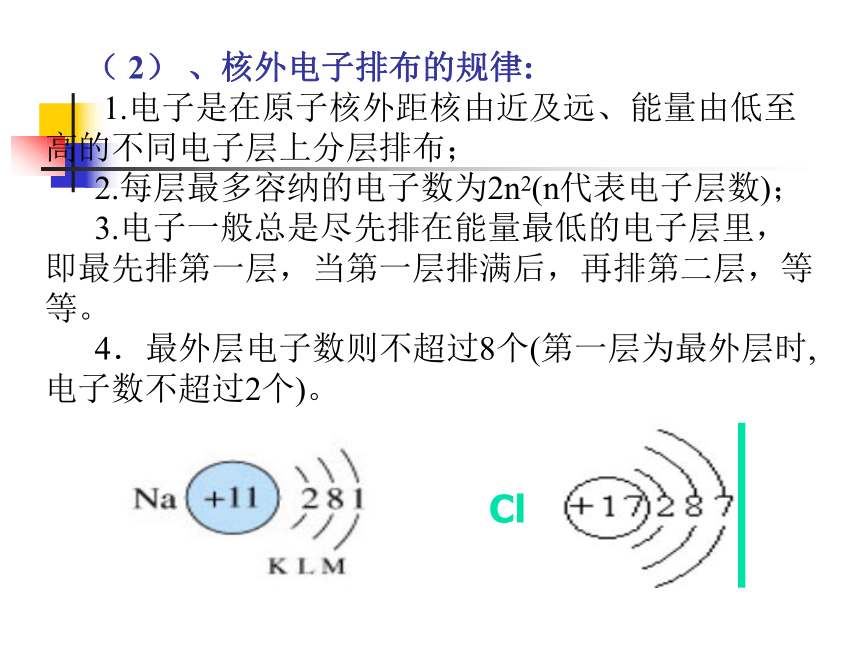
1.电子是在原子核外距核由近及远、能量由低至高的不同电子层上分层排布;
2.每层最多容纳的电子数为2n2(n代表电子层数);
3.电子一般总是尽先排在能量最低的电子层里,即最先排第一层,当第一层排满后,再排第二层,等等。
4.最外层电子数则不超过8个(第一层为最外层时,电子数不超过2个)。 Cl
元素周期表结构
( 3)周期律与周期表 【概括总结】
族 副族(3、4、5、6、7、11、12列)B族
零族(18列)、 第VIII族(8、9、10列)
周期 长周期(四、五、六行)(元素有18、18、
32种)
短周期(一、二、三行)(元素有2、8、8种)
不完全周期(七行)
(元素有26种多) 同一周期从左到右,元素原子失去电子能力逐渐减弱,得电子能力逐渐增强,即金属性渐弱,非金属性渐强。
同主族元素从上到下,随着原子核外电子层数增多,原子半径增大,原子核对最外层电子的引力减小,元素原子得电子能力减弱,失电子能力增强,即非金属性渐弱,金属性渐强。
主族(1、2、13、14、15、16、17列) A族
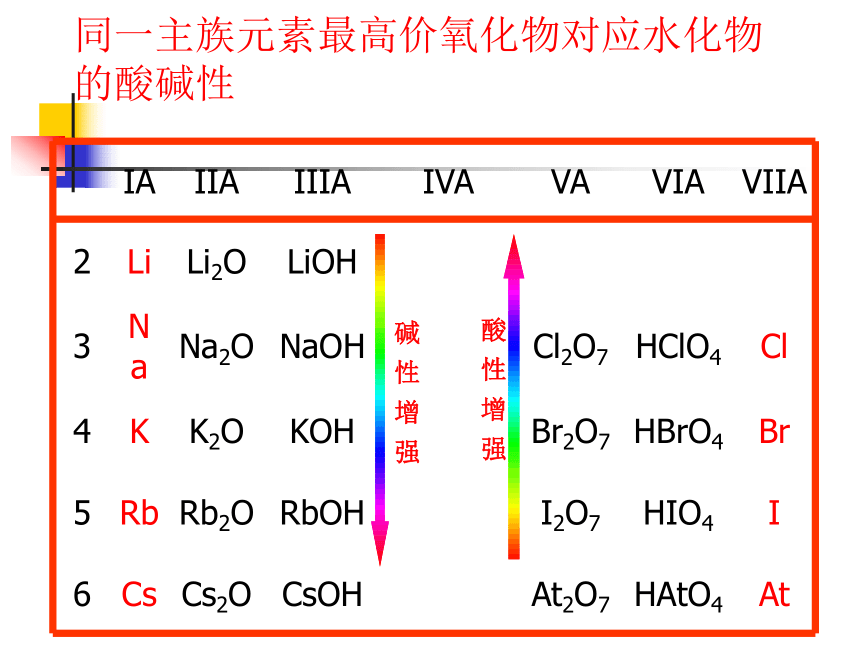
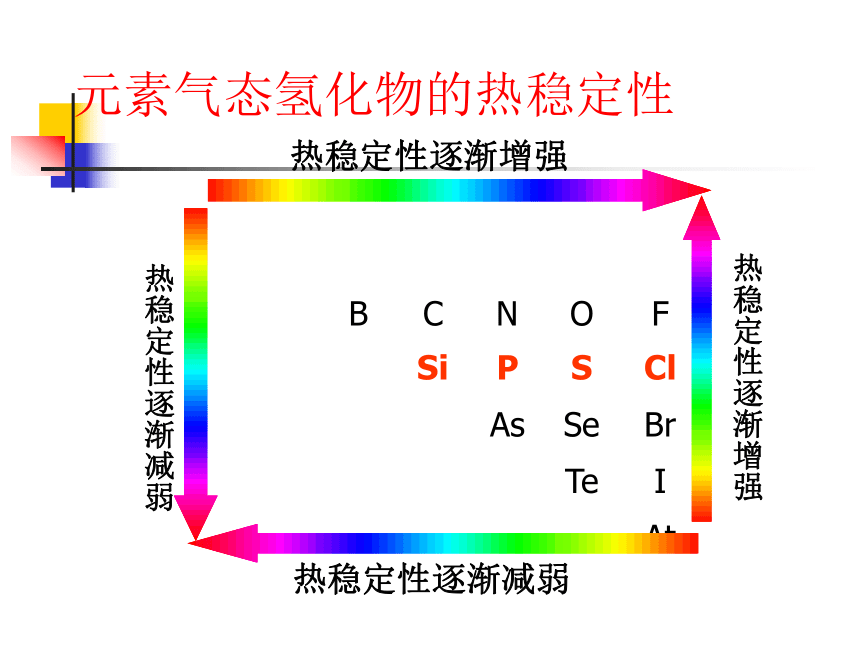
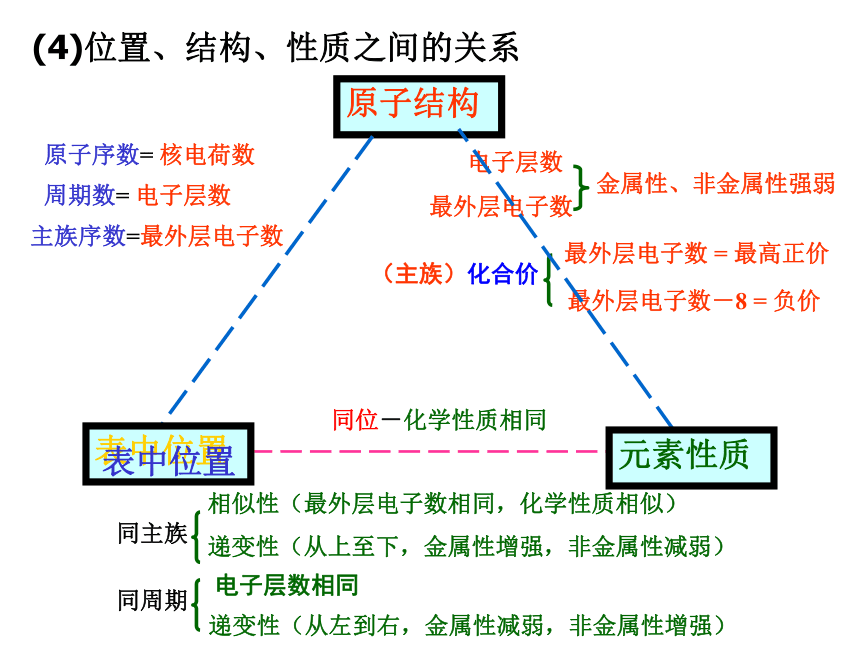
元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强第三周期元素的最高价氧化物对应水化物酸性酸性逐渐增强,碱性减弱同一主族元素最高价氧化物对应水化物的酸碱性酸 性 增 强碱 性 增 强元素气态氢化物的热稳定性热稳定性逐渐增强热稳定性逐渐减弱热稳定性逐渐减弱热稳定性逐渐增强(4)位置、结构、性质之间的关系原子结构表中位置元素性质表中位置同位-化学性质相同二 .微粒之间的相互作用力活泼金属与活泼非金属之间非金属元素之间阴、阳离子之间的静电作用原子间形成共用电子对有方括号、有正负号无方括号、无正负号1.离子键和共价键2.用电子式表示离子化合物的形成过程。
例如:氯化镁Na2O ?N?N
3.共价键形成的表示方法练习 1、判断下列物质内的化学键哪些是极性共价键,哪些是非极性共价键?
a.CO2 b.SO2 c.H2O2 d.Na2O2 e.NH4Cl
2下列微粒电子式错误的是( )?
B4.化学键与分子间作用力的比较相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间与化学键相比弱的多较 强主要影响化学性质主要影响物理性质(如熔沸点) 分子间作用力如何影响物质的物理性质?卤族元素单质物理性质差异三 、从微观结构看物质的多样性
1、 “四同 ”
同素异形体(指单质如金刚石、石墨和富勒烯)
四同 同位素 (指原子)
同系物 (结构相似的有机物 )
同分异构体(分子式相同而结构不同 ) 2. 离子晶体、分子晶体、原子晶体等的区别:
离子晶体
阴,阳离子
原 子
分 子 离子键较高较大NaCl、 NH4Cl,BaSO4等
金刚石、晶体硅 、刚玉 、石英等
干冰 、冰等 原子晶体
分子晶体2.下列叙述中,正确的是( )
A、由碳元素单质组成的物质一定是纯净物
B、金刚石和石墨具有相同的化学组成
C、石墨转变为金刚石不属于化学变化
D、C60是新发现的一种碳的单质 练习 1、有关O3的说法中错误的是( )
(1)O3具有特殊臭味,因此被称为”臭氧” (2)臭氧可用于漂白和消毒作用 (3)O3比O2在相同条件下密度大,比O2易溶于水 (4)O3比O2稳定,高温下不易分解 (5)空气中高压放电、高压电机、复印机工作时都会有O3生成 (6)空气中O3含量越高越好 (7)NO和氟里昂会促使O3分解A.①②③ B.④⑤⑥ C.④⑥ D.⑤⑦DC3.下列各组物质属于同位素的是 ;属于同素异形体的是 ;属于同系物的是 ;属于同分异构体的是 。
① O2和O3
②3517Cl和3717Cl
③氕、氘、氚
④金刚石和石墨
⑤ CH3CH3和CH3CH2CH2CH3
⑥新戊烷和异戊烷
⑦CH2=CH2和CH3CH2CH = CH2 ② 、③① 、④⑤ 、⑦⑥谢谢大家!再见!
微观结构与物质的多样性
总复习
一、微观结构与物质的多样性 ( 1 ) .原子的结构→核电荷数→决定元素种类→决定同一元素的核素→决定主族元素的化学性质→决定电子层数 ( 2) 、核外电子排布的规律:
1.电子是在原子核外距核由近及远、能量由低至高的不同电子层上分层排布;
2.每层最多容纳的电子数为2n2(n代表电子层数);
3.电子一般总是尽先排在能量最低的电子层里,即最先排第一层,当第一层排满后,再排第二层,等等。
4.最外层电子数则不超过8个(第一层为最外层时,电子数不超过2个)。 Cl
元素周期表结构
( 3)周期律与周期表 【概括总结】
族 副族(3、4、5、6、7、11、12列)B族
零族(18列)、 第VIII族(8、9、10列)
周期 长周期(四、五、六行)(元素有18、18、
32种)
短周期(一、二、三行)(元素有2、8、8种)
不完全周期(七行)
(元素有26种多) 同一周期从左到右,元素原子失去电子能力逐渐减弱,得电子能力逐渐增强,即金属性渐弱,非金属性渐强。
同主族元素从上到下,随着原子核外电子层数增多,原子半径增大,原子核对最外层电子的引力减小,元素原子得电子能力减弱,失电子能力增强,即非金属性渐弱,金属性渐强。
主族(1、2、13、14、15、16、17列) A族
元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强第三周期元素的最高价氧化物对应水化物酸性酸性逐渐增强,碱性减弱同一主族元素最高价氧化物对应水化物的酸碱性酸 性 增 强碱 性 增 强元素气态氢化物的热稳定性热稳定性逐渐增强热稳定性逐渐减弱热稳定性逐渐减弱热稳定性逐渐增强(4)位置、结构、性质之间的关系原子结构表中位置元素性质表中位置同位-化学性质相同二 .微粒之间的相互作用力活泼金属与活泼非金属之间非金属元素之间阴、阳离子之间的静电作用原子间形成共用电子对有方括号、有正负号无方括号、无正负号1.离子键和共价键2.用电子式表示离子化合物的形成过程。
例如:氯化镁Na2O ?N?N
3.共价键形成的表示方法练习 1、判断下列物质内的化学键哪些是极性共价键,哪些是非极性共价键?
a.CO2 b.SO2 c.H2O2 d.Na2O2 e.NH4Cl
2下列微粒电子式错误的是( )?
B4.化学键与分子间作用力的比较相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间与化学键相比弱的多较 强主要影响化学性质主要影响物理性质(如熔沸点) 分子间作用力如何影响物质的物理性质?卤族元素单质物理性质差异三 、从微观结构看物质的多样性
1、 “四同 ”
同素异形体(指单质如金刚石、石墨和富勒烯)
四同 同位素 (指原子)
同系物 (结构相似的有机物 )
同分异构体(分子式相同而结构不同 ) 2. 离子晶体、分子晶体、原子晶体等的区别:
离子晶体
阴,阳离子
原 子
分 子 离子键较高较大NaCl、 NH4Cl,BaSO4等
金刚石、晶体硅 、刚玉 、石英等
干冰 、冰等 原子晶体
分子晶体2.下列叙述中,正确的是( )
A、由碳元素单质组成的物质一定是纯净物
B、金刚石和石墨具有相同的化学组成
C、石墨转变为金刚石不属于化学变化
D、C60是新发现的一种碳的单质 练习 1、有关O3的说法中错误的是( )
(1)O3具有特殊臭味,因此被称为”臭氧” (2)臭氧可用于漂白和消毒作用 (3)O3比O2在相同条件下密度大,比O2易溶于水 (4)O3比O2稳定,高温下不易分解 (5)空气中高压放电、高压电机、复印机工作时都会有O3生成 (6)空气中O3含量越高越好 (7)NO和氟里昂会促使O3分解A.①②③ B.④⑤⑥ C.④⑥ D.⑤⑦DC3.下列各组物质属于同位素的是 ;属于同素异形体的是 ;属于同系物的是 ;属于同分异构体的是 。
① O2和O3
②3517Cl和3717Cl
③氕、氘、氚
④金刚石和石墨
⑤ CH3CH3和CH3CH2CH2CH3
⑥新戊烷和异戊烷
⑦CH2=CH2和CH3CH2CH = CH2 ② 、③① 、④⑤ 、⑦⑥谢谢大家!再见!
