化学反应的限度
图片预览








文档简介
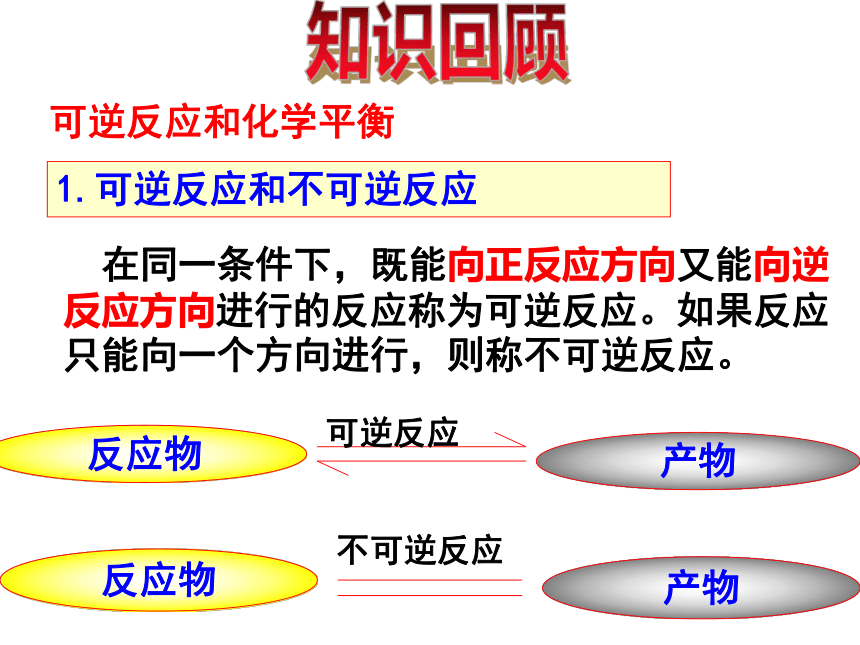
课件74张PPT。第2节 化学反应的限度可逆反应和化学平衡1.可逆反应和不可逆反应 在同一条件下,既能向正反应方向又能向逆反应方向进行的反应称为可逆反应。如果反应只能向一个方向进行,则称不可逆反应。知识回顾(1)同一条件下,同时进行;注
意(2)反应物不能完全转化为生成物。⑶ 使用“ ”正向反应:反应物→生成物 即SO2→SO3逆向反应:生成物→反应物 即SO3→ SO22、化学平衡:(1)、定义:化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。强调三点前提条件:可逆反应实质:ν(正)=ν(逆)标志:反应混合物中各组分的浓度保持不变的状态动态平衡(正逆反应仍在进行)正反应速率=逆反应速率可逆反应 H2+I2≒2HI①逆:②等:③动:④定:反应混合物中各组分的浓度保持不变(不一定相等)⑤变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。⑥同: 对于一个特定的可逆反应如果条件相同,不管采取何种方式和途径进行最终能达到相同平衡状态, 与反应途径无关-等效平衡(2)、化学平衡状态的特征为了减轻汽车尾气对城市空气的污染,人们提出通过以下反应来处理汽车尾气:
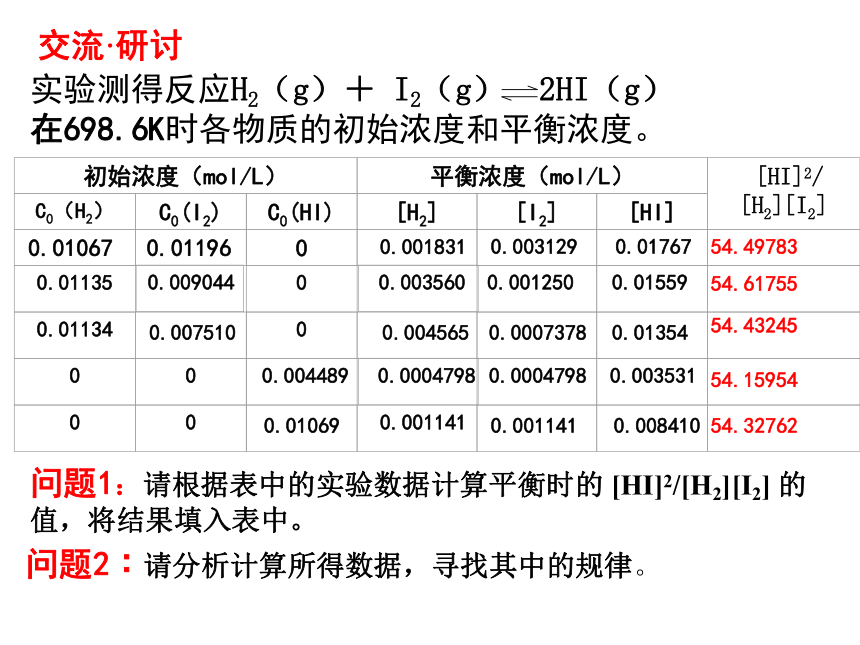
2NO(g)+2CO(g)=N2(g)+2CO2(g),上节课中我们已经证明了该反应完全可以自发进行,可是反应进行的程度有多大呢?为了寻找定量描述化学反应限度的方法,人们对许多化学平衡体系的数据进行了分析,终于发现:化学平衡常数可以表征化学反应限度的相对大小。化学平衡与化学平衡常数交流·研讨问题1:请根据表中的实验数据计算平衡时的 [HI]2/[H2][I2] 的值,将结果填入表中。实验测得反应H2(g)+ I2(g) 2HI(g)
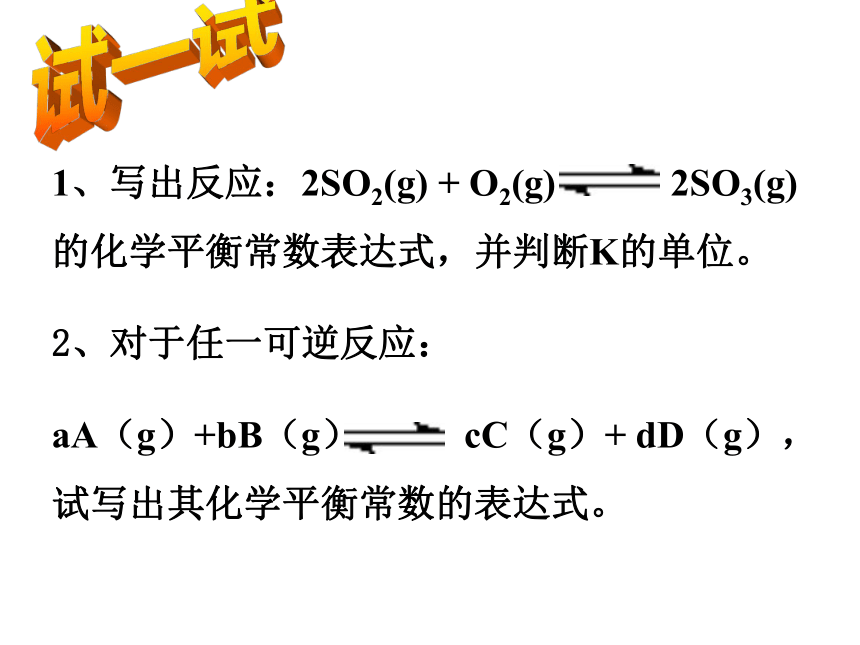
在698.6K时各物质的初始浓度和平衡浓度。 问题2︰请分析计算所得数据,寻找其中的规律。不管H2,I2和HI的初始浓度是多大,只要保持反应体系的温度不变,达到化学平衡状态后, 就为常数。思考 发现我们通常把这个常数称为化学平衡常数试一试1、写出反应:2SO2(g) + O2(g) 2SO3(g)的化学平衡常数表达式,并判断K的单位。
2、对于任一可逆反应:
aA(g)+bB(g) cC(g)+ dD(g),试写出其化学平衡常数的表达式。对于一般的反应aA +bB cC + dD
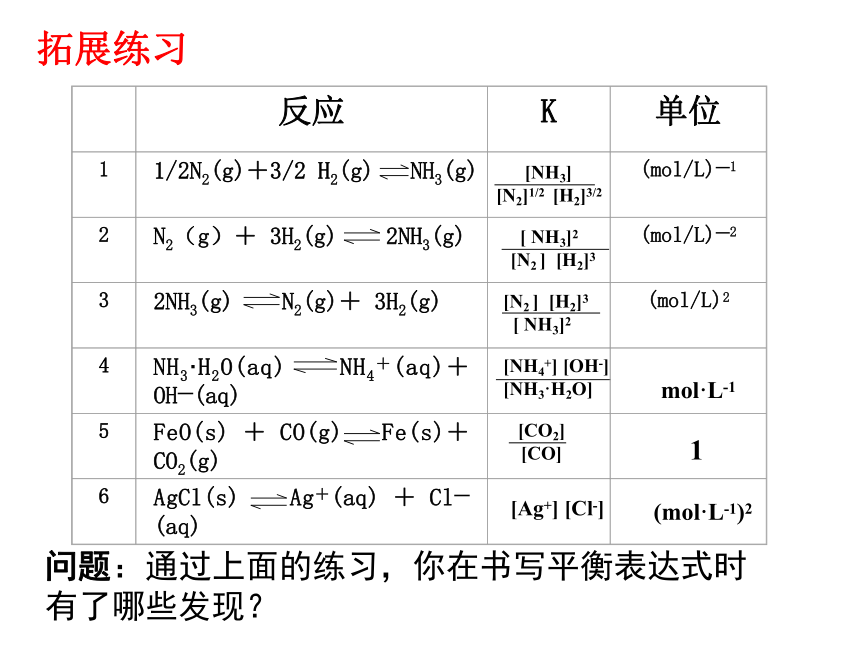
当温度一定,达到化学平衡时,其平衡常数表达式:注意:平衡常数表达式中不包括固体和纯液体物质的浓度项(因为它们的浓度为常数),只包括气态物质和溶液中各溶质的浓度。一、化学平衡常数拓展练习问题:通过上面的练习,你在书写平衡表达式时 有了哪些发现?
1、对于一个反应,其平衡常数的表达式是唯一的吗?平衡常数的表达式与哪些因素有关?
2、对于一个反应,正、逆反应的平衡常数之间有何关系?
3、如果浓度的单位是mol/L,将浓度单位代入平衡常数表达式,可得到K的单位。请写出上表中后三个反应的K的单位,并分析K的单位与反应的化学方程式之间有什么关系?思考平衡常数表达式与化学方程式的书写方式有关。
1、对于同一化学反应,由于书写方式不同,各反应物、生成物的系数不同,平衡常数的表达式就不同。
2、对于给定的化学反应,正、逆反应的平衡常数互为倒数。
3、平衡常数的单位也与化学方程式的表示形式相对应。
发现二、平衡常数表达式书写的注意事项 在2000K时,反应CO(g)+1/2O2(g) CO2(g) 的平衡常数为K1,则相同温度下反应
2CO2(g) 2CO(g) + O2(g)的平衡常数K2为
( )
A、 1/K1 B、 K12 C、 1/K12 D、 K1-1/2C巩固练习平衡常数的应用 ⑴判断反应可能进行的程度,估计反应的可能性。K>105时, 基本完全反应。
K在10-5~105之间 可逆反应。
K<10-5时, 很难反应。资料在线K值越大,反应越完全,K值越小,反应越不完全K的大小只能预示反应所能进行的最大程度交流·研讨请通过以下各反应平衡常数的数值,讨论反应可能进行的程度:
⑵判断反应进行的方向、反应是否达到平衡状态Q=K时,反应已达平衡;
Q>K时,反应逆向进行
Q 的任意状态 在温度一定时, Qc与Kc相比较,可知反应进行的方向.具体方法如下:练习1:已知CO(g)+H2O(g) CO2(g)+H2
8000C,K=1
试推导在下列浓度下反应进行的方向向逆平衡向正对于反应: CO(g)+H2O(g) CO2(g)+H2 [CO2] [H2] Qc= . [CO] [H2O] 0.4mol.L-1×0.4 mol.L-1 Qc1= =1.07>K 向逆 0.3mol.L-1×0.5 mol.L-1 0.5mol.L-1×0.6 mol.L-1 Qc2= =1.0=K 平衡 1.0mol.L-1×0.3 mol.L-1 0.7mol.L-1×1.7 mol.L-1 Qc3= =0.931、表达式:对于化学反应aA+bB cC+dD,反应物A的平衡转化率可表示为:2、平衡转化率的有关计算
关于平衡常数和平衡转化率的计算主要有以下三种类型
(1)、已知初始浓度和平衡浓度求平衡常数和平衡转化率
例1:对于反应2SO2(g)+ O2(g) 2SO3(g) ,若在一定温度下,将0.1mol的SO2(g)和0.06mol O2(g)注入一体积为2L的密闭容器中,当达到平衡状态时,测得容器中有0.088mol的SO3(g)试求在该温度下
(1)此反应的平衡常数。
(2)求SO2(g)和O2(g)的平衡转化率由例1可知,一个已标明化学方程式的化学反应,在温度一定时虽然只有一个平衡常数,但是不同反应物的平衡转化率可能不同。因此,脱离具体的反应物谈化学平衡转化率是没有意义的。(2)、已知平衡转化率和初始浓度求平衡常数
例2:反应SO2(g)+ NO2(g) SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
(1)此反应的平衡常数。
(2)若SO2(g)的初始浓度增大到3mol/L, NO2(g)的初始浓度仍为2mol/L,则SO2(g)的转化率变为多少?(1)K=1(2) SO2的转化率为40%(3)、已知平衡常数和初始浓度求平衡浓度及转化率。
例3、在1200℃时测得下列反应达平衡时,k=2.25.
CO2(g)+H2(g) CO(g)+H2O(g) 。若反应从CO2(g)和H2(g)开始,且CO2(g)和H2(g)的初始浓度分别为A、B、C三种情况。试计算A情况下各物质的平衡浓度及CO2(g)和H2(g)平衡转化率。 将根据B、C组数据计算各物质的平衡浓度和平衡
转化率(α),分析结果,得出什么结论? 化学平衡常数与转化率的区别和联系
由化学平衡常数K可以推断反应进行的 ,K越大,说明反应进行的越 ,反应物的转化率也越 ,但K只与 有关;转化率也可以表示某一可逆反应进行的 ,α越大,反应进行的越 ,但是α与反应物的起始浓度等因素有关,转化率变化了,
K 变化。 程度完全高温度程度完全不三、 反应条件对化学平衡的影响对于可逆反应N2(g)+3H2(g) 2NH3(g),在一定条件下,当正反应速率和逆反应速率相等时,该反应就达到了平衡状态,反应进行到了最大限度。如果改变条件,正反应速率和逆反应速率不再相等,这个平衡就要被破坏,在新的条件下建立起新的平衡。这样由一个平衡状态变为另一个平衡状态的过程,称为化学平衡移动。如果平衡移动的结果使NH3的物质的浓度变大,则称平衡正向或向右移动;反之称平衡逆向移动或向左移动。 你知道哪些外部条件可引起化学速率的改变 温度、浓度、压强、催化剂等外部条件的改变可能引起化学反应速率的改变。 这些条件的改变会对化学平衡产生怎样
的影响呢? 2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 温度对化学平衡的影响2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 减小正向增大逆向温度对化学平衡的影响正 向正 向 升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动。交流 研讨 温度对化学平衡的影响是通过改变平衡常数实现的。交流 研讨 在一定体积的 密闭容器中,反应CO2(g) + H2(g)
CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填”吸热”或”放热”)。
(3)某温度下,平衡浓度符合下式:
c(CO2)c(H2) =c(CO) c(H2O),可判断此时的温度为 ℃。吸热830迁移 应用正 向逆 向 请根据反应 Fe3+(aq) + 3SCN-(aq) Fe(SCN)3(aq)的平衡常数K 与
浓度商Q = 的关系,讨论改变反应物或生成物浓度对化学
平衡的影响。
Q < KQ > K交流 研讨 请根据提供的试剂和仪器,按照设计的实验
方案证明上述预测。
试剂:0.01 mol·L-1 FeCl3溶液、0.03 mol·L-1KSCN溶液、
1mol·L-1 FeCl3溶液、1mol·L-1KSCN溶液
仪器:胶头滴管、点滴板等
溶液呈血红色后加深溶液呈血红色后加深 请根据提供的试剂和仪器,按照设计的实验方 案证明上述预测。
试剂:0.01 mol·L-1 FeCl3溶液、0.03 mol·L-1KSCN溶液、
1mol·L-1 FeCl3溶液、1mol·L-1KSCN溶液
仪器:胶头滴管、点滴板等
改变浓度,若QK,平衡逆向移动。溶液呈血红色后加深正向移动溶液呈血红色后加深
正向移动 2SO2(g) + O2(g) 2SO3(g) △H = _ 197.8kJ·mol-1
是硫酸制造工业的基本反 应。在生产中通常采用通入过量的空气的方法。为什么? 提高O2在原料气中的比例,使SO2的平衡转化率提高,从而降低生产成本。原平衡状态 新平衡状态 平 衡 移 动浓度
借助Q与K的相对大小进行判断温度
温度对化学平衡的影响是
通过改变平衡常数来实现的精题点拨 在一定条件下,反应CO + NO2 CO2 + NO达到平衡后,降低温度,混合气体的颜色变浅。下列判断正确的是( )
A. 正反应为吸热反应
B. 正反应为放热反应
C. CO的平衡转化率降低
D. 各物质的浓度不变B 1.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。其化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动练习BD练习 2.在一定条件下,反应H2(g)+Br2(g) 2HBr(g) 的△H<0,达到化学平衡状态且其它条件不变时:
(1)如果升高温度,平衡混合物的颜色 ;
(2)如果在体积固定的容器中加入一定量的氢气,化学平衡 移动,Br2(g)的平衡转化率 (变大、变小或不变)。 3.铬酸钾(K2CrO4)与重铬酸钾(K2Cr2O7)有如下转化:
2CrO42-+ 2H+ Cr2O72- + H2O
黄色 橙红色
已知重铬酸钾的稀溶液呈橙红色。
(1)向重铬酸钾的稀溶液中加入NaOH,溶液呈 色;
(2)向 (1)的溶液中再加入过量的H2SO4,溶液呈 色;
(3)向重铬酸钾的稀溶液中加入Ba(NO3)2溶液(BaCrO4为 黄色沉淀),则平衡向 移动(填“左”或“右”)。变深正向变大黄橙红左一定温度下,在密闭容器中发生的反应
2NO2(g) N2O4(g); △H<0向吸热方向移动向放热方向移动正向移动逆向移动一定温度下,在密闭容器中发生的反应
2NO2(g) N2O4(g); △H<0 假设 K的数值为a正向移动逆向移动2a计算Q的数值并判断平衡移动的方向。三支针筒中均抽入10mlNO2气体,将针筒前端闭。
原理:N2O4 2NO2
(1)将第二支针筒活塞迅速推至5ml处(现象如下图中
a b c 所示)
(2)将第三支针筒活塞迅速拉至20ml处。(现象如下图中A1 b1 c1 所示)
请观察针筒中气体颜色变化,并尝试用化学平衡移动的观点进行解释。a1b1c1[观察.思考]bcaT℃时,在密闭容器中发生的反应
2NO2(g) N2O4(g);△H<0假设K的数值为a先变深后变浅先变浅后变深V↓c(NO2)↑,平衡正移c(NO2)↓ V↑c(NO2)↓,平衡逆移c(NO2)↑a1b1c1bca在T℃时对下列处于化学平衡的三个反应将压强均增加至2倍(假设三个反应在T℃时的K的数值分别为a、b、c)正向气态物质系数减小(△υ g<0 )正向移动b不移动4c逆向移动1、计算② 、 ③ Q的数据,判断加压平衡的移动方向。
2、根据上表思考讨论:加压后平衡移动方向与△υ g的关系。
气态物质系数不变(△υ g=0 )正向气态物质系数增大(△υ g>0 )对于只涉及固体或液体的反应,压强的影响极其微弱,可以不予考虑B:减小压强,会使化学平衡向着气体体积增大的方向移动。3、压强对化学平衡的影响结论: (在其它条件不变的情况下)(对于反应前后气体体积改变的反应)A:增大压强,会使化学平衡向着气体体积缩小的方向移动。(对于反应前后气体体积不变的反应)特例: 改变压强,化学平衡不移动。再如:向气体体积缩小的方向移动向气体体积增大的方向移动 N2(气) + 3H2 (气) 2NH3(气)4500C时N2与H2反应合成NH3的数据分析:煤气中毒病人血液中的化学平衡:
CO (g) + Hb(O2) O2(g) + Hb(CO)
K= 思考:应用化学平衡移动原理分析讨论
煤气 中毒 后应采取那些抢救措施? 在密闭容器中的反应2NO2(g) N2O4(g); △H<0
若仅改变影响平衡的一个条件,完成下表向吸热方向移动减弱温度的升高向放热方向移动减弱温度的降低正向移动减弱c(NO2)的增大逆向移动减弱c(NO2)的减小正向移动逆向移动减弱压强的增大减弱压强的减小 根据上表可以看出: 在密闭体系中,如果仅改变影响平衡的一个条件 ( 如 温度、浓度、压强 )平衡将 向 _______________方向移动。减弱这个改变的早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:改变影响化学平衡的一个因素,平衡将向能够减弱这种改变的方向移动。减弱的双重含义:
精析精练P41(反应达到平衡状态)
化学反应的限度平衡常数转化率第2节知识小结检测反馈题
1. 压强变化不会使下列化学反应的平衡发生移动的 是( )
H2(g)+I2(g) 2HI(g)
3H2(g)+N2(g) 2NH3(g)
2SO2(g)+O2(g) 2SO3(g)
C(s)+CO2(g) 2CO(g)A2. 促使化学平衡
3H2(g)+N2(g) 2NH3(g); △H<0
正向移动有各种措施,下列措施可行的是( )
升高温度 B. 增大体系压强
C. 增大c(N2) D. 容器体积增大BC3、下列关于平衡常数K和平衡转化率α的 说法中正确的是( )
A、在任何条件下,化学平衡常数都是一个 恒定值
B、改变反应物浓度或生成物浓度都会改变 α和K
C、K和α只与温度有关,与反应物浓度、 压强无关
D、K和α的大小都可以定量描述一个化学 反应的限度
D4、在557℃密闭容器中进行的反应及条件:
CO(g)+H2O(g) CO2(g)+H2(g)
起始浓度: 2mol·L-1 3mol·L-1 0 0
变化浓度:
平衡浓度: 1.2mol·L-1
请计算:
(1)此反应的平衡常数K=
(2)平衡时α(CO)=
(3)平衡时α( H2O)= 160%40%5. 下列平衡体系中,升温或减压都使平衡正向移动的是 ( )A. 3H2(g)+N2(g) 2NH3(g); △H<0
B. 2NO(g) N2(g)+O2(g) ; △H > 0
C. C(s)+H2O(g) CO(g)+ H2(g) ;△H>0
D. 2SO2(g)+O2(g) 2SO3(g) ; △H<0C作业:
1.完成课本52页第3、4、6题。
2.查找资料,分析工业合成氨是如何利
用化学平衡移动规律提高转化率的?等效平衡 等效平衡
对于同一可逆反应,达平衡时,任何相同的组分的含量(体积、物质的量)均对应相同,这样的化学平衡互称为等效平衡。在恒温恒容下,按不面同的投料方式进行反应
平衡后各体系内相同组分浓度是否对应相同 三条途径最终达同一平衡,
由此得出什么规律? 在定温定容的条件下,对于反应前后气体分子数改变的可逆反应,只改变起始加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一边物质的物质的量与原平衡相同,则两平衡等效.定温(T)定容(V)条件下的等效平衡 CO(g) + H2O(g) CO2(g) + H2(g)
(1) 1mol 1mol 0 mol 0 mol
(2) 0 mol 0 mol 2 mol 2 mol
“一边倒” 2 mol??? 2 mol??????? 0 mol?? 0 mol (3) 0 mol 1 mol 1 mol 1 mol
“一边倒” 1mol??? 2 mol??????? 0 mol?? 0 mol 1. 在一个固定体积的密闭容器中,加入2molA和2molB,发生如下反应:
2A(气)+ 2B(气) 3C(气)+ D(气),达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列配比作为起始物质达到平衡后,C的浓度仍为Wmol/L的是( )
A 2molA+2molB+3molC+1molD
B 3molC+1molD+1molB
C 3molC+1molD
D 1molA+0.5molB+1.5molC+0.5molD C2.在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA,0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为( )
A、1 B、2 C、3 D、4B在恒温恒压下,按不同的投料方式进行如下反应
N2 + 3H2 2NH3
1mol 3mol 0mol
2mol 6mol 0mol
(3) 2mol 6mol 2mol
以上哪些投料方式在反应达到平衡后,NH3
在平衡混合物中的体积百分含量相同?由此得出
什么规律?定温(T)定压(p)条件下的等效平衡改变起始加入情况,只要按化学计量数换算成同一边物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效将1molN2和3molH2充入一可变容积的密闭容器中,在适当温度和催化剂作用下发生反应N2 + 3H2 2NH3,反应达平衡后测得NH3的体积分数为m,若T、P恒定,起始时充入:xmolN2、ymolH2和zmolNH3,这样为保持平衡时NH3的体积分数仍为m,则x、y、z之间必须满足的一般关系是___________。 外界条件:1、相同温度 相同容积
2、相同温度、相同压强化学反应:1、反应前后体积不变
2、反应前后体积改变等同: 1、达到平衡时,浓度相同
2、达到平衡时,各组分的
百分含量相同某T下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:[1]若X=0,Y=0,则Z=————。
[2]若X=0.75,Y=————,Z=————。
[3]X、Y、Z应满足的一般条件是————。
(2)恒定T、P: [1]若X=0、Y=0,则Z=————。
[2]若X=0.75,则Y=————,Z=————。
[3]X、Y、Z应满足的一般条件是————。
意(2)反应物不能完全转化为生成物。⑶ 使用“ ”正向反应:反应物→生成物 即SO2→SO3逆向反应:生成物→反应物 即SO3→ SO22、化学平衡:(1)、定义:化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。强调三点前提条件:可逆反应实质:ν(正)=ν(逆)标志:反应混合物中各组分的浓度保持不变的状态动态平衡(正逆反应仍在进行)正反应速率=逆反应速率可逆反应 H2+I2≒2HI①逆:②等:③动:④定:反应混合物中各组分的浓度保持不变(不一定相等)⑤变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。⑥同: 对于一个特定的可逆反应如果条件相同,不管采取何种方式和途径进行最终能达到相同平衡状态, 与反应途径无关-等效平衡(2)、化学平衡状态的特征为了减轻汽车尾气对城市空气的污染,人们提出通过以下反应来处理汽车尾气:
2NO(g)+2CO(g)=N2(g)+2CO2(g),上节课中我们已经证明了该反应完全可以自发进行,可是反应进行的程度有多大呢?为了寻找定量描述化学反应限度的方法,人们对许多化学平衡体系的数据进行了分析,终于发现:化学平衡常数可以表征化学反应限度的相对大小。化学平衡与化学平衡常数交流·研讨问题1:请根据表中的实验数据计算平衡时的 [HI]2/[H2][I2] 的值,将结果填入表中。实验测得反应H2(g)+ I2(g) 2HI(g)
在698.6K时各物质的初始浓度和平衡浓度。 问题2︰请分析计算所得数据,寻找其中的规律。不管H2,I2和HI的初始浓度是多大,只要保持反应体系的温度不变,达到化学平衡状态后, 就为常数。思考 发现我们通常把这个常数称为化学平衡常数试一试1、写出反应:2SO2(g) + O2(g) 2SO3(g)的化学平衡常数表达式,并判断K的单位。
2、对于任一可逆反应:
aA(g)+bB(g) cC(g)+ dD(g),试写出其化学平衡常数的表达式。对于一般的反应aA +bB cC + dD
当温度一定,达到化学平衡时,其平衡常数表达式:注意:平衡常数表达式中不包括固体和纯液体物质的浓度项(因为它们的浓度为常数),只包括气态物质和溶液中各溶质的浓度。一、化学平衡常数拓展练习问题:通过上面的练习,你在书写平衡表达式时 有了哪些发现?
1、对于一个反应,其平衡常数的表达式是唯一的吗?平衡常数的表达式与哪些因素有关?
2、对于一个反应,正、逆反应的平衡常数之间有何关系?
3、如果浓度的单位是mol/L,将浓度单位代入平衡常数表达式,可得到K的单位。请写出上表中后三个反应的K的单位,并分析K的单位与反应的化学方程式之间有什么关系?思考平衡常数表达式与化学方程式的书写方式有关。
1、对于同一化学反应,由于书写方式不同,各反应物、生成物的系数不同,平衡常数的表达式就不同。
2、对于给定的化学反应,正、逆反应的平衡常数互为倒数。
3、平衡常数的单位也与化学方程式的表示形式相对应。
发现二、平衡常数表达式书写的注意事项 在2000K时,反应CO(g)+1/2O2(g) CO2(g) 的平衡常数为K1,则相同温度下反应
2CO2(g) 2CO(g) + O2(g)的平衡常数K2为
( )
A、 1/K1 B、 K12 C、 1/K12 D、 K1-1/2C巩固练习平衡常数的应用 ⑴判断反应可能进行的程度,估计反应的可能性。K>105时, 基本完全反应。
K在10-5~105之间 可逆反应。
K<10-5时, 很难反应。资料在线K值越大,反应越完全,K值越小,反应越不完全K的大小只能预示反应所能进行的最大程度交流·研讨请通过以下各反应平衡常数的数值,讨论反应可能进行的程度:
⑵判断反应进行的方向、反应是否达到平衡状态Q=K时,反应已达平衡;
Q>K时,反应逆向进行
Q
8000C,K=1
试推导在下列浓度下反应进行的方向向逆平衡向正对于反应: CO(g)+H2O(g) CO2(g)+H2 [CO2] [H2] Qc= . [CO] [H2O] 0.4mol.L-1×0.4 mol.L-1 Qc1= =1.07>K 向逆 0.3mol.L-1×0.5 mol.L-1 0.5mol.L-1×0.6 mol.L-1 Qc2= =1.0=K 平衡 1.0mol.L-1×0.3 mol.L-1 0.7mol.L-1×1.7 mol.L-1 Qc3= =0.93
(1)此反应的平衡常数。
(2)求SO2(g)和O2(g)的平衡转化率由例1可知,一个已标明化学方程式的化学反应,在温度一定时虽然只有一个平衡常数,但是不同反应物的平衡转化率可能不同。因此,脱离具体的反应物谈化学平衡转化率是没有意义的。(2)、已知平衡转化率和初始浓度求平衡常数
例2:反应SO2(g)+ NO2(g) SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2mol/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求:在该温度下。
(1)此反应的平衡常数。
(2)若SO2(g)的初始浓度增大到3mol/L, NO2(g)的初始浓度仍为2mol/L,则SO2(g)的转化率变为多少?(1)K=1(2) SO2的转化率为40%(3)、已知平衡常数和初始浓度求平衡浓度及转化率。
例3、在1200℃时测得下列反应达平衡时,k=2.25.
CO2(g)+H2(g) CO(g)+H2O(g) 。若反应从CO2(g)和H2(g)开始,且CO2(g)和H2(g)的初始浓度分别为A、B、C三种情况。试计算A情况下各物质的平衡浓度及CO2(g)和H2(g)平衡转化率。 将根据B、C组数据计算各物质的平衡浓度和平衡
转化率(α),分析结果,得出什么结论? 化学平衡常数与转化率的区别和联系
由化学平衡常数K可以推断反应进行的 ,K越大,说明反应进行的越 ,反应物的转化率也越 ,但K只与 有关;转化率也可以表示某一可逆反应进行的 ,α越大,反应进行的越 ,但是α与反应物的起始浓度等因素有关,转化率变化了,
K 变化。 程度完全高温度程度完全不三、 反应条件对化学平衡的影响对于可逆反应N2(g)+3H2(g) 2NH3(g),在一定条件下,当正反应速率和逆反应速率相等时,该反应就达到了平衡状态,反应进行到了最大限度。如果改变条件,正反应速率和逆反应速率不再相等,这个平衡就要被破坏,在新的条件下建立起新的平衡。这样由一个平衡状态变为另一个平衡状态的过程,称为化学平衡移动。如果平衡移动的结果使NH3的物质的浓度变大,则称平衡正向或向右移动;反之称平衡逆向移动或向左移动。 你知道哪些外部条件可引起化学速率的改变 温度、浓度、压强、催化剂等外部条件的改变可能引起化学反应速率的改变。 这些条件的改变会对化学平衡产生怎样
的影响呢? 2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 温度对化学平衡的影响2NO2(g) N2O4(g) △H=-57.2kJ·mol-1
红棕色 无色 减小正向增大逆向温度对化学平衡的影响正 向正 向 升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动。交流 研讨 温度对化学平衡的影响是通过改变平衡常数实现的。交流 研讨 在一定体积的 密闭容器中,反应CO2(g) + H2(g)
CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填”吸热”或”放热”)。
(3)某温度下,平衡浓度符合下式:
c(CO2)c(H2) =c(CO) c(H2O),可判断此时的温度为 ℃。吸热830迁移 应用正 向逆 向 请根据反应 Fe3+(aq) + 3SCN-(aq) Fe(SCN)3(aq)的平衡常数K 与
浓度商Q = 的关系,讨论改变反应物或生成物浓度对化学
平衡的影响。
Q < KQ > K交流 研讨 请根据提供的试剂和仪器,按照设计的实验
方案证明上述预测。
试剂:0.01 mol·L-1 FeCl3溶液、0.03 mol·L-1KSCN溶液、
1mol·L-1 FeCl3溶液、1mol·L-1KSCN溶液
仪器:胶头滴管、点滴板等
溶液呈血红色后加深溶液呈血红色后加深 请根据提供的试剂和仪器,按照设计的实验方 案证明上述预测。
试剂:0.01 mol·L-1 FeCl3溶液、0.03 mol·L-1KSCN溶液、
1mol·L-1 FeCl3溶液、1mol·L-1KSCN溶液
仪器:胶头滴管、点滴板等
改变浓度,若Q
正向移动 2SO2(g) + O2(g) 2SO3(g) △H = _ 197.8kJ·mol-1
是硫酸制造工业的基本反 应。在生产中通常采用通入过量的空气的方法。为什么? 提高O2在原料气中的比例,使SO2的平衡转化率提高,从而降低生产成本。原平衡状态 新平衡状态 平 衡 移 动浓度
借助Q与K的相对大小进行判断温度
温度对化学平衡的影响是
通过改变平衡常数来实现的精题点拨 在一定条件下,反应CO + NO2 CO2 + NO达到平衡后,降低温度,混合气体的颜色变浅。下列判断正确的是( )
A. 正反应为吸热反应
B. 正反应为放热反应
C. CO的平衡转化率降低
D. 各物质的浓度不变B 1.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。其化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动练习BD练习 2.在一定条件下,反应H2(g)+Br2(g) 2HBr(g) 的△H<0,达到化学平衡状态且其它条件不变时:
(1)如果升高温度,平衡混合物的颜色 ;
(2)如果在体积固定的容器中加入一定量的氢气,化学平衡 移动,Br2(g)的平衡转化率 (变大、变小或不变)。 3.铬酸钾(K2CrO4)与重铬酸钾(K2Cr2O7)有如下转化:
2CrO42-+ 2H+ Cr2O72- + H2O
黄色 橙红色
已知重铬酸钾的稀溶液呈橙红色。
(1)向重铬酸钾的稀溶液中加入NaOH,溶液呈 色;
(2)向 (1)的溶液中再加入过量的H2SO4,溶液呈 色;
(3)向重铬酸钾的稀溶液中加入Ba(NO3)2溶液(BaCrO4为 黄色沉淀),则平衡向 移动(填“左”或“右”)。变深正向变大黄橙红左一定温度下,在密闭容器中发生的反应
2NO2(g) N2O4(g); △H<0向吸热方向移动向放热方向移动正向移动逆向移动一定温度下,在密闭容器中发生的反应
2NO2(g) N2O4(g); △H<0 假设 K的数值为a正向移动逆向移动2a计算Q的数值并判断平衡移动的方向。三支针筒中均抽入10mlNO2气体,将针筒前端闭。
原理:N2O4 2NO2
(1)将第二支针筒活塞迅速推至5ml处(现象如下图中
a b c 所示)
(2)将第三支针筒活塞迅速拉至20ml处。(现象如下图中A1 b1 c1 所示)
请观察针筒中气体颜色变化,并尝试用化学平衡移动的观点进行解释。a1b1c1[观察.思考]bcaT℃时,在密闭容器中发生的反应
2NO2(g) N2O4(g);△H<0假设K的数值为a先变深后变浅先变浅后变深V↓c(NO2)↑,平衡正移c(NO2)↓ V↑c(NO2)↓,平衡逆移c(NO2)↑a1b1c1bca在T℃时对下列处于化学平衡的三个反应将压强均增加至2倍(假设三个反应在T℃时的K的数值分别为a、b、c)正向气态物质系数减小(△υ g<0 )正向移动b不移动4c逆向移动1、计算② 、 ③ Q的数据,判断加压平衡的移动方向。
2、根据上表思考讨论:加压后平衡移动方向与△υ g的关系。
气态物质系数不变(△υ g=0 )正向气态物质系数增大(△υ g>0 )对于只涉及固体或液体的反应,压强的影响极其微弱,可以不予考虑B:减小压强,会使化学平衡向着气体体积增大的方向移动。3、压强对化学平衡的影响结论: (在其它条件不变的情况下)(对于反应前后气体体积改变的反应)A:增大压强,会使化学平衡向着气体体积缩小的方向移动。(对于反应前后气体体积不变的反应)特例: 改变压强,化学平衡不移动。再如:向气体体积缩小的方向移动向气体体积增大的方向移动 N2(气) + 3H2 (气) 2NH3(气)4500C时N2与H2反应合成NH3的数据分析:煤气中毒病人血液中的化学平衡:
CO (g) + Hb(O2) O2(g) + Hb(CO)
K= 思考:应用化学平衡移动原理分析讨论
煤气 中毒 后应采取那些抢救措施? 在密闭容器中的反应2NO2(g) N2O4(g); △H<0
若仅改变影响平衡的一个条件,完成下表向吸热方向移动减弱温度的升高向放热方向移动减弱温度的降低正向移动减弱c(NO2)的增大逆向移动减弱c(NO2)的减小正向移动逆向移动减弱压强的增大减弱压强的减小 根据上表可以看出: 在密闭体系中,如果仅改变影响平衡的一个条件 ( 如 温度、浓度、压强 )平衡将 向 _______________方向移动。减弱这个改变的早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:改变影响化学平衡的一个因素,平衡将向能够减弱这种改变的方向移动。减弱的双重含义:
精析精练P41(反应达到平衡状态)
化学反应的限度平衡常数转化率第2节知识小结检测反馈题
1. 压强变化不会使下列化学反应的平衡发生移动的 是( )
H2(g)+I2(g) 2HI(g)
3H2(g)+N2(g) 2NH3(g)
2SO2(g)+O2(g) 2SO3(g)
C(s)+CO2(g) 2CO(g)A2. 促使化学平衡
3H2(g)+N2(g) 2NH3(g); △H<0
正向移动有各种措施,下列措施可行的是( )
升高温度 B. 增大体系压强
C. 增大c(N2) D. 容器体积增大BC3、下列关于平衡常数K和平衡转化率α的 说法中正确的是( )
A、在任何条件下,化学平衡常数都是一个 恒定值
B、改变反应物浓度或生成物浓度都会改变 α和K
C、K和α只与温度有关,与反应物浓度、 压强无关
D、K和α的大小都可以定量描述一个化学 反应的限度
D4、在557℃密闭容器中进行的反应及条件:
CO(g)+H2O(g) CO2(g)+H2(g)
起始浓度: 2mol·L-1 3mol·L-1 0 0
变化浓度:
平衡浓度: 1.2mol·L-1
请计算:
(1)此反应的平衡常数K=
(2)平衡时α(CO)=
(3)平衡时α( H2O)= 160%40%5. 下列平衡体系中,升温或减压都使平衡正向移动的是 ( )A. 3H2(g)+N2(g) 2NH3(g); △H<0
B. 2NO(g) N2(g)+O2(g) ; △H > 0
C. C(s)+H2O(g) CO(g)+ H2(g) ;△H>0
D. 2SO2(g)+O2(g) 2SO3(g) ; △H<0C作业:
1.完成课本52页第3、4、6题。
2.查找资料,分析工业合成氨是如何利
用化学平衡移动规律提高转化率的?等效平衡 等效平衡
对于同一可逆反应,达平衡时,任何相同的组分的含量(体积、物质的量)均对应相同,这样的化学平衡互称为等效平衡。在恒温恒容下,按不面同的投料方式进行反应
平衡后各体系内相同组分浓度是否对应相同 三条途径最终达同一平衡,
由此得出什么规律? 在定温定容的条件下,对于反应前后气体分子数改变的可逆反应,只改变起始加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一边物质的物质的量与原平衡相同,则两平衡等效.定温(T)定容(V)条件下的等效平衡 CO(g) + H2O(g) CO2(g) + H2(g)
(1) 1mol 1mol 0 mol 0 mol
(2) 0 mol 0 mol 2 mol 2 mol
“一边倒” 2 mol??? 2 mol??????? 0 mol?? 0 mol (3) 0 mol 1 mol 1 mol 1 mol
“一边倒” 1mol??? 2 mol??????? 0 mol?? 0 mol 1. 在一个固定体积的密闭容器中,加入2molA和2molB,发生如下反应:
2A(气)+ 2B(气) 3C(气)+ D(气),达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列配比作为起始物质达到平衡后,C的浓度仍为Wmol/L的是( )
A 2molA+2molB+3molC+1molD
B 3molC+1molD+1molB
C 3molC+1molD
D 1molA+0.5molB+1.5molC+0.5molD C2.在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA,0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为( )
A、1 B、2 C、3 D、4B在恒温恒压下,按不同的投料方式进行如下反应
N2 + 3H2 2NH3
1mol 3mol 0mol
2mol 6mol 0mol
(3) 2mol 6mol 2mol
以上哪些投料方式在反应达到平衡后,NH3
在平衡混合物中的体积百分含量相同?由此得出
什么规律?定温(T)定压(p)条件下的等效平衡改变起始加入情况,只要按化学计量数换算成同一边物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效将1molN2和3molH2充入一可变容积的密闭容器中,在适当温度和催化剂作用下发生反应N2 + 3H2 2NH3,反应达平衡后测得NH3的体积分数为m,若T、P恒定,起始时充入:xmolN2、ymolH2和zmolNH3,这样为保持平衡时NH3的体积分数仍为m,则x、y、z之间必须满足的一般关系是___________。 外界条件:1、相同温度 相同容积
2、相同温度、相同压强化学反应:1、反应前后体积不变
2、反应前后体积改变等同: 1、达到平衡时,浓度相同
2、达到平衡时,各组分的
百分含量相同某T下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:[1]若X=0,Y=0,则Z=————。
[2]若X=0.75,Y=————,Z=————。
[3]X、Y、Z应满足的一般条件是————。
(2)恒定T、P: [1]若X=0、Y=0,则Z=————。
[2]若X=0.75,则Y=————,Z=————。
[3]X、Y、Z应满足的一般条件是————。
