盐类的水解课件 鲁科版选修4
图片预览








文档简介
课件24张PPT。化学源于生产、生活,化学必将
服务于生产、生活……
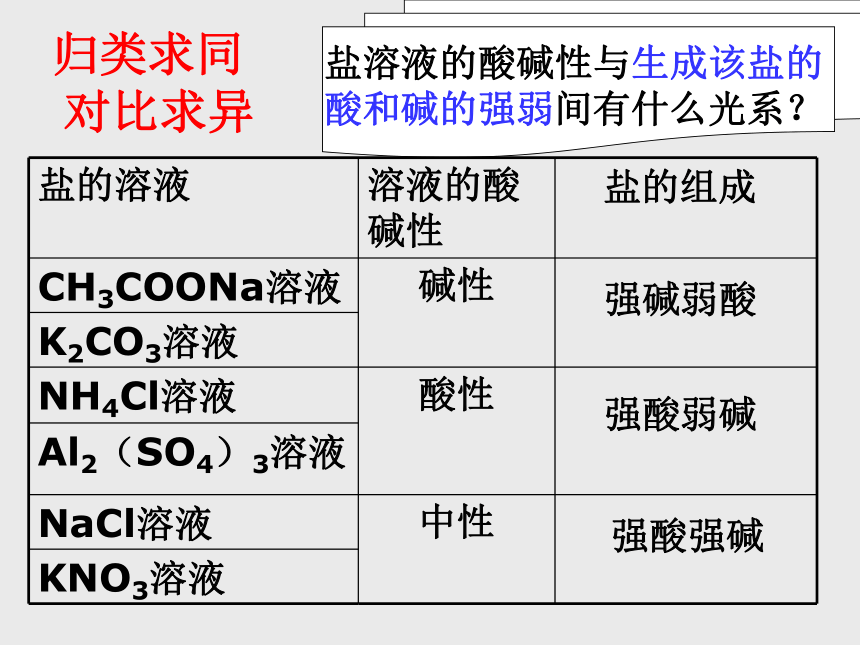
草木灰(主要成分为K2CO3)和铵态氮肥(如主要成分为NH4Cl)为什么不能混合使用?同学们,你们是否想过:
有两盐溶液:
第一组: CH3COONa溶液、NH4Cl溶液、 NaCl溶液;
第二组:K2CO3溶液、Al2(SO4)3溶液、 KNO3溶液;
请同学们设计实验方案测定其酸碱性。实验探究现象与结论碱性碱性中性酸性酸性中性>7>7<7<7=7=71、盐溶液的酸碱性是随机出现的,还是
有规律可循呢?2、有规律可循!用什么方法总结现象背
后的规律?思考与总结归类求同
对比求异强碱弱酸强酸弱碱强酸强碱盐溶液的酸碱性与生成该盐的
酸和碱的强弱间有什么光系?为什么盐的组成不同,溶液的酸碱性
就不同呢?请以CH3COONa、NH4Cl、
NaCl为例展开分析讨论。理论探究盐类的水解定义:在溶液中盐电离出来的离子跟
水所电离出来的H+或OH-结合生成
弱电解质的反应,叫做盐类的水解。实质:弱电解质的生成破坏了水的电
离平衡,增大了水的电离程度并
且常常使溶液呈酸性或碱性。弱酸阴离子或
弱碱阳离子弱酸或弱碱思考填空CH3COONa能弱酸
阴离子促进水
的电离碱性NH4Cl能弱碱
阳离子促进水
的电离酸性NaCl不能 无无中性规律:有__才水解;无__不水解;
谁__谁水解;谁__显谁性。
(填强或弱)弱弱强弱 在溶液中,不能发生水解的离子是( )
A、ClO - B、CO32-
C、Fe3+ D、SO42--D随堂练习下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
(1) FeCl3 (2) NaClO (3) (NH4)2SO4
(4) AgNO3 (5)Na2S (6)K2SO413425随堂练习盐类水解的表示方法(1)一元弱酸强碱盐和一元弱碱强酸盐(2)多元弱酸强碱盐(正盐)由于多元弱酸的电离是分步进行的,所以多元弱酸的酸根离子的水解电离是分步进行的(3)多元弱碱强酸盐尽管多元弱碱的电离是分步进行的,但在中学化学里不要求分步表示多元弱碱的电离反思总结一书写盐类水解离子方程式的注意事项1、盐类水解是可 逆 的,生成符号应写可 逆 号; 2、水解是微弱的,生成物中不应出现沉淀符号,也不应出现气体符号;3、多元弱酸阴离子的水解要分步书写。反思总结二 请写出KF、Na2S 和 MgCl2发生水解
反应的离子方程式。随堂练习1、科学知识
2、学习方法课堂小结盐类水解的过程中正确的说法是( )
A.盐的电离平衡破坏
B.水的电离平衡发生移动
C.溶液的pH减小
D.没有发生中和反应 B随堂练习D下列水解离子方程式正确的是 ( )
A、Fe3++3H2O Fe(OH)3↓+3H+
B、Br-+H2O HBr+OH-
C、CO32-+H2O H2CO3+2OH-
D、NH4++ H2O NH3.H2O +H+ 随堂练习 氯化氨溶液中离子浓度从大到小排列正确的是 ( )
A.NH4+、H+、OH -、Cl-
B.Cl-、NH4+、H+、OH -
C.H+、Cl-、NH4+、OH -
D.Cl-、NH4+、OH -、H+
B随堂练习1、为什么热的碱液(Na2CO3溶液)去油污的能力较强?盐类的水解平衡会受哪些因素的影响?
2、我们只总结了强酸强碱盐和强酸弱碱盐、强碱弱酸盐的水解情况,那么弱酸弱碱盐是否水解呢?其溶液是酸性?碱性?中性?
3、如何利用盐类的水解为生产、生活服务?拓展与延伸氯化铵在溶液中的变化:醋酸根离子钠离子硫酸铝溶液和碳酸氢钠溶液混合生成二氧化碳?
服务于生产、生活……
草木灰(主要成分为K2CO3)和铵态氮肥(如主要成分为NH4Cl)为什么不能混合使用?同学们,你们是否想过:
有两盐溶液:
第一组: CH3COONa溶液、NH4Cl溶液、 NaCl溶液;
第二组:K2CO3溶液、Al2(SO4)3溶液、 KNO3溶液;
请同学们设计实验方案测定其酸碱性。实验探究现象与结论碱性碱性中性酸性酸性中性>7>7<7<7=7=71、盐溶液的酸碱性是随机出现的,还是
有规律可循呢?2、有规律可循!用什么方法总结现象背
后的规律?思考与总结归类求同
对比求异强碱弱酸强酸弱碱强酸强碱盐溶液的酸碱性与生成该盐的
酸和碱的强弱间有什么光系?为什么盐的组成不同,溶液的酸碱性
就不同呢?请以CH3COONa、NH4Cl、
NaCl为例展开分析讨论。理论探究盐类的水解定义:在溶液中盐电离出来的离子跟
水所电离出来的H+或OH-结合生成
弱电解质的反应,叫做盐类的水解。实质:弱电解质的生成破坏了水的电
离平衡,增大了水的电离程度并
且常常使溶液呈酸性或碱性。弱酸阴离子或
弱碱阳离子弱酸或弱碱思考填空CH3COONa能弱酸
阴离子促进水
的电离碱性NH4Cl能弱碱
阳离子促进水
的电离酸性NaCl不能 无无中性规律:有__才水解;无__不水解;
谁__谁水解;谁__显谁性。
(填强或弱)弱弱强弱 在溶液中,不能发生水解的离子是( )
A、ClO - B、CO32-
C、Fe3+ D、SO42--D随堂练习下列盐的水溶液中,哪些呈酸性( )
哪些呈碱性( )
(1) FeCl3 (2) NaClO (3) (NH4)2SO4
(4) AgNO3 (5)Na2S (6)K2SO413425随堂练习盐类水解的表示方法(1)一元弱酸强碱盐和一元弱碱强酸盐(2)多元弱酸强碱盐(正盐)由于多元弱酸的电离是分步进行的,所以多元弱酸的酸根离子的水解电离是分步进行的(3)多元弱碱强酸盐尽管多元弱碱的电离是分步进行的,但在中学化学里不要求分步表示多元弱碱的电离反思总结一书写盐类水解离子方程式的注意事项1、盐类水解是可 逆 的,生成符号应写可 逆 号; 2、水解是微弱的,生成物中不应出现沉淀符号,也不应出现气体符号;3、多元弱酸阴离子的水解要分步书写。反思总结二 请写出KF、Na2S 和 MgCl2发生水解
反应的离子方程式。随堂练习1、科学知识
2、学习方法课堂小结盐类水解的过程中正确的说法是( )
A.盐的电离平衡破坏
B.水的电离平衡发生移动
C.溶液的pH减小
D.没有发生中和反应 B随堂练习D下列水解离子方程式正确的是 ( )
A、Fe3++3H2O Fe(OH)3↓+3H+
B、Br-+H2O HBr+OH-
C、CO32-+H2O H2CO3+2OH-
D、NH4++ H2O NH3.H2O +H+ 随堂练习 氯化氨溶液中离子浓度从大到小排列正确的是 ( )
A.NH4+、H+、OH -、Cl-
B.Cl-、NH4+、H+、OH -
C.H+、Cl-、NH4+、OH -
D.Cl-、NH4+、OH -、H+
B随堂练习1、为什么热的碱液(Na2CO3溶液)去油污的能力较强?盐类的水解平衡会受哪些因素的影响?
2、我们只总结了强酸强碱盐和强酸弱碱盐、强碱弱酸盐的水解情况,那么弱酸弱碱盐是否水解呢?其溶液是酸性?碱性?中性?
3、如何利用盐类的水解为生产、生活服务?拓展与延伸氯化铵在溶液中的变化:醋酸根离子钠离子硫酸铝溶液和碳酸氢钠溶液混合生成二氧化碳?
