化学:第五单元第三节 酸和碱的性质教案(鲁教版九年级)
文档属性
| 名称 | 化学:第五单元第三节 酸和碱的性质教案(鲁教版九年级) |
|
|
| 格式 | rar | ||
| 文件大小 | 26.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-08-06 00:00:00 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
课题 酸和碱的性质
(1)知识与技能
①认识酸和碱的化学性质;
②理解酸的碱的化学性质的实质就是H+和OH—的性质;
(2)过程与方法
①初步认识复分解反应,会书写常见复分解反应的化学方程式;
(3)情感、态度与价值观
通过对酸和碱性质的开放性探究活动,引领学生进一步发展科学探究能力。
CaCO3+2HCl==CaCl2+H2O+CO2↑
(2)检验CO2气体的方法:Ca(OH)2+CO2==CaCO3↓+H2O(3)酸碱指示剂,酸碱性与pH的关系
重点 常见酸和碱的化学性质,酸的通性,浓硫酸的稀释和使用
难点 复分解反应及发生的条件
方法、技巧与规律小结 ⑴掌握物质的特殊性与普遍性的关系,采用演绎归纳法总结酸碱的共性,并推广到一般酸或碱的性质。⑵注重知识的连贯性和一致性,采用列表比较法,使化学学习变得有规律可循,使零散的化学知识变得合理清晰,便于掌握。⑶本节知识与生产、生活息息相关,注意把知识与生产生活联系,把化学知识运用到生产生活中,达到学以致用的目的。
思维误区 (1)本节知识中,复分解反应条件的判断,是本节的易错点,由于开始时不熟悉物质的溶解性,造成错误的判断。(2)本节知识中浓硫酸和氢氧化钠都具有吸水性,都可作干燥剂,但干燥的原理不同,因此应针对不同物质的性质选择不同的干燥剂,这是易混点。
考点
1、酸和碱的化学性质以及在实践中的应用是中考命题的重点,主要考查酸或碱的性质,常见题型为填空题。
2、几种重要的酸和碱,以及它们在工农业生产中的应用,结合日常生活、生产实际考查,常见题型为选择题、简答题和实验探究题。
3、复分解反应及发生的条件,通常以判断溶液物质或离子共存的题目,常见题型为选择题。
课 题 第三节 酸和碱的性质 课 型 新 授
第 1课时 第 周 年 月 日
教学目标 1、认识酸的化学性质;2、理解酸的碱的化学性质的实质就是H+和OH—的性质。
学情分析 通过前面的学习,学生对酸碱有了初步的认识,学会了检验溶液酸碱性的方法,但酸和碱有哪些性质?有哪些普遍性和特殊性?这些问题既是学生头脑中真实存在的问题,又是很容易引发学生思考的问题,所以本节的教学起点应定位在酸和碱的性质实验上,从而引发一系列有关酸、碱性质的探究活动。
重 点 酸的性质。常见酸和碱的化学性质,酸的通性,浓硫酸的稀释和使用
难 点 常见酸的化学性质,酸的通性,浓硫酸的稀释和使用
关 键 点 实验的规范操作
教学媒体 仪器和药品:试管、玻璃棒、烧杯、生锈铁钉、氯化铜溶液、盐酸、镁条、碳酸钙、浓硫酸等。
教学方法 提出问题—设计实验—实验探究—收集数据—归纳结论
板 书 设 计
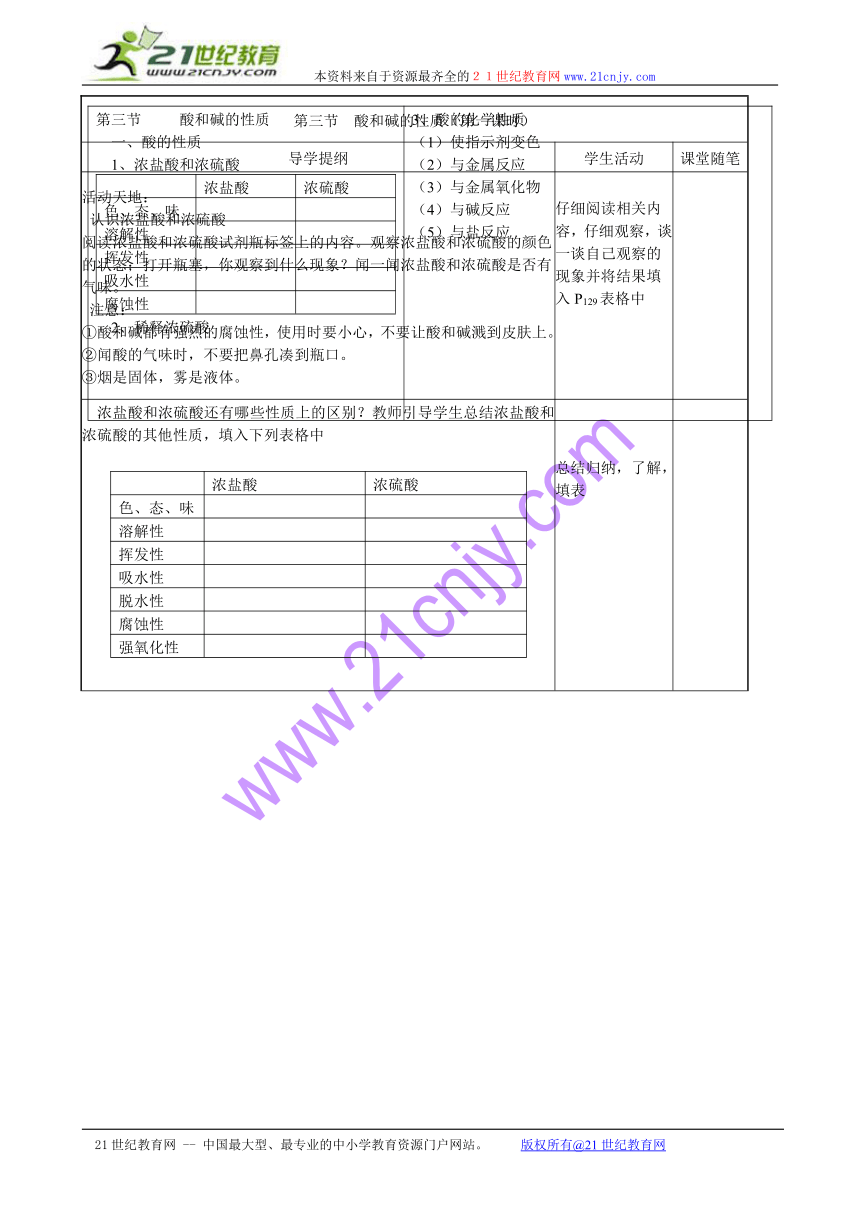
第三节 酸和碱的性质一、酸的性质1、浓盐酸和浓硫酸浓盐酸浓硫酸色、态、味溶解性挥发性吸水性腐蚀性2、稀释浓硫酸 3、酸的化学性质(1)使指示剂变色(2)与金属反应(3)与金属氧化物(4)与碱反应(5)与盐反应
第三节 酸和碱的性质(第一课时)
导学提纲 学生活动 课堂随笔
认识浓盐酸和浓硫酸
注意:
①酸和碱都有强烈的腐蚀性,使用时要小心,不要让酸和碱溅到皮肤上。
②闻酸的气味时,不要把鼻孔凑到瓶口。
③烟是固体,雾是液体。 仔细阅读相关内容,仔细观察,谈一谈自己观察的现象并将结果填入P129表格中
浓盐酸和浓硫酸还有哪些性质上的区别?教师引导学生总结浓盐酸和浓硫酸的其他性质,填入下列表格中
总结归纳,了解,填表
演示实验:稀释浓硫酸稀释浓硫酸时,一定要把_________沿器壁慢慢注入______里,并_________________。且不可_____________________! 若浓硫酸倒入水中会怎样? 领悟稀释浓硫酸的方法和要小心的原因;大胆猜测
实验探究:盐酸能与哪些物质发生化学反应?稀硫酸呢? (教师巡视,个别指导,规范操作)反应物盐酸稀硫酸镁条或铁丝(金属)生锈铁钉或氧化铜(金属氧化物)碳酸钙或碳酸钠(盐)氢氧化钠或氢氧化钙(碱) 利用提供的仪器、药品进行实验,观察现象,并记录,写出反应的化学方程式。寻找反应共同点。
导学提纲 学生活动 课堂随笔
注意:CuCl2、CuSO4的水溶液为蓝色或蓝绿色FeCl3、Fe2(SO4)3的水溶液为黄色③FeCl2、FeSO4的水溶液为浅绿色 学生识记,便于以后应用
回顾与反思:回忆一下,探索过程中你有哪些收获呢? 说说自己在实验过程中知识、能力、方法等方面的收获。
思考:稀硫酸和稀盐酸和以上物质的反应中,现象相似,它们为什么具有相似的化学性质?归纳总结:稀盐酸、稀硫酸以及其他的酸溶液中都含有氢离子,所以它们具有相似的化学性质。 讨论、交流、评价
A、溶液的质量 B、溶质的质量
C、溶剂的质量 D、溶质的质量分数
2、下列说法不正确的是( )
A、酸和碱都有腐蚀性
B、稀释浓硫酸时要把水倒入浓硫酸中
C、打开盛浓盐酸的瓶盖,瓶口会冒出白烟
3、生锈的铁钉放入盐酸中,溶液变黄,常有气泡冒出。说明产生这种现象的原因,并写出有关的化学方程式。
4、下列物质与稀硫酸反应后,能得到硫酸亚铁的是( )
A、Fe2O3 B、Fe(OH)3 C、Fe D、Fe(OH)2 独立完成,小组互改,班内交流
完成课后练习,检查一下你的学习效果如何。
课 题 第三节 酸和碱的性质 课 型 新 授
第 2课时 第 周 年 月 日
教学目标 1、认识碱的化学性质;2、理解中和反应的实质就是H+和OH—的性质。
学情分析 通过前面的学习,学生对酸有了初步的认识,学会了酸的性质的实验方法,但碱有哪些性质?有哪些普遍性和特殊性?这些问题将引起学生继续思考的问题,所以本节的教学起点应定位在碱的性质实验上,从而引发一系列有关碱性质的探究活动。
重 点 碱的性质。常见的碱,碱的化学性质,碱的通性,中和反应
难 点 常见碱的化学性质,碱的通性,中和反应
关 键 点 实验的规范操作
教学媒体 仪器和药品:试管、玻璃棒、镊子、羊毛、氢氧化钙、氢氧化钠、氯化铜溶液、碳酸钙、生锈铁钉等。
教学方法 提出问题—设计实验—实验探究—收集数据—归纳结论
板 书 设 计
第三节 酸和碱的性质二、碱的性质1、氢氧化钙和氢氧化钠 氢氧化钠 氢氧化钙化学式俗名色、态水溶性腐蚀性吸水性2、生石灰 3、碱的化学性质(1)使指示剂变色(2)与非金属氧化物反应(3)与酸反应(4)与盐反应
第三节 酸和碱的性质(第二课时)
导学提纲 学生活动 课堂随笔
用镊子分别夹取(切勿用手拿)2~3块固体氢氧化钠和氢氧化钙,分别放入小烧杯中。
1、观察它们的颜色和状态。
2、在空气中放置一段时间,再观察颜色和状态的变化。 3、向盛有这两种固体的小烧杯中分别加入少量水,振荡,手摸杯壁并观察溶解情况。
4、用玻璃棒分别蘸少量两溶液在手上捻一捻,有什么感觉?(过后立即用水冲干净)
5、把一段羊毛线放入氢氧化钠溶液中,加热煮沸,观察变化。 仔细阅读相关内容,仔细观察,谈一谈自己观察的现象并将结果填入P132表格中
氢氧化钠和氢氧化钙还有哪些性质上的区别?教师引导学生总结氢氧化钠和氢氧化钙的其他性质,填入下列表格中
认真听取老师讲解,总结归纳, 填表,领悟氢氧化钠和氢氧化钙的性质。
归纳总结:氢氧化钠固体暴露在空气中容易吸收空气中的水蒸气而逐渐溶解,我们就说氢氧化钠易潮解。在使用氢氧化钠时,必须十分小心,防止眼睛、皮肤、衣服等被腐蚀,如果不慎沾在皮肤上,要立即用大量的水冲洗,然后再涂上硼酸溶液 氢氧化钙的水溶液俗称石灰水,氢氧化钙对皮肤、衣服等有腐蚀作用。氢氧化钙可由氧化钙和水反应生成反应的化学方程为:CaO+H2O=Ca(OH)2 除氢氧化钠、氢氧化钙外,常见的碱还有氢氧化钾(KOH)、氢氧化钡;[Ba(OH)2],氨水(NH3·H2O )等。 领悟使用氢氧化钠的方法和要小心的原因;熟记化学方程式并了解工业上生产生石灰的方法和生石灰常作干燥剂的原因
下列物质的名称、俗称、化学式对应关系正确的一组是( )
A、氢氧化钙、生石灰、Ca(OH)2
B、石灰水、熟石灰、Ca(OH)2
C、碳酸钠、火碱、Na2CO3、
D、氢氧化钠、苛性钠、NaOH 独立完成,小组互改
导学提纲 学生活动 课堂随笔
二、实验探究:
1、在3支试管中分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量氢氧化钠溶液。
2、另取3支试管,再次分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量澄清石灰水。
利用提供的仪器、药品进行实验,观察现象,并记录,写出反应的化学方程式。
反思评价:同学们对本实验还有什么不明白的地方,请提出。你们认为哪个小组的实验方案最合理,最简便,最有说服力?
仔细阅读相关内容,设计实验方案,将方案写在课本方框里。小组内交流实验方案,选择一种可行且简便易行的方案,进行实验。自由发言,客观评价
Na2CO3、
CuCl2(盐)
酸碱指示剂
先思考哪些物质间能发生化学反应,再试着写出有关的化学方程式,填入表格中。
注意:
Cu(OH)2为蓝色沉淀
①NaOH__________、________②氢氧化钡_________、______③CuOH__________、________④Cu(OH)2__________、______⑤氢氧化铁__________、_________。
2、能一次性鉴别澄清石灰水、稀盐酸、和食盐溶液的试剂是( )
识记
先听讲,熟悉碱的命名、溶解性,再做练习独立完成,小组互改,班内交流
阅读课文、讨论,思考、交流并回答问题
导学提纲 学生活动 课堂随笔
下列变化属于复分解反应的是( ) A、3NO2+H2O==2HNO3+NO
C、CaCO3+2HCl==CaCl2+H2O+CO2↑
D、2KMnO4==K2MnO4+MnO2+O2↑ 讨论,思考、交流并回答问题
挑战自我:完成课后练习,检查一下你的学习效果如何。 独立完成,小组互改,班内交流
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
课题 酸和碱的性质
(1)知识与技能
①认识酸和碱的化学性质;
②理解酸的碱的化学性质的实质就是H+和OH—的性质;
(2)过程与方法
①初步认识复分解反应,会书写常见复分解反应的化学方程式;
(3)情感、态度与价值观
通过对酸和碱性质的开放性探究活动,引领学生进一步发展科学探究能力。
CaCO3+2HCl==CaCl2+H2O+CO2↑
(2)检验CO2气体的方法:Ca(OH)2+CO2==CaCO3↓+H2O(3)酸碱指示剂,酸碱性与pH的关系
重点 常见酸和碱的化学性质,酸的通性,浓硫酸的稀释和使用
难点 复分解反应及发生的条件
方法、技巧与规律小结 ⑴掌握物质的特殊性与普遍性的关系,采用演绎归纳法总结酸碱的共性,并推广到一般酸或碱的性质。⑵注重知识的连贯性和一致性,采用列表比较法,使化学学习变得有规律可循,使零散的化学知识变得合理清晰,便于掌握。⑶本节知识与生产、生活息息相关,注意把知识与生产生活联系,把化学知识运用到生产生活中,达到学以致用的目的。
思维误区 (1)本节知识中,复分解反应条件的判断,是本节的易错点,由于开始时不熟悉物质的溶解性,造成错误的判断。(2)本节知识中浓硫酸和氢氧化钠都具有吸水性,都可作干燥剂,但干燥的原理不同,因此应针对不同物质的性质选择不同的干燥剂,这是易混点。
考点
1、酸和碱的化学性质以及在实践中的应用是中考命题的重点,主要考查酸或碱的性质,常见题型为填空题。
2、几种重要的酸和碱,以及它们在工农业生产中的应用,结合日常生活、生产实际考查,常见题型为选择题、简答题和实验探究题。
3、复分解反应及发生的条件,通常以判断溶液物质或离子共存的题目,常见题型为选择题。
课 题 第三节 酸和碱的性质 课 型 新 授
第 1课时 第 周 年 月 日
教学目标 1、认识酸的化学性质;2、理解酸的碱的化学性质的实质就是H+和OH—的性质。
学情分析 通过前面的学习,学生对酸碱有了初步的认识,学会了检验溶液酸碱性的方法,但酸和碱有哪些性质?有哪些普遍性和特殊性?这些问题既是学生头脑中真实存在的问题,又是很容易引发学生思考的问题,所以本节的教学起点应定位在酸和碱的性质实验上,从而引发一系列有关酸、碱性质的探究活动。
重 点 酸的性质。常见酸和碱的化学性质,酸的通性,浓硫酸的稀释和使用
难 点 常见酸的化学性质,酸的通性,浓硫酸的稀释和使用
关 键 点 实验的规范操作
教学媒体 仪器和药品:试管、玻璃棒、烧杯、生锈铁钉、氯化铜溶液、盐酸、镁条、碳酸钙、浓硫酸等。
教学方法 提出问题—设计实验—实验探究—收集数据—归纳结论
板 书 设 计
第三节 酸和碱的性质一、酸的性质1、浓盐酸和浓硫酸浓盐酸浓硫酸色、态、味溶解性挥发性吸水性腐蚀性2、稀释浓硫酸 3、酸的化学性质(1)使指示剂变色(2)与金属反应(3)与金属氧化物(4)与碱反应(5)与盐反应
第三节 酸和碱的性质(第一课时)
导学提纲 学生活动 课堂随笔
认识浓盐酸和浓硫酸
注意:
①酸和碱都有强烈的腐蚀性,使用时要小心,不要让酸和碱溅到皮肤上。
②闻酸的气味时,不要把鼻孔凑到瓶口。
③烟是固体,雾是液体。 仔细阅读相关内容,仔细观察,谈一谈自己观察的现象并将结果填入P129表格中
浓盐酸和浓硫酸还有哪些性质上的区别?教师引导学生总结浓盐酸和浓硫酸的其他性质,填入下列表格中
总结归纳,了解,填表
演示实验:稀释浓硫酸稀释浓硫酸时,一定要把_________沿器壁慢慢注入______里,并_________________。且不可_____________________! 若浓硫酸倒入水中会怎样? 领悟稀释浓硫酸的方法和要小心的原因;大胆猜测
实验探究:盐酸能与哪些物质发生化学反应?稀硫酸呢? (教师巡视,个别指导,规范操作)反应物盐酸稀硫酸镁条或铁丝(金属)生锈铁钉或氧化铜(金属氧化物)碳酸钙或碳酸钠(盐)氢氧化钠或氢氧化钙(碱) 利用提供的仪器、药品进行实验,观察现象,并记录,写出反应的化学方程式。寻找反应共同点。
导学提纲 学生活动 课堂随笔
注意:CuCl2、CuSO4的水溶液为蓝色或蓝绿色FeCl3、Fe2(SO4)3的水溶液为黄色③FeCl2、FeSO4的水溶液为浅绿色 学生识记,便于以后应用
回顾与反思:回忆一下,探索过程中你有哪些收获呢? 说说自己在实验过程中知识、能力、方法等方面的收获。
思考:稀硫酸和稀盐酸和以上物质的反应中,现象相似,它们为什么具有相似的化学性质?归纳总结:稀盐酸、稀硫酸以及其他的酸溶液中都含有氢离子,所以它们具有相似的化学性质。 讨论、交流、评价
A、溶液的质量 B、溶质的质量
C、溶剂的质量 D、溶质的质量分数
2、下列说法不正确的是( )
A、酸和碱都有腐蚀性
B、稀释浓硫酸时要把水倒入浓硫酸中
C、打开盛浓盐酸的瓶盖,瓶口会冒出白烟
3、生锈的铁钉放入盐酸中,溶液变黄,常有气泡冒出。说明产生这种现象的原因,并写出有关的化学方程式。
4、下列物质与稀硫酸反应后,能得到硫酸亚铁的是( )
A、Fe2O3 B、Fe(OH)3 C、Fe D、Fe(OH)2 独立完成,小组互改,班内交流
完成课后练习,检查一下你的学习效果如何。
课 题 第三节 酸和碱的性质 课 型 新 授
第 2课时 第 周 年 月 日
教学目标 1、认识碱的化学性质;2、理解中和反应的实质就是H+和OH—的性质。
学情分析 通过前面的学习,学生对酸有了初步的认识,学会了酸的性质的实验方法,但碱有哪些性质?有哪些普遍性和特殊性?这些问题将引起学生继续思考的问题,所以本节的教学起点应定位在碱的性质实验上,从而引发一系列有关碱性质的探究活动。
重 点 碱的性质。常见的碱,碱的化学性质,碱的通性,中和反应
难 点 常见碱的化学性质,碱的通性,中和反应
关 键 点 实验的规范操作
教学媒体 仪器和药品:试管、玻璃棒、镊子、羊毛、氢氧化钙、氢氧化钠、氯化铜溶液、碳酸钙、生锈铁钉等。
教学方法 提出问题—设计实验—实验探究—收集数据—归纳结论
板 书 设 计
第三节 酸和碱的性质二、碱的性质1、氢氧化钙和氢氧化钠 氢氧化钠 氢氧化钙化学式俗名色、态水溶性腐蚀性吸水性2、生石灰 3、碱的化学性质(1)使指示剂变色(2)与非金属氧化物反应(3)与酸反应(4)与盐反应
第三节 酸和碱的性质(第二课时)
导学提纲 学生活动 课堂随笔
用镊子分别夹取(切勿用手拿)2~3块固体氢氧化钠和氢氧化钙,分别放入小烧杯中。
1、观察它们的颜色和状态。
2、在空气中放置一段时间,再观察颜色和状态的变化。 3、向盛有这两种固体的小烧杯中分别加入少量水,振荡,手摸杯壁并观察溶解情况。
4、用玻璃棒分别蘸少量两溶液在手上捻一捻,有什么感觉?(过后立即用水冲干净)
5、把一段羊毛线放入氢氧化钠溶液中,加热煮沸,观察变化。 仔细阅读相关内容,仔细观察,谈一谈自己观察的现象并将结果填入P132表格中
氢氧化钠和氢氧化钙还有哪些性质上的区别?教师引导学生总结氢氧化钠和氢氧化钙的其他性质,填入下列表格中
认真听取老师讲解,总结归纳, 填表,领悟氢氧化钠和氢氧化钙的性质。
归纳总结:氢氧化钠固体暴露在空气中容易吸收空气中的水蒸气而逐渐溶解,我们就说氢氧化钠易潮解。在使用氢氧化钠时,必须十分小心,防止眼睛、皮肤、衣服等被腐蚀,如果不慎沾在皮肤上,要立即用大量的水冲洗,然后再涂上硼酸溶液 氢氧化钙的水溶液俗称石灰水,氢氧化钙对皮肤、衣服等有腐蚀作用。氢氧化钙可由氧化钙和水反应生成反应的化学方程为:CaO+H2O=Ca(OH)2 除氢氧化钠、氢氧化钙外,常见的碱还有氢氧化钾(KOH)、氢氧化钡;[Ba(OH)2],氨水(NH3·H2O )等。 领悟使用氢氧化钠的方法和要小心的原因;熟记化学方程式并了解工业上生产生石灰的方法和生石灰常作干燥剂的原因
下列物质的名称、俗称、化学式对应关系正确的一组是( )
A、氢氧化钙、生石灰、Ca(OH)2
B、石灰水、熟石灰、Ca(OH)2
C、碳酸钠、火碱、Na2CO3、
D、氢氧化钠、苛性钠、NaOH 独立完成,小组互改
导学提纲 学生活动 课堂随笔
二、实验探究:
1、在3支试管中分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量氢氧化钠溶液。
2、另取3支试管,再次分别放入生锈铁钉、氯化铜溶液、碳酸钠溶液,然后再向试管中分别加入少量澄清石灰水。
利用提供的仪器、药品进行实验,观察现象,并记录,写出反应的化学方程式。
反思评价:同学们对本实验还有什么不明白的地方,请提出。你们认为哪个小组的实验方案最合理,最简便,最有说服力?
仔细阅读相关内容,设计实验方案,将方案写在课本方框里。小组内交流实验方案,选择一种可行且简便易行的方案,进行实验。自由发言,客观评价
Na2CO3、
CuCl2(盐)
酸碱指示剂
先思考哪些物质间能发生化学反应,再试着写出有关的化学方程式,填入表格中。
注意:
Cu(OH)2为蓝色沉淀
①NaOH__________、________②氢氧化钡_________、______③CuOH__________、________④Cu(OH)2__________、______⑤氢氧化铁__________、_________。
2、能一次性鉴别澄清石灰水、稀盐酸、和食盐溶液的试剂是( )
识记
先听讲,熟悉碱的命名、溶解性,再做练习独立完成,小组互改,班内交流
阅读课文、讨论,思考、交流并回答问题
导学提纲 学生活动 课堂随笔
下列变化属于复分解反应的是( ) A、3NO2+H2O==2HNO3+NO
C、CaCO3+2HCl==CaCl2+H2O+CO2↑
D、2KMnO4==K2MnO4+MnO2+O2↑ 讨论,思考、交流并回答问题
挑战自我:完成课后练习,检查一下你的学习效果如何。 独立完成,小组互改,班内交流
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
