第二节 化学计量在化学实验中的应用(4)
文档属性
| 名称 | 第二节 化学计量在化学实验中的应用(4) |

|
|
| 格式 | rar | ||
| 文件大小 | 53.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-08-08 00:00:00 | ||
图片预览






文档简介
课件17张PPT。溶液配制和计算的有关问题一、配制物质的量浓度的溶液的相关问题
问题:如何配制100mL 1.00mol/LNaCl溶液?
实验步骤 计算:NaCl物质的量=1.00mol/L×0.1L=0.1mol
则NaCl质量=0.1mol×58.5g/mol=5.85g
称量:用托盘天平称量5.9gNaCl固体。
溶解:在烧杯中用适量蒸馏水使之完全溶解.
转移:将烧杯中液体沿玻璃棒注入100mL容量瓶中
洗涤:洗涤烧杯和玻璃棒2~3次
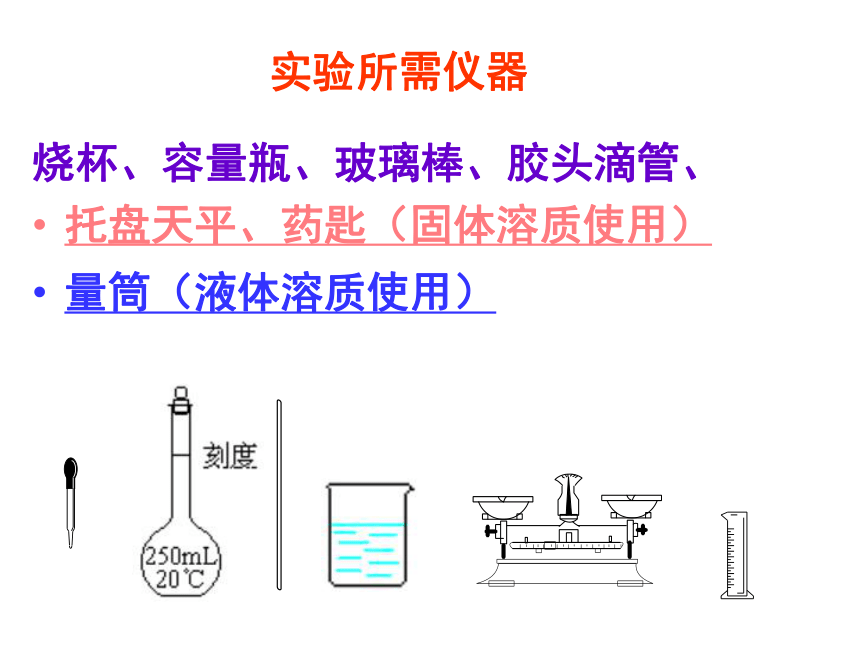
定容:加水到接近刻度1~2厘米时,改用胶头滴管加水到刻度,摇匀,装瓶. 思考:若溶质为液体物质,则操作上有何区别?第二步操作不用天平称量,而是用量筒量取。注意:应先在烧杯中加一定量的水,然后将浓硫酸沿玻璃棒慢慢注入水中,并不断搅拌,待冷却到室温后再转移到容量瓶中.若用浓硫酸配稀硫酸,具体应该怎样操作呢?实验所需仪器 烧杯、容量瓶、玻璃棒、胶头滴管、
托盘天平、药匙(固体溶质使用)、
量筒(液体溶质使用) 实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950mL,111.2g B.500mL,117g
C.1000mL,117g
D.任意规格,111.2gC随堂练习1用质量分数为98%、密度为1.84g/cm3的浓硫酸配制100mL 1.84mol/L的稀硫酸,若实验仪器有:
A.100mL量筒;B.托盘天平;
C.玻璃棒;D.50mL容量瓶;E.10mL量筒;F.胶头滴管;G.50mL烧杯;H.100mL容量瓶,实验时应选用仪器的先后顺序是(填入编号): 。 E、G、C、H、F随堂练习2讨论在配制溶液中哪些操作可能引起溶液浓度的误差? ?根据物质的量浓度定义式分析:
(1)影响nB(固体质量或液体体积等)
(2)影响溶液体积(溶解过程、转移过程、洗涤过程、定容过程等)讨论:下列操作会使实际所配得溶液物质的量浓度如何变化?
(1)称量NaCl时药品和砝码放反且使用游码
(2)未洗涤烧杯和玻璃棒
(3)转移时有溶液流出
(4)容量瓶中原来有水
(5)加水至刻度线后,上下颠倒摇匀,发现液面低于刻度线,又加水至刻度线(偏小)(偏小)(偏小)(无影响)(偏小)二、关于物质的量浓度的计算问题mol/L溶质B既可以是纯净物又可以是混合物,
还可以是指某种离子或分子。 例:有一瓶18.4mol/L的硫酸溶液1L,将其稀释到10L,请问,此溶液中H2SO4总的物质的量有没有变化?物质的量浓度有没有变化?如果有请计算出来。 n(H2SO4)浓=n (H2SO4)稀
C浓×V浓 = C稀×V稀
18.4mol/L×1L=C稀×10L
C稀=1.84mol/L 本质:稀释浓溶液时,溶液的体积要发生变化,但溶质的量(质量或物质的量)均不变公式:C浓×V浓 = C稀×V稀1、溶液的稀释【练习1 】要配制500mL 0.6mol/L 的NaOH溶液,需2 mol/L 的NaOH溶液多少毫升? 150mL【练习2】配制500mL1 mol/L的稀硫酸,需要的98%浓硫酸(已知其密度为1.84g/mL)多少毫升?27.2mL例 :50 mL 0.5 mol/L BaCl2 溶液和100 mL 0.5
mol/L NaCl溶液混合后,求溶液中Cl- 的物质的量
浓度(假设溶液体积变化忽略不计)。C (Cl-) = 50mL ×0. 5mol/L ×2 + 100mL ×0. 5mol/L 50mL+ 100mL = 0. 67 mol/ L 答: 溶液中Cl- 的物质的量浓度是 0.67 mol/L解:2、混合溶液物质的量浓度的计算3、溶液由气体溶解于水形成,如氯化氢气体溶于水形成盐酸。例:标准状况下,336L氯化氢气体溶于1L水中所得溶液密度为1.17g/cm3,求所得溶液物质的量浓度?
注意:
溶液的体积不能直接用气体的体积或水的体积或气体与水的体积之和,而必须是通过V = m / ρ 换算成质量 11.6mol/L【练习3 】标准状况下,将448L NH3 溶于1L 水中,得到密度为0.9 g/cm3 的氨水。求此氨水的物质的量浓度。解: n (NH3) = 448L 22.4L/mol = 20 molm (NH3) = 20 mol × 17g/mol = 340g V(氨水) = 1340g 0. 9g/mL ×1000mL/L= 1. 49 L 答: 此氨水的浓度是 13. 4 mol/Lm (氨水) = 340g + 1000g = 1340g C(氨水) = 20 mol 1. 49L=13. 4 mol/L氨水中的溶质主要是NH3·H2O,但要以NH3为准计算例:中和 1L 0. 5mol/L NaOH 溶液,需要多少L
的1 mol/L H2SO4 溶液? 2 NaOH + H2SO4 = Na2SO4 + 2H2O解:答:需 1mol/L H2SO4 溶液 0.25L。设需 1 mol / L H2SO4 溶液的体积为V 2 mol 1 mol 0. 5 mol/L×1L 1 mol/L×V 2 mol : 0. 5 mol/L×1L = 1mol : 1 mol/L×VV = 0.25L4、有关化学方程式的计算
称量:用托盘天平称量5.9gNaCl固体。
溶解:在烧杯中用适量蒸馏水使之完全溶解.
转移:将烧杯中液体沿玻璃棒注入100mL容量瓶中
洗涤:洗涤烧杯和玻璃棒2~3次
定容:加水到接近刻度1~2厘米时,改用胶头滴管加水到刻度,摇匀,装瓶. 思考:若溶质为液体物质,则操作上有何区别?第二步操作不用天平称量,而是用量筒量取。注意:应先在烧杯中加一定量的水,然后将浓硫酸沿玻璃棒慢慢注入水中,并不断搅拌,待冷却到室温后再转移到容量瓶中.若用浓硫酸配稀硫酸,具体应该怎样操作呢?实验所需仪器 烧杯、容量瓶、玻璃棒、胶头滴管、
托盘天平、药匙(固体溶质使用)、
量筒(液体溶质使用) 实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950mL,111.2g B.500mL,117g
C.1000mL,117g
D.任意规格,111.2gC随堂练习1用质量分数为98%、密度为1.84g/cm3的浓硫酸配制100mL 1.84mol/L的稀硫酸,若实验仪器有:
A.100mL量筒;B.托盘天平;
C.玻璃棒;D.50mL容量瓶;E.10mL量筒;F.胶头滴管;G.50mL烧杯;H.100mL容量瓶,实验时应选用仪器的先后顺序是(填入编号): 。 E、G、C、H、F随堂练习2讨论在配制溶液中哪些操作可能引起溶液浓度的误差? ?根据物质的量浓度定义式分析:
(1)影响nB(固体质量或液体体积等)
(2)影响溶液体积(溶解过程、转移过程、洗涤过程、定容过程等)讨论:下列操作会使实际所配得溶液物质的量浓度如何变化?
(1)称量NaCl时药品和砝码放反且使用游码
(2)未洗涤烧杯和玻璃棒
(3)转移时有溶液流出
(4)容量瓶中原来有水
(5)加水至刻度线后,上下颠倒摇匀,发现液面低于刻度线,又加水至刻度线(偏小)(偏小)(偏小)(无影响)(偏小)二、关于物质的量浓度的计算问题mol/L溶质B既可以是纯净物又可以是混合物,
还可以是指某种离子或分子。 例:有一瓶18.4mol/L的硫酸溶液1L,将其稀释到10L,请问,此溶液中H2SO4总的物质的量有没有变化?物质的量浓度有没有变化?如果有请计算出来。 n(H2SO4)浓=n (H2SO4)稀
C浓×V浓 = C稀×V稀
18.4mol/L×1L=C稀×10L
C稀=1.84mol/L 本质:稀释浓溶液时,溶液的体积要发生变化,但溶质的量(质量或物质的量)均不变公式:C浓×V浓 = C稀×V稀1、溶液的稀释【练习1 】要配制500mL 0.6mol/L 的NaOH溶液,需2 mol/L 的NaOH溶液多少毫升? 150mL【练习2】配制500mL1 mol/L的稀硫酸,需要的98%浓硫酸(已知其密度为1.84g/mL)多少毫升?27.2mL例 :50 mL 0.5 mol/L BaCl2 溶液和100 mL 0.5
mol/L NaCl溶液混合后,求溶液中Cl- 的物质的量
浓度(假设溶液体积变化忽略不计)。C (Cl-) = 50mL ×0. 5mol/L ×2 + 100mL ×0. 5mol/L 50mL+ 100mL = 0. 67 mol/ L 答: 溶液中Cl- 的物质的量浓度是 0.67 mol/L解:2、混合溶液物质的量浓度的计算3、溶液由气体溶解于水形成,如氯化氢气体溶于水形成盐酸。例:标准状况下,336L氯化氢气体溶于1L水中所得溶液密度为1.17g/cm3,求所得溶液物质的量浓度?
注意:
溶液的体积不能直接用气体的体积或水的体积或气体与水的体积之和,而必须是通过V = m / ρ 换算成质量 11.6mol/L【练习3 】标准状况下,将448L NH3 溶于1L 水中,得到密度为0.9 g/cm3 的氨水。求此氨水的物质的量浓度。解: n (NH3) = 448L 22.4L/mol = 20 molm (NH3) = 20 mol × 17g/mol = 340g V(氨水) = 1340g 0. 9g/mL ×1000mL/L= 1. 49 L 答: 此氨水的浓度是 13. 4 mol/Lm (氨水) = 340g + 1000g = 1340g C(氨水) = 20 mol 1. 49L=13. 4 mol/L氨水中的溶质主要是NH3·H2O,但要以NH3为准计算例:中和 1L 0. 5mol/L NaOH 溶液,需要多少L
的1 mol/L H2SO4 溶液? 2 NaOH + H2SO4 = Na2SO4 + 2H2O解:答:需 1mol/L H2SO4 溶液 0.25L。设需 1 mol / L H2SO4 溶液的体积为V 2 mol 1 mol 0. 5 mol/L×1L 1 mol/L×V 2 mol : 0. 5 mol/L×1L = 1mol : 1 mol/L×VV = 0.25L4、有关化学方程式的计算
