盐城中学2010届高中学业水平模拟测试(必修科目)化学试卷
文档属性
| 名称 | 盐城中学2010届高中学业水平模拟测试(必修科目)化学试卷 |

|
|
| 格式 | rar | ||
| 文件大小 | 106.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-08-29 00:00:00 | ||
图片预览


文档简介
盐城中学2010届高中学业水平模拟测试(必修科目)试卷
化 学
本试卷可能用到的相对原子质量 H:1 C:12 O:16 S:32
一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本题23题,每题3分,共69分)。
1.缤纷的焰火表演让2008年的北京奥运会开幕式更加辉煌、更加浪漫。这与高中化学中“焰色反应”知识相关。下列说法中正确的是
A.食盐与纯碱灼烧时的火焰颜色相同 B.所有金属灼烧时都有明显的焰色反应
C.非金属单质燃烧时火焰都没有颜色 D.焰色反应均应透过蓝色钴玻璃观察
2.据科学家预测,月球土壤中吸附着数百万吨可作为核聚变材料的He。可能是解决未来人类能源危机的选择之一。下列关于He的说法正确的是
A.与 4 2He互为同素异形体 B.中子数为1
C.带2个单位正电荷 ? D.原子最外层有3个电子
3.下列物质属于纯净物的是
A.不锈钢 B.液态空气
C.液氯 D.氢氧化铁胶体
4.既能和盐酸反应,又能和氢氧化钠溶液反应的物质是
A.硅酸钠 B.氢氧化钙 C.碳酸钾 D.氧化铝
5.下列各组混合物中,能用分液漏斗进行分离的是
A.苯和水 B.碘和四氯化碳
C.乙醇和水 D.汽油和植物油
6.下列关于0.05mol /L的K2SO4溶液的说法中,正确的是 A.1L溶液中含有K+、SO42-总数为0.03NA? ??? B.1L溶液中含有K+数目是0.1NA?? C.1 L溶液中K+的浓度是0.20 mol / L? ?? ? D.2 L溶液中含有SO42-的浓度是0.3mol / L
7.下列离子在溶液中可以大量共存的一组是
A.H+、K+、OH- B. K+、NH4+、OH-
C.Na+、Ca2+、HCO3- D.Fe3+、NO3-、SCN-
8.将氯水注入KI溶液中,用力振荡,再注入四氯化碳,震荡后静置,观察到的现象是
A.液体呈紫红色 B.液体为无色
C.液体分层,上层接近无色,下层呈紫红色
D.液体分层,上层呈紫红色,下层接近无色
9.除去Na2CO3 固体中少量NaHCO3的最佳方法是
A.加入适量盐酸 B.加入NaOH溶液
C.加热 D.配成溶液后通入适量CO2
10.下列反应的离子方程式书写正确的是
A.氧化铜与稀硫酸反应: CuO+ 2H+ = Cu2+ + H2O
B.碳酸钙和稀盐酸反应:2H+ + CO32-= CO2↑ + H2O
C.氯气和氯化亚铁溶液反应:Cl2 + Fe2+ = Fe3+ + 2Cl-
D.铜和浓硝酸反应:Cu + 2H+ = Cu2+ + H2↑
11.向MgSO4和KAl (SO4)2的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
12.过量的NaHCO3和Na2O2混合,在密闭容器中充分混合加热后,最后排出气体,残留的固体是
A. Na2O B.Na2CO3
C.NaOH和Na2CO3 D.Na2CO3和NaHCO3
13.决定化学反应速率大小最根本的因素是
A.反应物浓度 B.反应温度
C.反应物本身 D.使用不同的催化剂
14.下列关于乙醇和乙酸的说法中,不正确的是
A.乙醇和乙酸分子中都含有C=O键
B.乙醇和乙酸相互之间能相互溶解
C.乙酸能使紫色石蕊试液变红而乙醇则不能
D.乙醇和乙酸在一定条件下能发生酯化反应
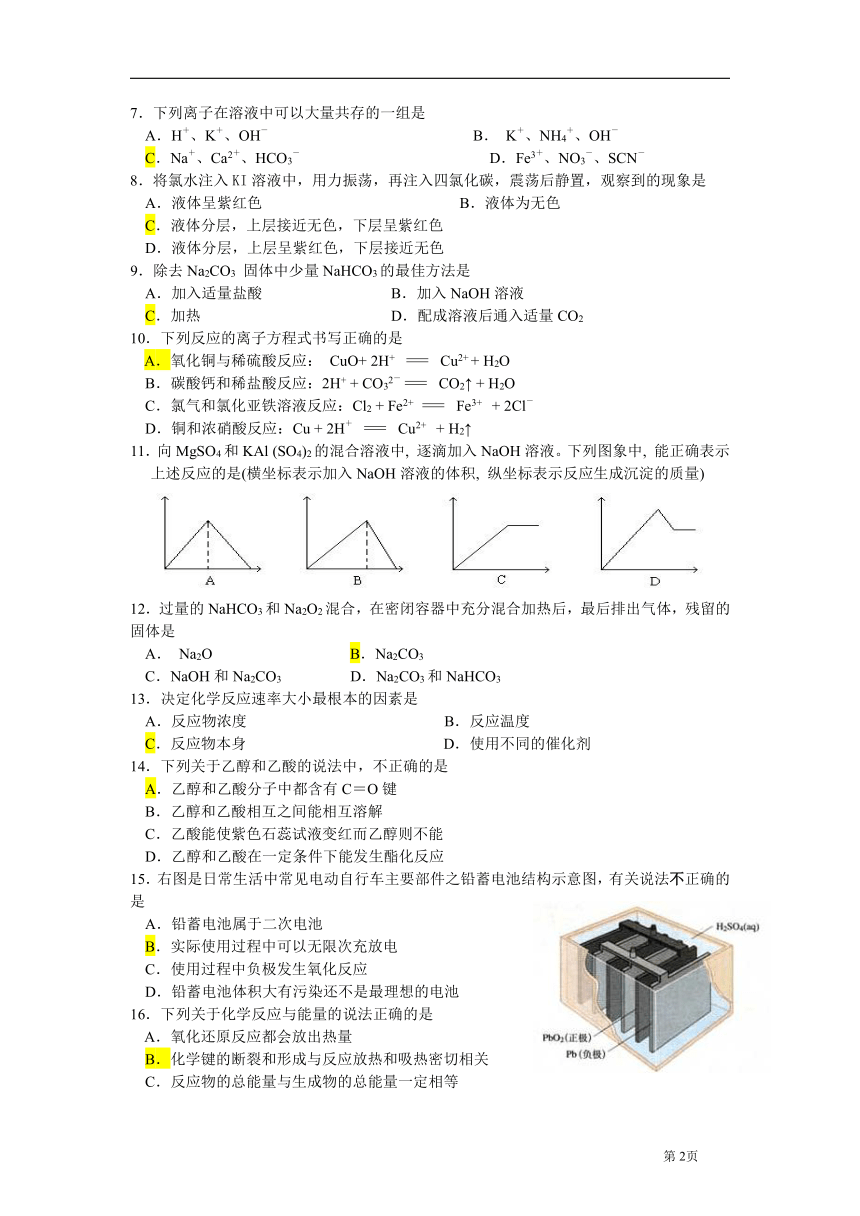
15.右图是日常生活中常见电动自行车主要部件之铅蓄电池结构示意图,有关说法不正确的是
A.铅蓄电池属于二次电池
B.实际使用过程中可以无限次充放电
C.使用过程中负极发生氧化反应
D.铅蓄电池体积大有污染还不是最理想的电池
16.下列关于化学反应与能量的说法正确的是
A.氧化还原反应都会放出热量
B.化学键的断裂和形成与反应放热和吸热密切相关
C.反应物的总能量与生成物的总能量一定相等
D.化学反应中既没有物质变化也没有能量变化
17.A、B、C为短周期元素,在周期表中如右图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数。有关说法不正确的是
A.A的氧化物有多种形式
B.B的最高价氧化物对应的水化物是一种强酸
C.C的氢化物水溶液通常用玻璃试剂瓶盛放
D.D元素形成的单质不止一种
18.关于烷烃性质的叙述中,不正确的是
A.烷烃同系物随相对分子质量增大,熔点、沸点逐渐升高
B.烷烃同系物的密度随相对分子质量增大逐渐增大
C.烷烃跟卤素单质在光照条件下能发生取代反应
D.烷烃同系物都能使溴水、KMnO4溶液褪色
19."绿色化学"要从根本上消除污染,是一门能彻底阻止污染产生的科学。因此设计化学反应流程时要考虑"原子经济",下列反应类型从理论上看原子利用率可达到100%的是
A.酯化反应 B.分解反应 C.化合反应 D.取代反应
20.食用下列物质与人体微量元素的摄入无关的是
A.铁强化酱油 B.加碘食盐 C.高钙牛奶 D.富锌面粉
21.在标准状况下,取等物质的量下列各烃,分别在足量O2中燃烧,消耗O2最多是
A.CH4 B.C2H4
C.C6H6 D.C3H6
22.某有机物的结构为CH3-CH=CH-COOH,该化合物不可能发生的化学反应是
A.加聚反应 B.加成反应
C.酯化反应 D.水解反应
23.金属腐蚀在生活和生产中相当普遍。下列措施能防止金属腐蚀的是
A.将铜铝导线焊接在一起使用
B.将输送自来水的铁管表面镀锌
C.经常用自来水冲洗生铁制品
D.将输油铸铁管道埋在潮湿、疏松的土壤中
二、本大题包括1小题,共15分。每题分为A题和B题,每位考生只可选做一题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题。
24.A.(15分) 化学与我们日常生活中的吃、穿、住、行、医关系密切
(1)油脂、淀粉、蛋白质是我们食物中提供能量的主要物质。它们在人体内都能发生水解。
①油脂水解的最终产物是 ▲ 和 ▲ 。
②淀粉水解的最终产物是 ▲ 若要检验淀粉的淀粉酶作用下已经发生了水解,可取少量上述溶液加入 ▲ (填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量上述溶液加入几滴 ▲ 溶液,应观察到出现蓝色。
③蛋白质在人体内水解的最终产物是氨基酸。请在下图虚线方框内写上适当的官能团符号,将氨基酸的通式补充完整:
(2)现在越来越多的自行车采用铝合金作材料,它不仅轻便美观,而且也很耐久。它能长期使用的原因是 ▲ 。
(3)聚丙烯腈——合成腈纶又称人造羊毛,如何用简单的方法区别一件羊毛衫是否为真品 ▲ ,丙烯腈为CH2=CHCN 请写出聚丙烯腈的结构 ▲
(4)钙塑板是一种质轻、消声、隔热、防潮的新型家居装修材料。它是以高压聚乙烯、轻质碳酸钙和少量助剂为原料制成的。下列有关钙塑板的说法不正确的是 ▲
A.钙塑板是一种复合材料
B.钙塑板可作隔音材料
C.钙塑板可以长期接触酸性溶液而不被腐蚀
D.钙塑板在制造过程中掺入的碳酸钙应该适量
(5)氢氧化铝、碳酸镁、碳酸氢钠都可用于治疗胃酸过多引起的不适。请分别写出相关反应的离子方程式:
① ▲ ② ▲
③ ▲
④碳酸氢钠还是常用的疏松剂,在加热的条件下产生气体,使食品变得疏松。请写出反应方程式 ▲
24.B.如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
(1)写出左试管中主要反应的方程式: ▲ ; (2)在左试管中放入碎瓷片的作用是:
(3)加入浓硫酸的作用:___________________________▲____________________;
(4)饱和Na2CO3的作用是: _______________________▲______________________;
(5)反应开始时用酒精灯对左试管小火加热的原因是: ▲
_________▲________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)后改用大火加热的目的是 ▲ 。
(6)右试管中观察到的现象是:
(7)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称) ▲ ,所需主要仪器为 ▲ 。
(8)实验生成的乙酸乙酯,其密度比水 ▲ ,有 ▲ 气味。
三、本大题包括2小题,共16分。
25.(6分)A、B、C等八种物质有如下框图所示转化关系。又知,A是由地壳中含量最多的金属元素形成的单质,C、D、E是常见的由短周期元素形成的气体单质,气体F与气体G相遇产生大量的白烟,H是厨房中必备一种调味盐(部分反应物和生成物及溶剂水已略去)。
请回答下列问题:
⑴ B的化学式是 ▲ ,F的化学式是 ▲ ,H的电子式为 ▲ ;
⑵ 写出A和B溶液反应的离子方程式: ▲ ;
⑶ 写出D和E反应的化学方程式: ▲ 。
⑷ 如何检验I中的阳离子 ▲
26.(10分)酸雨是指pH<5.6的雨、雪等各种形式的大气降水。二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成。酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
(3)每隔一定时间测定其pH,数据如表Ⅰ所示。
表Ⅰ 不同时间酸雨的pH
测定时间/小时钟
0
1
2
4
pH
4.73
4.62
4.56
4.55
(1)一段时间后,观察到红色变浅,可能的原因是 ▲
(2)生成白色浑浊的离子方程式 ▲
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示) ▲
(4)如果取该雨水和蒸馏水混合,再测pH,结果将 ▲ (填“变大”“变小”或“不变”)
第二组,用拟用下列装置定量分析空气中SO2的含量:
(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
该反应的现象是 ▲ ,SO2在该反应中显 ▲ (填“氧化”或“还原”)性。发生了 ▲ 反应(填“氧化”或“还原”)
(6)通入空气前应进行的实验操作是 ▲ ;KMnO4溶液中导管末端做成球状多孔结构的作用是 ▲
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为
▲ g/L
盐城中学2010届高中学业水平模拟测试试卷
化学答题纸
一、选择题(每小题3分,共69分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
二、注意选择模块!(每空1分,共15分)
24.(1)① 和 。
② ③
(2)原因是 。
(3) ,
(4)
(5)① ②
③
④
三、本大题包括2小题(每空1分,共16分)
25.(6分)⑴ B的化学式是 ,F的化学式是 ,H的电子式为 ;
⑵ A和B溶液反应的离子方程式: ;
⑶D和E反应的化学方程式: 。
⑷检验I中的阳离子
26.(10分)(1)
(2)
(3)
(4)
(5) ,
(6) ;
(7) g/L
盐城中学2010届高中学业水平模拟测试试卷
化 学化学参考答案及评分标准
一、选择题:(本题23题,每题3分,共69分)。
1.A 2.B 3.C 4.D 5.A 6.B 7.C 8.C 9.C 10.A 11.D 12.B
13.C 14.A 15.B 16.B 17. C 18.D 19.C 20.C 21.C 22.D 23.B
二、三、(每空1分,共31分)
24.A.⑴ ① 高级脂肪酸和甘油 ②葡萄糖 银氨溶液(或新制氢氧化铜悬浊液) 碘
③ -NH2 -COOH ⑵铝表面能形成致密氧化层具有抗腐蚀性 ⑶ 取少量线头,点燃,若有烧焦羽毛气味,说明是真品 –[CH2–CH] – n (4)C
CN
(5)①Al(OH)3 + 3H+ = Al3+ + 3H2O ②MgCO3 + 2H+ = Mg2+ + H2O+ CO2↑
③HCO3- + H+ = H2O + CO2↑
④ 2NaHCO3 =(加热) 2Na2CO3 + H2O + CO2↑
25.⑴ NaOH NH3 NaCl电子式 ⑵2Al + 2H2O + 2OH_ = 2AlO2_ +3 H2↑
⑶ H2 + Cl2 =(点燃) 2HCl ⑷取样,加入碱,加热,在试管口以湿润红色石蕊试纸检验,变蓝色,说明存在铵根离子
26.⑴ SO2 有漂白作用 ⑵ Ba2++ SO42- = BaSO4↓
⑶ 2SO2 + 2H2O + O2 = 2 H2SO4 (4) 变大(5)紫色褪去 还原 氧化(6)气密性检查 增大接触面积,有利于SO2的充分吸收(7)32bc/a
(文字表述题,合理答案均给分)
化 学
本试卷可能用到的相对原子质量 H:1 C:12 O:16 S:32
一、单项选择题:在每题的四个选项中,只有一个选项是符合要求的(本题23题,每题3分,共69分)。
1.缤纷的焰火表演让2008年的北京奥运会开幕式更加辉煌、更加浪漫。这与高中化学中“焰色反应”知识相关。下列说法中正确的是
A.食盐与纯碱灼烧时的火焰颜色相同 B.所有金属灼烧时都有明显的焰色反应
C.非金属单质燃烧时火焰都没有颜色 D.焰色反应均应透过蓝色钴玻璃观察
2.据科学家预测,月球土壤中吸附着数百万吨可作为核聚变材料的He。可能是解决未来人类能源危机的选择之一。下列关于He的说法正确的是
A.与 4 2He互为同素异形体 B.中子数为1
C.带2个单位正电荷 ? D.原子最外层有3个电子
3.下列物质属于纯净物的是
A.不锈钢 B.液态空气
C.液氯 D.氢氧化铁胶体
4.既能和盐酸反应,又能和氢氧化钠溶液反应的物质是
A.硅酸钠 B.氢氧化钙 C.碳酸钾 D.氧化铝
5.下列各组混合物中,能用分液漏斗进行分离的是
A.苯和水 B.碘和四氯化碳
C.乙醇和水 D.汽油和植物油
6.下列关于0.05mol /L的K2SO4溶液的说法中,正确的是 A.1L溶液中含有K+、SO42-总数为0.03NA? ??? B.1L溶液中含有K+数目是0.1NA?? C.1 L溶液中K+的浓度是0.20 mol / L? ?? ? D.2 L溶液中含有SO42-的浓度是0.3mol / L
7.下列离子在溶液中可以大量共存的一组是
A.H+、K+、OH- B. K+、NH4+、OH-
C.Na+、Ca2+、HCO3- D.Fe3+、NO3-、SCN-
8.将氯水注入KI溶液中,用力振荡,再注入四氯化碳,震荡后静置,观察到的现象是
A.液体呈紫红色 B.液体为无色
C.液体分层,上层接近无色,下层呈紫红色
D.液体分层,上层呈紫红色,下层接近无色
9.除去Na2CO3 固体中少量NaHCO3的最佳方法是
A.加入适量盐酸 B.加入NaOH溶液
C.加热 D.配成溶液后通入适量CO2
10.下列反应的离子方程式书写正确的是
A.氧化铜与稀硫酸反应: CuO+ 2H+ = Cu2+ + H2O
B.碳酸钙和稀盐酸反应:2H+ + CO32-= CO2↑ + H2O
C.氯气和氯化亚铁溶液反应:Cl2 + Fe2+ = Fe3+ + 2Cl-
D.铜和浓硝酸反应:Cu + 2H+ = Cu2+ + H2↑
11.向MgSO4和KAl (SO4)2的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
12.过量的NaHCO3和Na2O2混合,在密闭容器中充分混合加热后,最后排出气体,残留的固体是
A. Na2O B.Na2CO3
C.NaOH和Na2CO3 D.Na2CO3和NaHCO3
13.决定化学反应速率大小最根本的因素是
A.反应物浓度 B.反应温度
C.反应物本身 D.使用不同的催化剂
14.下列关于乙醇和乙酸的说法中,不正确的是
A.乙醇和乙酸分子中都含有C=O键
B.乙醇和乙酸相互之间能相互溶解
C.乙酸能使紫色石蕊试液变红而乙醇则不能
D.乙醇和乙酸在一定条件下能发生酯化反应
15.右图是日常生活中常见电动自行车主要部件之铅蓄电池结构示意图,有关说法不正确的是
A.铅蓄电池属于二次电池
B.实际使用过程中可以无限次充放电
C.使用过程中负极发生氧化反应
D.铅蓄电池体积大有污染还不是最理想的电池
16.下列关于化学反应与能量的说法正确的是
A.氧化还原反应都会放出热量
B.化学键的断裂和形成与反应放热和吸热密切相关
C.反应物的总能量与生成物的总能量一定相等
D.化学反应中既没有物质变化也没有能量变化
17.A、B、C为短周期元素,在周期表中如右图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数。有关说法不正确的是
A.A的氧化物有多种形式
B.B的最高价氧化物对应的水化物是一种强酸
C.C的氢化物水溶液通常用玻璃试剂瓶盛放
D.D元素形成的单质不止一种
18.关于烷烃性质的叙述中,不正确的是
A.烷烃同系物随相对分子质量增大,熔点、沸点逐渐升高
B.烷烃同系物的密度随相对分子质量增大逐渐增大
C.烷烃跟卤素单质在光照条件下能发生取代反应
D.烷烃同系物都能使溴水、KMnO4溶液褪色
19."绿色化学"要从根本上消除污染,是一门能彻底阻止污染产生的科学。因此设计化学反应流程时要考虑"原子经济",下列反应类型从理论上看原子利用率可达到100%的是
A.酯化反应 B.分解反应 C.化合反应 D.取代反应
20.食用下列物质与人体微量元素的摄入无关的是
A.铁强化酱油 B.加碘食盐 C.高钙牛奶 D.富锌面粉
21.在标准状况下,取等物质的量下列各烃,分别在足量O2中燃烧,消耗O2最多是
A.CH4 B.C2H4
C.C6H6 D.C3H6
22.某有机物的结构为CH3-CH=CH-COOH,该化合物不可能发生的化学反应是
A.加聚反应 B.加成反应
C.酯化反应 D.水解反应
23.金属腐蚀在生活和生产中相当普遍。下列措施能防止金属腐蚀的是
A.将铜铝导线焊接在一起使用
B.将输送自来水的铁管表面镀锌
C.经常用自来水冲洗生铁制品
D.将输油铸铁管道埋在潮湿、疏松的土壤中
二、本大题包括1小题,共15分。每题分为A题和B题,每位考生只可选做一题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题。
24.A.(15分) 化学与我们日常生活中的吃、穿、住、行、医关系密切
(1)油脂、淀粉、蛋白质是我们食物中提供能量的主要物质。它们在人体内都能发生水解。
①油脂水解的最终产物是 ▲ 和 ▲ 。
②淀粉水解的最终产物是 ▲ 若要检验淀粉的淀粉酶作用下已经发生了水解,可取少量上述溶液加入 ▲ (填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量上述溶液加入几滴 ▲ 溶液,应观察到出现蓝色。
③蛋白质在人体内水解的最终产物是氨基酸。请在下图虚线方框内写上适当的官能团符号,将氨基酸的通式补充完整:
(2)现在越来越多的自行车采用铝合金作材料,它不仅轻便美观,而且也很耐久。它能长期使用的原因是 ▲ 。
(3)聚丙烯腈——合成腈纶又称人造羊毛,如何用简单的方法区别一件羊毛衫是否为真品 ▲ ,丙烯腈为CH2=CHCN 请写出聚丙烯腈的结构 ▲
(4)钙塑板是一种质轻、消声、隔热、防潮的新型家居装修材料。它是以高压聚乙烯、轻质碳酸钙和少量助剂为原料制成的。下列有关钙塑板的说法不正确的是 ▲
A.钙塑板是一种复合材料
B.钙塑板可作隔音材料
C.钙塑板可以长期接触酸性溶液而不被腐蚀
D.钙塑板在制造过程中掺入的碳酸钙应该适量
(5)氢氧化铝、碳酸镁、碳酸氢钠都可用于治疗胃酸过多引起的不适。请分别写出相关反应的离子方程式:
① ▲ ② ▲
③ ▲
④碳酸氢钠还是常用的疏松剂,在加热的条件下产生气体,使食品变得疏松。请写出反应方程式 ▲
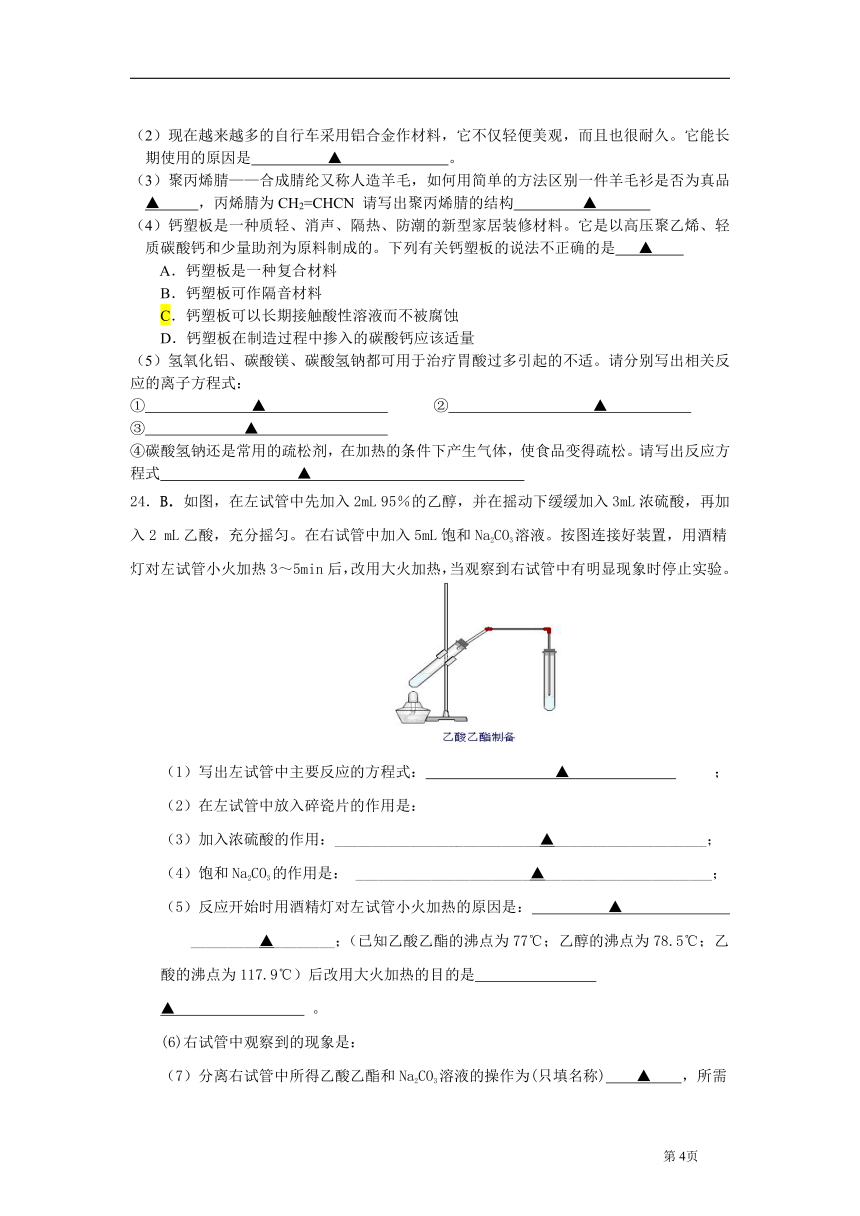
24.B.如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2 mL乙酸,充分摇匀。在右试管中加入5mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
(1)写出左试管中主要反应的方程式: ▲ ; (2)在左试管中放入碎瓷片的作用是:
(3)加入浓硫酸的作用:___________________________▲____________________;
(4)饱和Na2CO3的作用是: _______________________▲______________________;
(5)反应开始时用酒精灯对左试管小火加热的原因是: ▲
_________▲________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)后改用大火加热的目的是 ▲ 。
(6)右试管中观察到的现象是:
(7)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称) ▲ ,所需主要仪器为 ▲ 。
(8)实验生成的乙酸乙酯,其密度比水 ▲ ,有 ▲ 气味。
三、本大题包括2小题,共16分。
25.(6分)A、B、C等八种物质有如下框图所示转化关系。又知,A是由地壳中含量最多的金属元素形成的单质,C、D、E是常见的由短周期元素形成的气体单质,气体F与气体G相遇产生大量的白烟,H是厨房中必备一种调味盐(部分反应物和生成物及溶剂水已略去)。
请回答下列问题:
⑴ B的化学式是 ▲ ,F的化学式是 ▲ ,H的电子式为 ▲ ;
⑵ 写出A和B溶液反应的离子方程式: ▲ ;
⑶ 写出D和E反应的化学方程式: ▲ 。
⑷ 如何检验I中的阳离子 ▲
26.(10分)酸雨是指pH<5.6的雨、雪等各种形式的大气降水。二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成。酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
(3)每隔一定时间测定其pH,数据如表Ⅰ所示。
表Ⅰ 不同时间酸雨的pH
测定时间/小时钟
0
1
2
4
pH
4.73
4.62
4.56
4.55
(1)一段时间后,观察到红色变浅,可能的原因是 ▲
(2)生成白色浑浊的离子方程式 ▲
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示) ▲
(4)如果取该雨水和蒸馏水混合,再测pH,结果将 ▲ (填“变大”“变小”或“不变”)
第二组,用拟用下列装置定量分析空气中SO2的含量:
(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
该反应的现象是 ▲ ,SO2在该反应中显 ▲ (填“氧化”或“还原”)性。发生了 ▲ 反应(填“氧化”或“还原”)
(6)通入空气前应进行的实验操作是 ▲ ;KMnO4溶液中导管末端做成球状多孔结构的作用是 ▲
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为
▲ g/L
盐城中学2010届高中学业水平模拟测试试卷
化学答题纸
一、选择题(每小题3分,共69分)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
二、注意选择模块!(每空1分,共15分)
24.(1)① 和 。
② ③
(2)原因是 。
(3) ,
(4)
(5)① ②
③
④
三、本大题包括2小题(每空1分,共16分)
25.(6分)⑴ B的化学式是 ,F的化学式是 ,H的电子式为 ;
⑵ A和B溶液反应的离子方程式: ;
⑶D和E反应的化学方程式: 。
⑷检验I中的阳离子
26.(10分)(1)
(2)
(3)
(4)
(5) ,
(6) ;
(7) g/L
盐城中学2010届高中学业水平模拟测试试卷
化 学化学参考答案及评分标准
一、选择题:(本题23题,每题3分,共69分)。
1.A 2.B 3.C 4.D 5.A 6.B 7.C 8.C 9.C 10.A 11.D 12.B
13.C 14.A 15.B 16.B 17. C 18.D 19.C 20.C 21.C 22.D 23.B
二、三、(每空1分,共31分)
24.A.⑴ ① 高级脂肪酸和甘油 ②葡萄糖 银氨溶液(或新制氢氧化铜悬浊液) 碘
③ -NH2 -COOH ⑵铝表面能形成致密氧化层具有抗腐蚀性 ⑶ 取少量线头,点燃,若有烧焦羽毛气味,说明是真品 –[CH2–CH] – n (4)C
CN
(5)①Al(OH)3 + 3H+ = Al3+ + 3H2O ②MgCO3 + 2H+ = Mg2+ + H2O+ CO2↑
③HCO3- + H+ = H2O + CO2↑
④ 2NaHCO3 =(加热) 2Na2CO3 + H2O + CO2↑
25.⑴ NaOH NH3 NaCl电子式 ⑵2Al + 2H2O + 2OH_ = 2AlO2_ +3 H2↑
⑶ H2 + Cl2 =(点燃) 2HCl ⑷取样,加入碱,加热,在试管口以湿润红色石蕊试纸检验,变蓝色,说明存在铵根离子
26.⑴ SO2 有漂白作用 ⑵ Ba2++ SO42- = BaSO4↓
⑶ 2SO2 + 2H2O + O2 = 2 H2SO4 (4) 变大(5)紫色褪去 还原 氧化(6)气密性检查 增大接触面积,有利于SO2的充分吸收(7)32bc/a
(文字表述题,合理答案均给分)
同课章节目录
