1.2 第2节研究物质性质的方法和程序 全3课时
文档属性
| 名称 | 1.2 第2节研究物质性质的方法和程序 全3课时 |

|
|
| 格式 | rar | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-08-30 00:00:00 | ||
图片预览






文档简介
课件92张PPT。第1章 走进化学科学
第2节 研究物质性质的方法和程序
研究物质的性质
交流·研讨观察和实验法分类、比较法 1、在初中化学中,你认识了哪些物质?你是通过什么方法来研究它们的性质的?
研究物质的性质就应该首先
把握研究物质的方法和程序可见: 化学学习,贵在得法。
当代著名的科学家和科学史学者贝尔纳曾经指出:
“良好的方法能使我们更好地发挥运用天赋的才能,而拙劣的方法则可能阻碍才能的发挥”。
研究物质的性质的常用方法有哪些?
常用观察、实验、分类、比较等方法下面以金属钠为例
体会一下观察法
研究物质性质的基本方法:观察法 【实验目的】
⑴学会观察实验现象的方法;
⑵通过对所观察到的现象进行分析,
揭示物质的性质;
⑶通过观察认识钠的色、态、硬度的密度的相对
大小,熔点的相对高低;
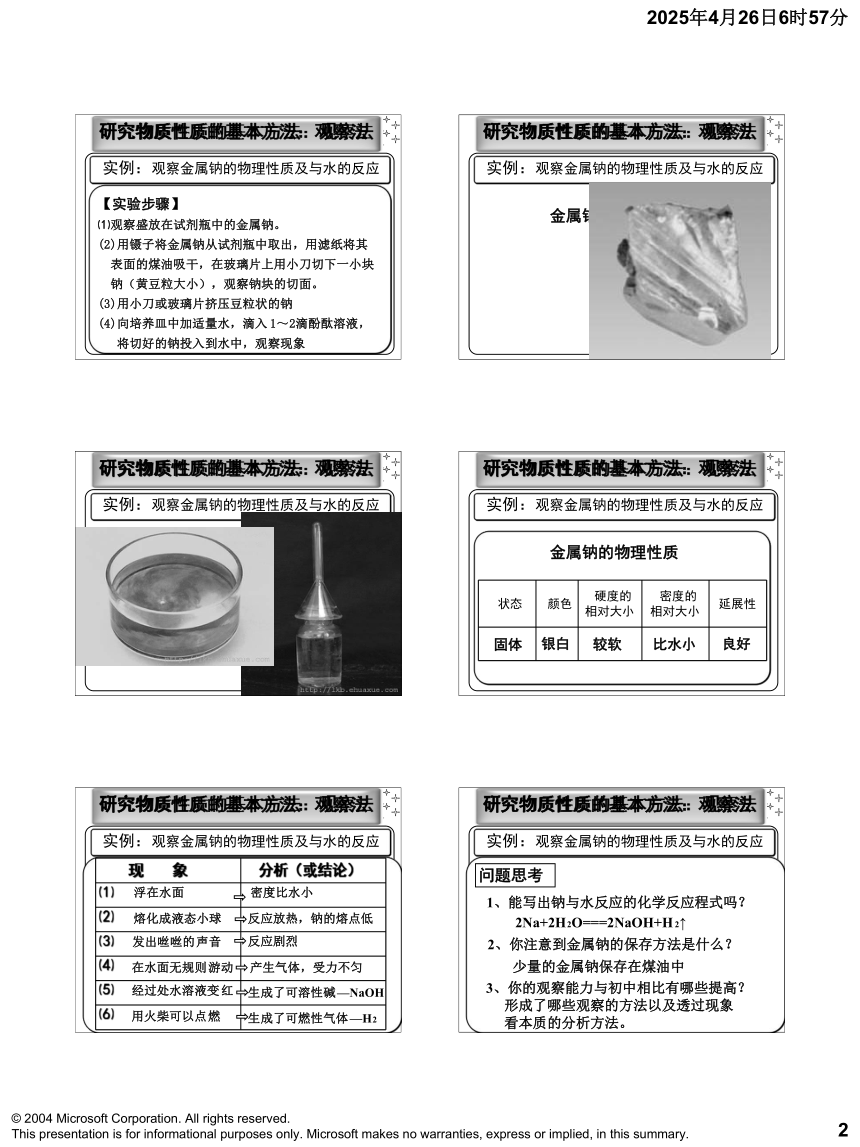
⑷通过观察钠与水反应的现象,分析钠的化学性质。 实例:观察金属钠的物理性质及与水的反应
研究物质性质的基本方法:观察法【实验步骤】
⑴观察盛放在试剂瓶中的金属钠。
(2)用镊子将金属钠从试剂瓶中取出,用滤纸将其
表面的煤油吸干,在玻璃片上用小刀切下一小块
钠(黄豆粒大小),观察钠块的切面。
(3)用小刀或玻璃片挤压豆粒状的钠
(4)向培养皿中加适量水,滴入1~2滴酚酞溶液,
将切好的钠投入到水中,观察现象 实例:观察金属钠的物理性质及与水的反应
研究物质性质的基本方法:观察法金属钠的物理性质 实例:观察金属钠的物理性质及与水的反应
研究物质性质的基本方法:观察法 实例:观察金属钠的物理性质及与水的反应
研究物质性质的基本方法:观察法金属钠的物理性质固体 实例:观察金属钠的物理性质及与水的反应银白较软比水小良好
研究物质性质的基本方法:观察法 实例:观察金属钠的物理性质及与水的反应浮在水面熔化成液态小球在水面无规则游动经过处水溶液变红发出咝咝的声音用火柴可以点燃密度比水小反应放热,钠的熔点低产生气体,受力不匀生成了可溶性碱—NaOH反应剧烈生成了可燃性气体—H2
研究物质性质的基本方法:观察法 实例:观察金属钠的物理性质及与水的反应问题思考1、能写出钠与水反应的化学反应程式吗?2Na+2H2O===2NaOH+H2↑少量的金属钠保存在煤油中2、你注意到金属钠的保存方法是什么?3、你的观察能力与初中相比有哪些提高?
形成了哪些观察的方法以及透过现象
看本质的分析方法。
研究物质性质的基本方法:观察法 实例:观察金属钠的物理性质及与水的反应拓展·延伸1、预测钠与盐酸的反应现象,推测方程式。反应更剧烈
2Na+2HCl==2NaCl+H2↑反应剧烈,产生气泡,并有蓝色沉淀生成2Na+2H2O===2NaOH+H2↑
2NaOH+ CuSO4 ==Cu(OH)2↓+ Na2SO4 2、预测钠与CuSO4稀溶液的反应现象,
观察并分析结果,推测化学反应方程式。
研究物质性质的基本方法:观察法 1、含义:是一种有计划、有目的的用
感官察研究对象的方法 2、观察的详细过程:
用感官观察:看、闻、听、摸
借助仪器观察:提高灵敏度
大脑的积极思维活动:
观察要有明确而具体的目的和计划
要积极思考,及时贮存和处理信息。
要对所观察到的现象进行分析和综合。本课小结
知识上:金属钠的化学性质
方法上:初步学会以观察在研究物质性质中的运用本课重点:
P18.
1. 2. (做在书上)
《第二教材》本节课内容
预习:下节课内容
本课作业:
再见第1章 走进化学科学
第2节 研究物质性质的方法和程序第二课时
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验步骤】
⑴将切好的金属钠放置在空气中,
使其跟氧气反应;
⑵将金属钠放在石棉网上加热,
使其跟氧气反应。
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验记录】
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验记录】很快失去金属光泽与O2反应生成了
白色的Na2O
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验记录】很快失去金属光泽与O2反应生成了
白色的Na2O
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验记录】很快失去金属光泽与O2反应生成了
白色的Na2O剧烈燃烧,发出黄
色火焰,生成淡黄
色固体。与O2反应生成了
淡黄色的的Na2O2
研究物质性质的基本方法:实验法 问题讨论:1、这组实验对你有何启示?
相同的反应物,在不同条件下,可以发生不同的反应,生成不同的产物。2、在你所知道的反应中,还有因条件不同而得到不同反应产物的实例吗? 碳与氧气:氧气量不同,产物不同.
铁与氧气:条件不同,产物不同.
研究物质性质的基本方法:实验法 问题讨论:3、钠为什么保存在煤油中?
能否保存在汽油中?
钠很易与空气中的O2和H2O起反应,而不与煤油起反应,且密度比煤油大,钠沉在煤油下面,使钠与O2和H2O隔绝,达到保护的目的。
钠不能保存在汽油中,因汽油易挥发。4、金属钠着火,能否用水灭火? 补充实验:吹气生火
???
研究物质性质的基本方法:实验法 问题讨论:3、钠为什么保存在煤油中?
能否保存在汽油中?
钠很易与空气中的O2和H2O起反应,而不与煤油起反应,且密度比煤油大,钠沉在煤油下面,使钠与O2和H2O隔绝,达到保护的目的。
钠不能保存在汽油中,因汽油易挥发。4、金属钠着火,能否用水灭火?不能。一是因为钠与水的反应生成氢气能燃烧;
二是因为钠燃烧产物过氧化钠能与水反应生成氧气能助燃.钠与盐溶液的反应实验探究实验课题:钠与硫酸铜溶液反应,
能否置换出铜?假设1:钠是活泼金属,能置换出金属铜
假设2:钠先和水反应,生成的氢氧化钠
与硫酸铜溶液反应生成沉淀。实验方案:
将一小块钠放在硫酸铜溶液中观察。结 论:活泼金属钠(包括钾、钙等)与盐溶液
反应时,一般不能置换出金属,而是钠
先与水反应,生成的碱再与盐溶液反应。
只有与熔融盐作用才能置换出相应的金
属。如:4Na+TiCl4(熔融)=4NaCl+Ti
请写出化学方程式:
拓展提高思考:将一小块钠放入FeCl3溶液中,有什么现象?写出反应的化学方程式。2Na+2H2O=2NaOH+H2↑ ①
2FeCl3+ 3NaOH=Fe(OH)3+3NaCl ②
①×3+②×2,得:
6Na + 6H2O + 2FeCl3 =2Fe (OH)3 +3 H2↑+6NaCl
研究物质性质的基本方法:实验法 小结:1、金属钠放置在空气中,会迅速被氧化而生成氧化钠,失去金属光泽(因此金属钠通常保存在煤油里):
4Na +O2 ==== 2Na2O
2、金属钠在空气中燃烧生成过氧化钠
2Na +O2 ==== 2Na2O2
3、该实验验证了金属钠在不同条件下与氧气反应的性质。
白色
粉末淡黄色
粉末Na2O+H2O==
2NaOH2Na2O2+2H2O==
4NaOH+O2↑Na2O+2HCl==
2NaCl+H2O2Na2O2+4HCl==
4NaCl+2H2O +O2 ↑Na2O+CO2 ==
Na2 CO32Na2O2+2CO2 ==
2Na2 CO3+O2
活动探究:由Na2O的性质
预测并验证Na2O2的性质补充:Na2O2与水的反应过氧化钠能与水迅速反应,产生大量气泡,最后固体消失。
滴加酚酞,溶液先变红后逐渐褪去。2.向试管中插入一根带火星的小木条(验证气体是O2)小木条复燃说明气体确实是氧气吹气生火补充:Na2O2与二氧化碳的反应2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
【结论】
氧化钠是典型的碱性氧化物,
过氧化钠不是碱性氧化物
研究物质性质的基本方法:比较法均为银白
色金属钠比铁硬度、密度小,熔点、沸点低均能与O2、
酸、盐溶液反应①常温下:钠能与O2反应, 铁不能与O2反应
②钠可在空气中燃烧,
铁只能在纯氧中燃烧
③铁可置换出CuSO4溶液中的Cu,钠先与水反应虽都是金属单
质,但物理性
质有较大差别都是较活泼的
金属单质,但
钠比铁更活泼交流·研讨:金属钠与铁的比较
研究物质性质的基本方法:比较法交流·研讨:预测金属的共性物理性质的共性:①有金属光泽、不透明的固体;
②电和热的良导体;
③有延展性。
研究物质性质的基本方法:比较法交流·研讨:预测金属的共性化学性质的共性:①常温或加热条件下与氧气反应;
②常温或加热时与水反应,置换出水中的
氢(比氢活泼);
③与酸反应置换出酸中的氢(比氢活泼);
④与盐溶液应,置换出在金属活动顺序中
排在它后面的金属
研究物质性质的基本方法:分类法预习P12: 分类的必要性:
自然界中物质几百万种,我们不可能一种
一种地研究,只能一类一类地研究。分类的含义:
根据事物的特点分别归类。分类的优点:
可以总结出各类物质的通性和特性
知道某物质的类别,就可推知该物质的一般性质 。
研究物质性质的基本方法:比较法比较的含义:
对两种或两种以上的同类事物辨别异同或高下。比较的优点:
可以物质性质间的异同
可以认识物质间的内在联系
可以对物质的性质进行归纳和概括 例题解析1、下列物质中既能与水反应,又能与CO2反应,且都有O2产生的是( )
A、Na2O B、Na2O2
C、Na D、NaClB 例题解析2、氧化钠与过氧化钠共同之处是( )
A 均是淡黄色固体
B 均是碱性氧化钠
C 与水反应生成物中均有碱
D 均与二氧化碳反应放出氧气C 例题解析3、向紫色石蕊试液中加入过量的Na2O2粉末,充分搅拌,正确的叙述是( )
A 溶液仍为紫色
B 最后溶液变成蓝色
C 最后溶液褪色
D 有气泡产生CD 例题解析4、将一小块金属钠放置在空气中较长时间,请描述可能出现的现象,写出可能发生的化学反应方程式。
表面变暗,再慢慢变湿润,接着形成少量液体,然后形成少量晶体,最后变成白色粉末。
变暗是被氧化成Na2O,变湿润是由于生成的NaOH具有吸湿性,慢慢吸水变成液体,由于空气中CO2缘故而变成Na2CO3,水分蒸发形成Na2CO3·10H2O,最后,晶体风化,变成Na2CO3粉末。
Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3
本课重点: 知识上:金属钠的化学性质
方法上:初步学会以观察、实验、比较、分类等方法在研究物质性质中的运用
作业:
课堂作业:
预测:金属锂和金属钾与氧气反
应的现象和产物。
课外作业:第二教材本节第二课时
再见第1章 走进化学科学
第2节 研究物质性质的方法和程序第三课时 听写下列化学方程式: 钠与水:
钠与硫酸铜溶液:
钠与氧气:
过氧化钠与水:
过氧化钠与二氧化碳:2Na+2H2O=2NaOH+H2 ↑ 4Na +O2 ==== 2Na2O 条件? 2Na +O2 ==== 2Na2O2 条件?2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2 =2Na2 CO3+O2 本课重点: 知识上:掌握氯气的性质
方法上:体会研究物质性质的
程序
研究物质性质的基本方法---小结1.观察法
2.实验法
3.比较法
4.分类法比较钠与金属铁的性质预测金属的通性钠物理性质和与水的反应钠与氧气的反应一、观察氯气的物理性质1、通常从哪些方面认识物质的物理性质?色、态、味,
“二点” ( 熔点、沸点 )
“二度” ( 密度、硬度 )
“三性” (溶解性、导电性、导热性)研究氯气的性质案例一、观察氯气的物理性质1、通常从哪些方面认识物质的物理性质?2、闻气味的方法研究氯气的性质案例 用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。
注意:
这是闻各种气体气味的方法。一、观察氯气的物理性质1、通常从哪些方面认识物质的物理性质?2、闻气味的方法3、试验氯气的溶解性实验(检验气体水溶性的常用方法)研究氯气的性质案例将盛满氯气的试管倒置在水中,水面上升,并呈黄绿色黄绿色刺激性气味
(剧毒!)能溶于水
(氯水)小结氯气的物理性质1、Cl2与O2、 H2都是非金属单质,应该具有某些类似性质。与哪种更相似?与Na、Fe、Cu等金属单质反应。
与S、P等非金属单质反应。从原子结构看,氯元
素与氧元素更相似,它
们的原子的最外层电子
数都比较多,容易得到
电子成为8电子的稳定结构,所以都是较活泼的非金属元素。氧气与氯气都是活泼的非金属单质。预测二、预测氯气的化学性质实验探究实验探究铁在氯气中燃烧录像剧烈燃烧,产生红棕色浓烟,产物水溶液呈棕黄色FeCl3实验探究实验探究铜在氯气中燃烧录像剧烈燃烧,产生红棕色浓烟,
产物水溶液呈棕黄色FeCl3剧烈燃烧,产生棕色浓烟,
产物水溶液呈蓝绿色CuCl2实验探究实验探究氢气在氯气中燃烧录像剧烈燃烧,产生红棕色浓烟,
产物水溶液呈棕黄色FeCl3剧烈燃烧,产生棕色浓烟,
产物水溶液呈棕蓝绿色CuCl2剧烈燃烧,产生苍白色火焰,
集气瓶口有白雾HCl实验探究什么叫燃烧?
燃烧一定要有氧气吗?剧烈燃烧,产生红棕色浓烟,
产物水溶液呈棕黄色FeCl3剧烈燃烧,产生棕色浓烟,
产物水溶液呈棕蓝绿色CuCl2点燃氢气与氯气的混合气体,
发生爆炸HCl实验探究思考 氯气、氧气等都是活泼的非金属单质,其化学性质有相似之处。但是,化学性质能完全相同吗? 除了上述与氧气类似的性质外,氯气还具有什么特性呢? Cl2与O2的性质相似,但氧气不易溶于水,而氯气能溶于水。
思考 那么,氯气溶于水的过程只是一个纯物理过程吗?
能否设计实验证明?
思考与假设思考一、如果氯气溶于水仅仅是纯物理过程,
则氯水成分是什么?思考二、氯水的颜色:黄绿色——说明氯水中含有
什么分子?能否由此说明氯气与水没反应?思考三、若Cl2与H2O发生了反应,可能会生成什么?
如何设计实验检验?Cl2、H2O说明含有Cl2分子。
不能,因为也许氯气只是没反应完全。可能是:Cl2、H2O、HCl(Cl- 、 H+)氯气能否与水反应实验探究 方案:氯水与硝酸银(酸化)溶液反应探究一:氯水中有?无Cl- 白色沉淀现象结论有Cl-实验探究氯气能否与水反应探究气体(H2)现象结论有H+镁条氯水探究二:氯水中有?无H+ (方法1)实验探究氯气能否与水反应探究蓝色石蕊试纸盐酸↓变红先变红后褪色氯水↓探究二:氯水中有?无H+(方法2)实验探究氯气能否与水反应探究现在,能否写出氯气与水反应的化学方程式?Cl2 + H2O == HCl + HClO依据:质量守恒定律实验探究氯气能否与水反应探究探究三:氯水中有漂白作用的是什么? 绿油油的油菜被泄漏的氯气熏成枯黄,为什么假设1: ;
假设2: ;
假设3: 。实验探究氯气能否与水反应探究探究三:氯水中有漂白作用的是什么? 氯水中 已被证实没有漂白性。
你认为起漂白作用的微粒可能是什么?如何设计实验方案,验证假设是否成立?氯气具有漂白性次氯酸具有漂白性氯气和次氯酸都具有漂白性 分析 假设 验证H2O、HCl实验探究装置设计:干燥氯气干燥红纸片湿润红纸片NaOH溶液不褪色褪色吸收余氯实验探究实验结论:1、氯气不仅能溶于水,还能与水发生化学反应,
生成HCl和HClO,反应的化学方程式为:
Cl2+H2O == HCl+HClO
2、干燥的Cl2不具有漂白性。
3、HClO具有漂白性。
原因:它遇到有色物质时,能破坏其中的有机色质,
使有色物质褪色。补充:HClO不稳定,见光分解:2HClO == HCl +O2 ↑二、研究物质性质的基本程序氯气能与碱反应吗? Cl2 + H2O = HCl + HClO分步进行:HCl + NaOH = NaCl + H2OHClO+ NaOH = NaClO + H2OCl2 + 2 NaOH = NaCl + NaClO + H2O次氯酸钠总反应Cl2与NaOH溶液?练习:应用:实验室常用NaOH溶液吸收多余的Cl2 ,以消除污染。知识拓展2Cl2+2Ca(OH) 2== CaCl 2 +Ca(ClO) 2+2H2OCl2与熟石灰反应有何应用?漂白粉制备原理:漂白粉使用原理:CO2+Ca(ClO) 2+2H2O== CaCO 3 +2HClO2漂白粉主要成分: CaCl 2 +Ca(ClO) 2漂白粉有效成分: Ca(ClO) 2漂白粉保存方法:密封(隔绝水和二氧化碳)知识拓展氯水与液氯的区别知识拓展新制氯水与久置氯水的区别混合物分子:离子:Cl2 ,HClO,H2OH+,Cl-,ClO-分子:H2O离子:H+,Cl-新制有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中只有酸性知识拓展氯气物理性质 氯气的物理性质和化学性质化学性质 (1)与铁反应 . 与铜反应 . 与钠反应 . (2)与氢气反应 . (3)与水反应 . (4)与碱反应 . 小结实验室中多余的氯气是如何处理的?为什么?用碱液吸收多余的氯气
(1)氯气有毒,污染空气.
(2)氯气可与碱液反应问题?思考课堂练习1、下列物质属于纯净物的是( )
A、液氯 B、氯水
C、盐酸 D、漂白粉A课堂练习1、下列物质属于纯净物的是( )
A、液氯 B、氯水
C、盐酸 D、漂白粉A2、将下列物质分别加到干燥的红色布条上,不能使其褪色的是( )
A、新制的氯水 B、盐酸
C、液氯
D、盐酸和次氯酸的混合溶液BC课堂练习3、下列常用的干燥剂中,不能用来干燥氯气的是( )
A、浓硫酸 B、碱石灰
C、无水CaCl2 D、P2O5B课堂练习4、氯气在第一次世界大战中曾作为化学武器被使用过,当遇到氯气制成的炸弹爆炸时,防御的方法是( )
A、人、畜躲到低洼地方
B、人、畜躲到地势高的地方
C、人、畜躲到河沟或水塘边
D、用浸过碱性溶液或肥皂水的毛巾捂住鼻嘴处BD5.将新制的氯水缓缓滴入预先滴有酚酞的 NaOH溶液中,当滴到一定量时红色完全褪去。产生这一现象的原因可能有两种:
(1)_____________________________
(2)____________________________新制氯水中的HCl、HClO与 NaOH发生中和反应,使NaOH无剩余。新制氯水中HClO具有漂白性,使红色溶液褪色课堂练习请大家阅读:P15假说 模型各种原子模型假设 本课重点: 知识上:氯气的化学性质
方法上:初步学会研究物质性质的程序 作业:
课外作业:第二课堂本节第二课时再见
第2节 研究物质性质的方法和程序
研究物质的性质
交流·研讨观察和实验法分类、比较法 1、在初中化学中,你认识了哪些物质?你是通过什么方法来研究它们的性质的?
研究物质的性质就应该首先
把握研究物质的方法和程序可见: 化学学习,贵在得法。
当代著名的科学家和科学史学者贝尔纳曾经指出:
“良好的方法能使我们更好地发挥运用天赋的才能,而拙劣的方法则可能阻碍才能的发挥”。
研究物质的性质的常用方法有哪些?
常用观察、实验、分类、比较等方法下面以金属钠为例
体会一下观察法
研究物质性质的基本方法:观察法 【实验目的】
⑴学会观察实验现象的方法;
⑵通过对所观察到的现象进行分析,
揭示物质的性质;
⑶通过观察认识钠的色、态、硬度的密度的相对
大小,熔点的相对高低;
⑷通过观察钠与水反应的现象,分析钠的化学性质。 实例:观察金属钠的物理性质及与水的反应
研究物质性质的基本方法:观察法【实验步骤】
⑴观察盛放在试剂瓶中的金属钠。
(2)用镊子将金属钠从试剂瓶中取出,用滤纸将其
表面的煤油吸干,在玻璃片上用小刀切下一小块
钠(黄豆粒大小),观察钠块的切面。
(3)用小刀或玻璃片挤压豆粒状的钠
(4)向培养皿中加适量水,滴入1~2滴酚酞溶液,
将切好的钠投入到水中,观察现象 实例:观察金属钠的物理性质及与水的反应
研究物质性质的基本方法:观察法金属钠的物理性质 实例:观察金属钠的物理性质及与水的反应
研究物质性质的基本方法:观察法 实例:观察金属钠的物理性质及与水的反应
研究物质性质的基本方法:观察法金属钠的物理性质固体 实例:观察金属钠的物理性质及与水的反应银白较软比水小良好
研究物质性质的基本方法:观察法 实例:观察金属钠的物理性质及与水的反应浮在水面熔化成液态小球在水面无规则游动经过处水溶液变红发出咝咝的声音用火柴可以点燃密度比水小反应放热,钠的熔点低产生气体,受力不匀生成了可溶性碱—NaOH反应剧烈生成了可燃性气体—H2
研究物质性质的基本方法:观察法 实例:观察金属钠的物理性质及与水的反应问题思考1、能写出钠与水反应的化学反应程式吗?2Na+2H2O===2NaOH+H2↑少量的金属钠保存在煤油中2、你注意到金属钠的保存方法是什么?3、你的观察能力与初中相比有哪些提高?
形成了哪些观察的方法以及透过现象
看本质的分析方法。
研究物质性质的基本方法:观察法 实例:观察金属钠的物理性质及与水的反应拓展·延伸1、预测钠与盐酸的反应现象,推测方程式。反应更剧烈
2Na+2HCl==2NaCl+H2↑反应剧烈,产生气泡,并有蓝色沉淀生成2Na+2H2O===2NaOH+H2↑
2NaOH+ CuSO4 ==Cu(OH)2↓+ Na2SO4 2、预测钠与CuSO4稀溶液的反应现象,
观察并分析结果,推测化学反应方程式。
研究物质性质的基本方法:观察法 1、含义:是一种有计划、有目的的用
感官察研究对象的方法 2、观察的详细过程:
用感官观察:看、闻、听、摸
借助仪器观察:提高灵敏度
大脑的积极思维活动:
观察要有明确而具体的目的和计划
要积极思考,及时贮存和处理信息。
要对所观察到的现象进行分析和综合。本课小结
知识上:金属钠的化学性质
方法上:初步学会以观察在研究物质性质中的运用本课重点:
P18.
1. 2. (做在书上)
《第二教材》本节课内容
预习:下节课内容
本课作业:
再见第1章 走进化学科学
第2节 研究物质性质的方法和程序第二课时
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验步骤】
⑴将切好的金属钠放置在空气中,
使其跟氧气反应;
⑵将金属钠放在石棉网上加热,
使其跟氧气反应。
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验记录】
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验记录】很快失去金属光泽与O2反应生成了
白色的Na2O
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验记录】很快失去金属光泽与O2反应生成了
白色的Na2O
研究物质性质的基本方法:实验法 实例:实验探究金属钠与氧气的反应 【实验记录】很快失去金属光泽与O2反应生成了
白色的Na2O剧烈燃烧,发出黄
色火焰,生成淡黄
色固体。与O2反应生成了
淡黄色的的Na2O2
研究物质性质的基本方法:实验法 问题讨论:1、这组实验对你有何启示?
相同的反应物,在不同条件下,可以发生不同的反应,生成不同的产物。2、在你所知道的反应中,还有因条件不同而得到不同反应产物的实例吗? 碳与氧气:氧气量不同,产物不同.
铁与氧气:条件不同,产物不同.
研究物质性质的基本方法:实验法 问题讨论:3、钠为什么保存在煤油中?
能否保存在汽油中?
钠很易与空气中的O2和H2O起反应,而不与煤油起反应,且密度比煤油大,钠沉在煤油下面,使钠与O2和H2O隔绝,达到保护的目的。
钠不能保存在汽油中,因汽油易挥发。4、金属钠着火,能否用水灭火? 补充实验:吹气生火
???
研究物质性质的基本方法:实验法 问题讨论:3、钠为什么保存在煤油中?
能否保存在汽油中?
钠很易与空气中的O2和H2O起反应,而不与煤油起反应,且密度比煤油大,钠沉在煤油下面,使钠与O2和H2O隔绝,达到保护的目的。
钠不能保存在汽油中,因汽油易挥发。4、金属钠着火,能否用水灭火?不能。一是因为钠与水的反应生成氢气能燃烧;
二是因为钠燃烧产物过氧化钠能与水反应生成氧气能助燃.钠与盐溶液的反应实验探究实验课题:钠与硫酸铜溶液反应,
能否置换出铜?假设1:钠是活泼金属,能置换出金属铜
假设2:钠先和水反应,生成的氢氧化钠
与硫酸铜溶液反应生成沉淀。实验方案:
将一小块钠放在硫酸铜溶液中观察。结 论:活泼金属钠(包括钾、钙等)与盐溶液
反应时,一般不能置换出金属,而是钠
先与水反应,生成的碱再与盐溶液反应。
只有与熔融盐作用才能置换出相应的金
属。如:4Na+TiCl4(熔融)=4NaCl+Ti
请写出化学方程式:
拓展提高思考:将一小块钠放入FeCl3溶液中,有什么现象?写出反应的化学方程式。2Na+2H2O=2NaOH+H2↑ ①
2FeCl3+ 3NaOH=Fe(OH)3+3NaCl ②
①×3+②×2,得:
6Na + 6H2O + 2FeCl3 =2Fe (OH)3 +3 H2↑+6NaCl
研究物质性质的基本方法:实验法 小结:1、金属钠放置在空气中,会迅速被氧化而生成氧化钠,失去金属光泽(因此金属钠通常保存在煤油里):
4Na +O2 ==== 2Na2O
2、金属钠在空气中燃烧生成过氧化钠
2Na +O2 ==== 2Na2O2
3、该实验验证了金属钠在不同条件下与氧气反应的性质。
白色
粉末淡黄色
粉末Na2O+H2O==
2NaOH2Na2O2+2H2O==
4NaOH+O2↑Na2O+2HCl==
2NaCl+H2O2Na2O2+4HCl==
4NaCl+2H2O +O2 ↑Na2O+CO2 ==
Na2 CO32Na2O2+2CO2 ==
2Na2 CO3+O2
活动探究:由Na2O的性质
预测并验证Na2O2的性质补充:Na2O2与水的反应过氧化钠能与水迅速反应,产生大量气泡,最后固体消失。
滴加酚酞,溶液先变红后逐渐褪去。2.向试管中插入一根带火星的小木条(验证气体是O2)小木条复燃说明气体确实是氧气吹气生火补充:Na2O2与二氧化碳的反应2Na2O2 + 2CO2 = 2Na2CO3 + O2↑
【结论】
氧化钠是典型的碱性氧化物,
过氧化钠不是碱性氧化物
研究物质性质的基本方法:比较法均为银白
色金属钠比铁硬度、密度小,熔点、沸点低均能与O2、
酸、盐溶液反应①常温下:钠能与O2反应, 铁不能与O2反应
②钠可在空气中燃烧,
铁只能在纯氧中燃烧
③铁可置换出CuSO4溶液中的Cu,钠先与水反应虽都是金属单
质,但物理性
质有较大差别都是较活泼的
金属单质,但
钠比铁更活泼交流·研讨:金属钠与铁的比较
研究物质性质的基本方法:比较法交流·研讨:预测金属的共性物理性质的共性:①有金属光泽、不透明的固体;
②电和热的良导体;
③有延展性。
研究物质性质的基本方法:比较法交流·研讨:预测金属的共性化学性质的共性:①常温或加热条件下与氧气反应;
②常温或加热时与水反应,置换出水中的
氢(比氢活泼);
③与酸反应置换出酸中的氢(比氢活泼);
④与盐溶液应,置换出在金属活动顺序中
排在它后面的金属
研究物质性质的基本方法:分类法预习P12: 分类的必要性:
自然界中物质几百万种,我们不可能一种
一种地研究,只能一类一类地研究。分类的含义:
根据事物的特点分别归类。分类的优点:
可以总结出各类物质的通性和特性
知道某物质的类别,就可推知该物质的一般性质 。
研究物质性质的基本方法:比较法比较的含义:
对两种或两种以上的同类事物辨别异同或高下。比较的优点:
可以物质性质间的异同
可以认识物质间的内在联系
可以对物质的性质进行归纳和概括 例题解析1、下列物质中既能与水反应,又能与CO2反应,且都有O2产生的是( )
A、Na2O B、Na2O2
C、Na D、NaClB 例题解析2、氧化钠与过氧化钠共同之处是( )
A 均是淡黄色固体
B 均是碱性氧化钠
C 与水反应生成物中均有碱
D 均与二氧化碳反应放出氧气C 例题解析3、向紫色石蕊试液中加入过量的Na2O2粉末,充分搅拌,正确的叙述是( )
A 溶液仍为紫色
B 最后溶液变成蓝色
C 最后溶液褪色
D 有气泡产生CD 例题解析4、将一小块金属钠放置在空气中较长时间,请描述可能出现的现象,写出可能发生的化学反应方程式。
表面变暗,再慢慢变湿润,接着形成少量液体,然后形成少量晶体,最后变成白色粉末。
变暗是被氧化成Na2O,变湿润是由于生成的NaOH具有吸湿性,慢慢吸水变成液体,由于空气中CO2缘故而变成Na2CO3,水分蒸发形成Na2CO3·10H2O,最后,晶体风化,变成Na2CO3粉末。
Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3
本课重点: 知识上:金属钠的化学性质
方法上:初步学会以观察、实验、比较、分类等方法在研究物质性质中的运用
作业:
课堂作业:
预测:金属锂和金属钾与氧气反
应的现象和产物。
课外作业:第二教材本节第二课时
再见第1章 走进化学科学
第2节 研究物质性质的方法和程序第三课时 听写下列化学方程式: 钠与水:
钠与硫酸铜溶液:
钠与氧气:
过氧化钠与水:
过氧化钠与二氧化碳:2Na+2H2O=2NaOH+H2 ↑ 4Na +O2 ==== 2Na2O 条件? 2Na +O2 ==== 2Na2O2 条件?2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2 =2Na2 CO3+O2 本课重点: 知识上:掌握氯气的性质
方法上:体会研究物质性质的
程序
研究物质性质的基本方法---小结1.观察法
2.实验法
3.比较法
4.分类法比较钠与金属铁的性质预测金属的通性钠物理性质和与水的反应钠与氧气的反应一、观察氯气的物理性质1、通常从哪些方面认识物质的物理性质?色、态、味,
“二点” ( 熔点、沸点 )
“二度” ( 密度、硬度 )
“三性” (溶解性、导电性、导热性)研究氯气的性质案例一、观察氯气的物理性质1、通常从哪些方面认识物质的物理性质?2、闻气味的方法研究氯气的性质案例 用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。
注意:
这是闻各种气体气味的方法。一、观察氯气的物理性质1、通常从哪些方面认识物质的物理性质?2、闻气味的方法3、试验氯气的溶解性实验(检验气体水溶性的常用方法)研究氯气的性质案例将盛满氯气的试管倒置在水中,水面上升,并呈黄绿色黄绿色刺激性气味
(剧毒!)能溶于水
(氯水)小结氯气的物理性质1、Cl2与O2、 H2都是非金属单质,应该具有某些类似性质。与哪种更相似?与Na、Fe、Cu等金属单质反应。
与S、P等非金属单质反应。从原子结构看,氯元
素与氧元素更相似,它
们的原子的最外层电子
数都比较多,容易得到
电子成为8电子的稳定结构,所以都是较活泼的非金属元素。氧气与氯气都是活泼的非金属单质。预测二、预测氯气的化学性质实验探究实验探究铁在氯气中燃烧录像剧烈燃烧,产生红棕色浓烟,产物水溶液呈棕黄色FeCl3实验探究实验探究铜在氯气中燃烧录像剧烈燃烧,产生红棕色浓烟,
产物水溶液呈棕黄色FeCl3剧烈燃烧,产生棕色浓烟,
产物水溶液呈蓝绿色CuCl2实验探究实验探究氢气在氯气中燃烧录像剧烈燃烧,产生红棕色浓烟,
产物水溶液呈棕黄色FeCl3剧烈燃烧,产生棕色浓烟,
产物水溶液呈棕蓝绿色CuCl2剧烈燃烧,产生苍白色火焰,
集气瓶口有白雾HCl实验探究什么叫燃烧?
燃烧一定要有氧气吗?剧烈燃烧,产生红棕色浓烟,
产物水溶液呈棕黄色FeCl3剧烈燃烧,产生棕色浓烟,
产物水溶液呈棕蓝绿色CuCl2点燃氢气与氯气的混合气体,
发生爆炸HCl实验探究思考 氯气、氧气等都是活泼的非金属单质,其化学性质有相似之处。但是,化学性质能完全相同吗? 除了上述与氧气类似的性质外,氯气还具有什么特性呢? Cl2与O2的性质相似,但氧气不易溶于水,而氯气能溶于水。
思考 那么,氯气溶于水的过程只是一个纯物理过程吗?
能否设计实验证明?
思考与假设思考一、如果氯气溶于水仅仅是纯物理过程,
则氯水成分是什么?思考二、氯水的颜色:黄绿色——说明氯水中含有
什么分子?能否由此说明氯气与水没反应?思考三、若Cl2与H2O发生了反应,可能会生成什么?
如何设计实验检验?Cl2、H2O说明含有Cl2分子。
不能,因为也许氯气只是没反应完全。可能是:Cl2、H2O、HCl(Cl- 、 H+)氯气能否与水反应实验探究 方案:氯水与硝酸银(酸化)溶液反应探究一:氯水中有?无Cl- 白色沉淀现象结论有Cl-实验探究氯气能否与水反应探究气体(H2)现象结论有H+镁条氯水探究二:氯水中有?无H+ (方法1)实验探究氯气能否与水反应探究蓝色石蕊试纸盐酸↓变红先变红后褪色氯水↓探究二:氯水中有?无H+(方法2)实验探究氯气能否与水反应探究现在,能否写出氯气与水反应的化学方程式?Cl2 + H2O == HCl + HClO依据:质量守恒定律实验探究氯气能否与水反应探究探究三:氯水中有漂白作用的是什么? 绿油油的油菜被泄漏的氯气熏成枯黄,为什么假设1: ;
假设2: ;
假设3: 。实验探究氯气能否与水反应探究探究三:氯水中有漂白作用的是什么? 氯水中 已被证实没有漂白性。
你认为起漂白作用的微粒可能是什么?如何设计实验方案,验证假设是否成立?氯气具有漂白性次氯酸具有漂白性氯气和次氯酸都具有漂白性 分析 假设 验证H2O、HCl实验探究装置设计:干燥氯气干燥红纸片湿润红纸片NaOH溶液不褪色褪色吸收余氯实验探究实验结论:1、氯气不仅能溶于水,还能与水发生化学反应,
生成HCl和HClO,反应的化学方程式为:
Cl2+H2O == HCl+HClO
2、干燥的Cl2不具有漂白性。
3、HClO具有漂白性。
原因:它遇到有色物质时,能破坏其中的有机色质,
使有色物质褪色。补充:HClO不稳定,见光分解:2HClO == HCl +O2 ↑二、研究物质性质的基本程序氯气能与碱反应吗? Cl2 + H2O = HCl + HClO分步进行:HCl + NaOH = NaCl + H2OHClO+ NaOH = NaClO + H2OCl2 + 2 NaOH = NaCl + NaClO + H2O次氯酸钠总反应Cl2与NaOH溶液?练习:应用:实验室常用NaOH溶液吸收多余的Cl2 ,以消除污染。知识拓展2Cl2+2Ca(OH) 2== CaCl 2 +Ca(ClO) 2+2H2OCl2与熟石灰反应有何应用?漂白粉制备原理:漂白粉使用原理:CO2+Ca(ClO) 2+2H2O== CaCO 3 +2HClO2漂白粉主要成分: CaCl 2 +Ca(ClO) 2漂白粉有效成分: Ca(ClO) 2漂白粉保存方法:密封(隔绝水和二氧化碳)知识拓展氯水与液氯的区别知识拓展新制氯水与久置氯水的区别混合物分子:离子:Cl2 ,HClO,H2OH+,Cl-,ClO-分子:H2O离子:H+,Cl-新制有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中只有酸性知识拓展氯气物理性质 氯气的物理性质和化学性质化学性质 (1)与铁反应 . 与铜反应 . 与钠反应 . (2)与氢气反应 . (3)与水反应 . (4)与碱反应 . 小结实验室中多余的氯气是如何处理的?为什么?用碱液吸收多余的氯气
(1)氯气有毒,污染空气.
(2)氯气可与碱液反应问题?思考课堂练习1、下列物质属于纯净物的是( )
A、液氯 B、氯水
C、盐酸 D、漂白粉A课堂练习1、下列物质属于纯净物的是( )
A、液氯 B、氯水
C、盐酸 D、漂白粉A2、将下列物质分别加到干燥的红色布条上,不能使其褪色的是( )
A、新制的氯水 B、盐酸
C、液氯
D、盐酸和次氯酸的混合溶液BC课堂练习3、下列常用的干燥剂中,不能用来干燥氯气的是( )
A、浓硫酸 B、碱石灰
C、无水CaCl2 D、P2O5B课堂练习4、氯气在第一次世界大战中曾作为化学武器被使用过,当遇到氯气制成的炸弹爆炸时,防御的方法是( )
A、人、畜躲到低洼地方
B、人、畜躲到地势高的地方
C、人、畜躲到河沟或水塘边
D、用浸过碱性溶液或肥皂水的毛巾捂住鼻嘴处BD5.将新制的氯水缓缓滴入预先滴有酚酞的 NaOH溶液中,当滴到一定量时红色完全褪去。产生这一现象的原因可能有两种:
(1)_____________________________
(2)____________________________新制氯水中的HCl、HClO与 NaOH发生中和反应,使NaOH无剩余。新制氯水中HClO具有漂白性,使红色溶液褪色课堂练习请大家阅读:P15假说 模型各种原子模型假设 本课重点: 知识上:氯气的化学性质
方法上:初步学会研究物质性质的程序 作业:
课外作业:第二课堂本节第二课时再见
