化学:2.3《化学平衡》课件(新人教版选修4)
文档属性
| 名称 | 化学:2.3《化学平衡》课件(新人教版选修4) |  | |
| 格式 | rar | ||
| 文件大小 | 162.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-08-31 20:29:00 | ||
图片预览





文档简介
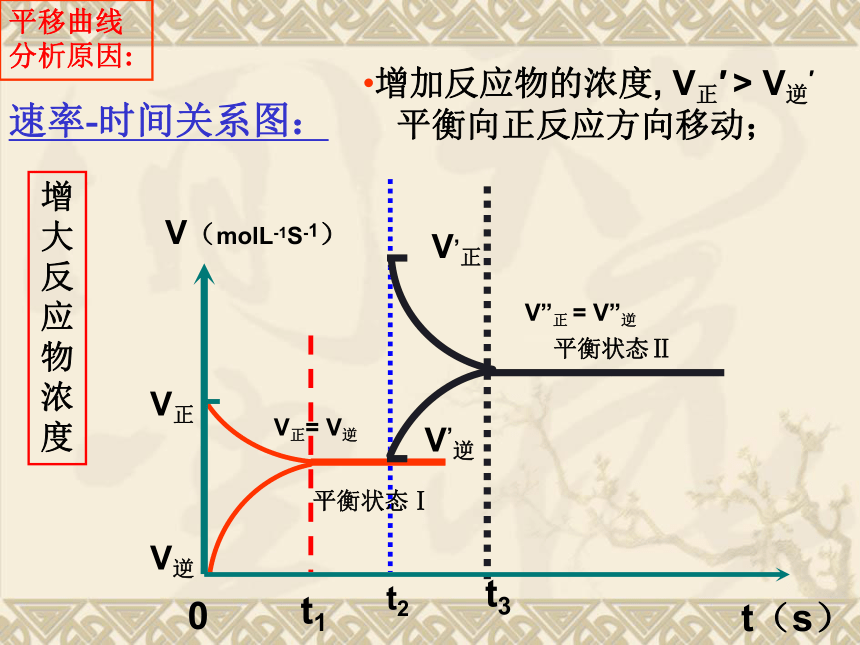
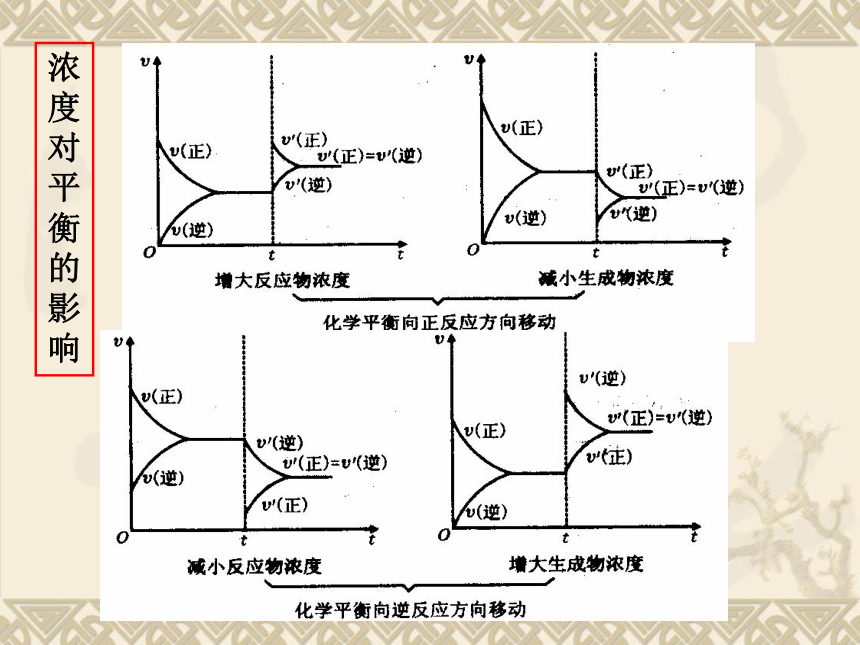
课件16张PPT。第二章 化学反应速率与化学平衡第三节化学平衡一、浓度对化学平衡的影响: 增加Fe3+ 或 SCN-的浓度,平衡向生成Fe(SCN)3的方向移动,故红色加深。 *增加反应物的浓度平衡向正反应方向移动; *减少生成物的浓度,平衡向正反应方向移动; *减小反应物浓度或增加生成物的浓度,平衡 向逆反应方向移动.Fe(SCN)3 + 3OH- ? Fe(OH)3↓+ 3SCN-t2V”正 = V”逆V’逆V,正t3平衡状态Ⅱ增大反应物浓度增加反应物的浓度, V正′ > V逆′
平衡向正反应方向移动;V正= V逆浓度对平衡的影响注意:
①对平衡体系中的固态和纯液态物质,其浓度可看作 一个常数,增加或减小固态或液态纯净物的量并不 影响V正、V逆的大小,所以化学平衡不移动。
②只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,新平衡状态下的反应速率一定大于原 平衡状态;减小浓度,新平衡状态下的速率一定小 于原平衡状态
③反应物有两种或两种以上, 增加一种物质的浓度, 该 物质的平衡转化率降低, 而其他物质的转化率提高。二、压强对化学平衡的影响: NH3%随着压强的增大而增大,即平衡向正反应的方向移动。实验数据:解释:说明:增大压强,正逆反应速率均增大,但增大倍数 不一样,平衡向着体积缩小的方向移动加压→体积缩小→浓度增大→正反应速率增大
逆反应速率增大→ V正>V逆→平衡向正反应方向移动。先决条件:结论: 反应体系中有气体参加且反应
前后总体积发生改变。
aA(g)+bB(g) cC(g)+dD(g)
a+b≠c+d 对于反应前后气体体积发生变化的化学反应,在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动,减小压强,会使化学平衡向着气体体积增大的方向移动。体积缩小:平衡向气体分子数目减少的方向
体积增大:平衡向气体分子数目增多的方向说明: V(molL-1S-1)0t2V”正 = V”逆V’逆V‘正增大压强速率-时间关系图:aA(g)+bB(g) cC(g)+dD(g) a+b > c+d压强对化学平衡的影响aA(g)+bB(g) cC(g)思考:对于反应
H2O+CO H2+CO2
如果增大压强,反应速率是否改变,平衡是否移动?高温催化剂速率-时间关系图:V’正= V’逆增大压强,正逆反应速率均增大,但增大倍数一样,
V’正= V’逆,平衡不移动。t2三、温度对化学平衡的影响: 在其它条件不变的情况下,
升高温度,平衡向吸热反应方向移动。
降低温度,平衡向放热反应方向移动。1.结论:2.原因分析: 在其它条件不变的情况下, 升高温度,不 管是吸热反应还是放热反应,反应速率都增大,但吸热反应增大的倍数大于放热反应增大的倍数,故平衡向吸热反应的方向移动.t2V”正 = V”逆V’逆V‘正升高温度(正反应是放热反应)2NO2 N2O4温度对化学平衡的影响四、催化剂对化学平衡的影响: 同等程度改变化学反应速率,V’正= V’逆,只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。V’正= V’逆 催化剂对可逆反应的影响: 化学平衡移动:化学平衡状态1
V正 =V逆
各物质组成一定 化学平衡状态2
V正’ =V逆’
各物质组分含
量达新值 平衡被破坏
V正≠V逆
各物质组分变化新的平衡状态与旧的平衡状态不同在于:
1] V和V′数值不同,可能大也可能小。
2]平衡混合物中各物质含量一定发生变化 可见,要引起化学平衡的移动,必须是由于外界条件的改变而引起V正≠ V逆。 平衡移动的本质: 化学平衡为动态平衡,条件改变造成 V正≠ V逆平衡移动原理(勒沙特列原理): 如果改变影响平衡的条件(如浓度、压强、或温度)等,平衡就向能减弱这种改变的方向移动。
平衡向正反应方向移动;V正= V逆浓度对平衡的影响注意:
①对平衡体系中的固态和纯液态物质,其浓度可看作 一个常数,增加或减小固态或液态纯净物的量并不 影响V正、V逆的大小,所以化学平衡不移动。
②只要是增大浓度,不论增大的是反应物浓度,还是生成物浓度,新平衡状态下的反应速率一定大于原 平衡状态;减小浓度,新平衡状态下的速率一定小 于原平衡状态
③反应物有两种或两种以上, 增加一种物质的浓度, 该 物质的平衡转化率降低, 而其他物质的转化率提高。二、压强对化学平衡的影响: NH3%随着压强的增大而增大,即平衡向正反应的方向移动。实验数据:解释:说明:增大压强,正逆反应速率均增大,但增大倍数 不一样,平衡向着体积缩小的方向移动加压→体积缩小→浓度增大→正反应速率增大
逆反应速率增大→ V正>V逆→平衡向正反应方向移动。先决条件:结论: 反应体系中有气体参加且反应
前后总体积发生改变。
aA(g)+bB(g) cC(g)+dD(g)
a+b≠c+d 对于反应前后气体体积发生变化的化学反应,在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动,减小压强,会使化学平衡向着气体体积增大的方向移动。体积缩小:平衡向气体分子数目减少的方向
体积增大:平衡向气体分子数目增多的方向说明: V(molL-1S-1)0t2V”正 = V”逆V’逆V‘正增大压强速率-时间关系图:aA(g)+bB(g) cC(g)+dD(g) a+b > c+d压强对化学平衡的影响aA(g)+bB(g) cC(g)思考:对于反应
H2O+CO H2+CO2
如果增大压强,反应速率是否改变,平衡是否移动?高温催化剂速率-时间关系图:V’正= V’逆增大压强,正逆反应速率均增大,但增大倍数一样,
V’正= V’逆,平衡不移动。t2三、温度对化学平衡的影响: 在其它条件不变的情况下,
升高温度,平衡向吸热反应方向移动。
降低温度,平衡向放热反应方向移动。1.结论:2.原因分析: 在其它条件不变的情况下, 升高温度,不 管是吸热反应还是放热反应,反应速率都增大,但吸热反应增大的倍数大于放热反应增大的倍数,故平衡向吸热反应的方向移动.t2V”正 = V”逆V’逆V‘正升高温度(正反应是放热反应)2NO2 N2O4温度对化学平衡的影响四、催化剂对化学平衡的影响: 同等程度改变化学反应速率,V’正= V’逆,只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。V’正= V’逆 催化剂对可逆反应的影响: 化学平衡移动:化学平衡状态1
V正 =V逆
各物质组成一定 化学平衡状态2
V正’ =V逆’
各物质组分含
量达新值 平衡被破坏
V正≠V逆
各物质组分变化新的平衡状态与旧的平衡状态不同在于:
1] V和V′数值不同,可能大也可能小。
2]平衡混合物中各物质含量一定发生变化 可见,要引起化学平衡的移动,必须是由于外界条件的改变而引起V正≠ V逆。 平衡移动的本质: 化学平衡为动态平衡,条件改变造成 V正≠ V逆平衡移动原理(勒沙特列原理): 如果改变影响平衡的条件(如浓度、压强、或温度)等,平衡就向能减弱这种改变的方向移动。
