2010届高三化学一轮考点精讲精析(55):物质的分离与提纯
文档属性
| 名称 | 2010届高三化学一轮考点精讲精析(55):物质的分离与提纯 |  | |
| 格式 | rar | ||
| 文件大小 | 85.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-09-07 18:56:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
2010届高三化学一轮考点精讲精析
考点55 物质的分离与提纯
考点聚焦
1. 知道物质分离和提纯的常用方法
2. 能根据常见物质的性质设计分离和提纯的方案,并初步掌握其操作技能。
知识梳理
混合物的分离,就是将混合物中的各组分各自独立开来。分离时要做到操作正确,操作简便,少用试剂,量不减少,纯度合格。 混合物的提纯,即将混合物中的杂质除去而使主成分(非杂质)达到一定的纯度保留下来,混合物的提纯又叫做物质的净化或除杂。对混合物的提纯要做到:原理正确,操作简便,少用试剂(主要成分)量不减少(或减少很少), 保护环境。
选择混合物分离、提纯的方法首先要掌握混合物中各物质的性质,包括物理性质和化学性质。不同物质在某些性质上的差异是分离和提纯的基础。
一、固体与液体的混合物
⑴难溶固体与液体混合物常用过滤的方法分离。
思考:1.若难溶固体通过沉淀法得到,如何判断沉淀是否完全?
2.过滤需要哪些仪器、如何操作?
3.如何洗涤沉淀以及判断沉淀已经洗涤干净?
⑵固体溶解于液体中如何分离? 蒸发结晶和降温结晶有何区别?
二、固体与固体的混合物
思考:溶解过滤、结晶或重结晶、加热升华这三种办法适用的对象分别是什么?
操作时有哪些注意事项?
三、 胶体与溶液混合物
胶体中常混有溶液,一般用_________或__________的方法进行分离和提纯。
四、 气体与气体的混合物
除去气体中的水蒸气通常叫干燥,除去气体中的其它杂质通常叫洗气。除去气体中杂质通常有以下装置:
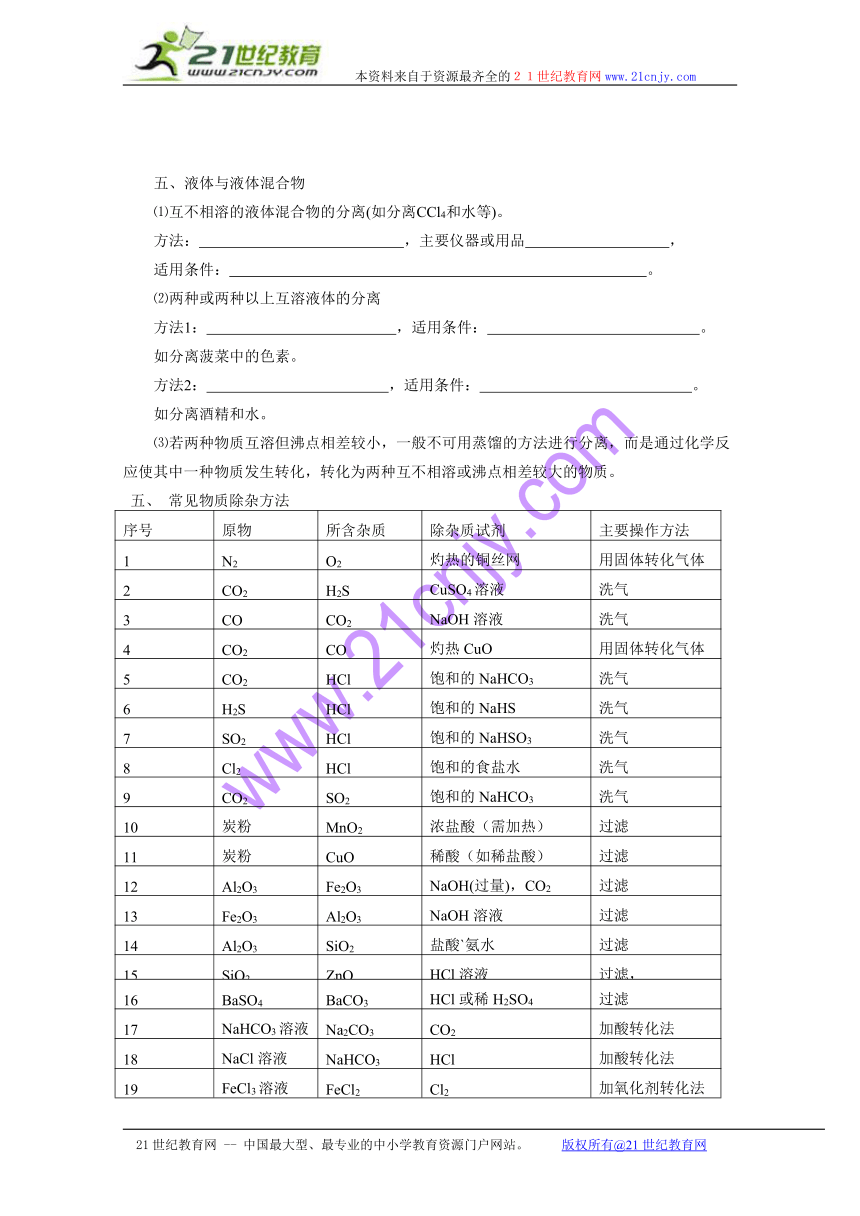
五、液体与液体混合物
⑴互不相溶的液体混合物的分离(如分离CCl4和水等)。
方法: ,主要仪器或用品 ,
适用条件: 。
⑵两种或两种以上互溶液体的分离
方法1: ,适用条件: 。
如分离菠菜中的色素。
方法2: ,适用条件: 。
如分离酒精和水。
⑶若两种物质互溶但沸点相差较小,一般不可用蒸馏的方法进行分离,而是通过化学反应使其中一种物质发生转化,转化为两种互不相溶或沸点相差较大的物质。
五、 常见物质除杂方法
序号 原物 所含杂质 除杂质试剂 主要操作方法
1 N2 O2 灼热的铜丝网 用固体转化气体
2 CO2 H2S CuSO4溶液 洗气
3 CO CO2 NaOH溶液 洗气
4 CO2 CO 灼热CuO 用固体转化气体
5 CO2 HCl 饱和的NaHCO3 洗气
6 H2S HCl 饱和的NaHS 洗气
7 SO2 HCl 饱和的NaHSO3 洗气
8 Cl2 HCl 饱和的食盐水 洗气
9 CO2 SO2 饱和的NaHCO3 洗气
10 炭粉 MnO2 浓盐酸(需加热) 过滤
11 炭粉 CuO 稀酸(如稀盐酸) 过滤
12 Al2O3 Fe2O3 NaOH(过量),CO2 过滤
13 Fe2O3 Al2O3 NaOH溶液 过滤
14 Al2O3 SiO2 盐酸`氨水 过滤
15 SiO2 ZnO HCl溶液 过滤,
16 BaSO4 BaCO3 HCl或稀H2SO4 过滤
17 NaHCO3溶液 Na2CO3 CO2 加酸转化法
18 NaCl溶液 NaHCO3 HCl 加酸转化法
19 FeCl3溶液 FeCl2 Cl2 加氧化剂转化法
20 FeCl3溶液 CuCl2 Fe 、Cl2 过滤
21 FeCl2溶液 FeCl3 Fe 加还原剂转化法
22 CuO Fe (磁铁) 吸附
23 Fe(OH)3胶体 FeCl3 蒸馏水 渗析
24 CuS FeS 稀盐酸 过滤
25 I2晶体 NaCl -------- 加热升华
26 NaCl晶体 NH4Cl -------- 加热分解
27 KNO3晶体 NaCl 蒸馏水 重结晶.
28 乙烯 SO2、H2O 碱石灰 加固体转化法
29 乙烷 C2H4 溴的四氯化碳溶液 洗气
30 溴苯 Br2 NaOH稀溶液 分液
31 甲苯 苯酚 NaOH溶液 分液
32 己醛 乙酸 饱和Na2CO3 蒸馏
33 乙醇 水(少量) 新制CaO 蒸馏
34 苯酚 苯 NaOH溶液、CO2 分液
试题枚举
【例1】提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为
A .加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量的硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量的硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量的硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量的硝酸
解析 A步骤中加入过量碳酸钠,钠离子是新杂质,此法不可用;B步骤中加入过量硫酸钾,过量的硫酸钾是新杂质,此法不可用;C步骤加入过量硫酸钠,钠离子和过量的硫酸根离子,都是新杂质,此法不可用.。只有D碳酸钾可使碳酸钡生成碳酸钡沉淀,过滤出去后,过量碳酸钾跟适量硝酸生成硝酸钾和CO2气体,硝酸钾是待提纯的物质而CO2将逸出。所以此法可用,应选D项。
答案 D
【例2】(06四川高考26) 海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三角架外,还需要用到的仪器是 (从下列仪器中选择所需的仪器,用标号字母填写在空白处)
A、烧杯 B、坩埚 C、表面皿 D、泥三角 E、酒精灯 F、干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法 。
解析 本题是以从海带中提取碘为背景,综合考查了物质的分离、检验等基本实验知识。
灼烧海带时,除需要三脚架外,还需要有坩埚、泥三角和酒精灯。步骤③是由海带灰悬浊液得到含碘离子的溶液,因此需要进行过滤。步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,只能采用蒸馏的方法。步骤④反应的离子方程式利用实验室制取Cl2的知识;选择用苯来提取碘的理由是因为苯与水互不相溶且碘在苯中的溶解度比在水中大;根据碘单质遇淀粉变蓝这一实验现象可以通过取少量提取碘后的溶液,加入淀粉看是否变蓝来检验。
答案(1)灼烧海带需要坩埚(盛放海带)、搁放坩埚的泥三角、火源酒精灯。注意不要干燥器。BDE (2)分离悬浊液和溶液应用过滤、分离出碘和苯用蒸馏。
(3)2I-+MnO4-+4H+==Mn2++I2+2H2O(4)苯与水互不相溶,碘在苯中的溶解度比在水中大。(5)检验单质碘方法:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘)。
【例3】(2002·广东)已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
序号 实验步骤 简述实验操作(不必叙述如何组装实验装置)
① 溶解 将混合物放入烧杯中,加入98% H2SO4 ,充分搅拌直到固体不再溶解。
②
③
④
⑤ 洗涤沉淀
⑥ 检验沉淀是否洗净
解析 本题通过对混合物的分离考查实验设计和化学实验基本操作。
题中给出了信息“化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶”,又给出了第一步实验操作“将混合物放入烧杯中,加入98% H2SO4 ,充分搅拌直到固体不再溶解”。综合分析两个信息,应该知道实验设计的大体思路:用浓硫酸将甲溶解,过滤出乙后,滤液加入水中稀释同时析出甲,再过滤。
知道了实验设计的大体思路之后,就需要考虑操作的细节问题了:含浓硫酸的滤液与水混合时应怎样操作?过滤得到的沉淀物需要洗涤,怎样洗?怎样才算洗干净了?等等。
答案②过滤 将烧杯中物质倒入耐酸过滤器中过滤,得滤液。
③析出沉淀 将滤液沿烧杯壁慢慢倒入足量水中,并不段搅拌,直至析出全部固体。
④过滤 将此烧杯中的物质倒入过滤器中过滤,得固体。
⑤用蒸馏水冲洗滤纸上的固体若干次,直至洗净。
⑥取新得到的洗出液少许,滴入用盐酸酸化的BaCl2 溶液 ,若没有白色浑浊出现,则说明沉淀已洗净,若有白色浑浊出现,则说明沉淀没有洗净。
21世纪教育网
www.
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
2010届高三化学一轮考点精讲精析
考点55 物质的分离与提纯
考点聚焦
1. 知道物质分离和提纯的常用方法
2. 能根据常见物质的性质设计分离和提纯的方案,并初步掌握其操作技能。
知识梳理
混合物的分离,就是将混合物中的各组分各自独立开来。分离时要做到操作正确,操作简便,少用试剂,量不减少,纯度合格。 混合物的提纯,即将混合物中的杂质除去而使主成分(非杂质)达到一定的纯度保留下来,混合物的提纯又叫做物质的净化或除杂。对混合物的提纯要做到:原理正确,操作简便,少用试剂(主要成分)量不减少(或减少很少), 保护环境。
选择混合物分离、提纯的方法首先要掌握混合物中各物质的性质,包括物理性质和化学性质。不同物质在某些性质上的差异是分离和提纯的基础。
一、固体与液体的混合物
⑴难溶固体与液体混合物常用过滤的方法分离。
思考:1.若难溶固体通过沉淀法得到,如何判断沉淀是否完全?
2.过滤需要哪些仪器、如何操作?
3.如何洗涤沉淀以及判断沉淀已经洗涤干净?
⑵固体溶解于液体中如何分离? 蒸发结晶和降温结晶有何区别?
二、固体与固体的混合物
思考:溶解过滤、结晶或重结晶、加热升华这三种办法适用的对象分别是什么?
操作时有哪些注意事项?
三、 胶体与溶液混合物
胶体中常混有溶液,一般用_________或__________的方法进行分离和提纯。
四、 气体与气体的混合物
除去气体中的水蒸气通常叫干燥,除去气体中的其它杂质通常叫洗气。除去气体中杂质通常有以下装置:
五、液体与液体混合物
⑴互不相溶的液体混合物的分离(如分离CCl4和水等)。
方法: ,主要仪器或用品 ,
适用条件: 。
⑵两种或两种以上互溶液体的分离
方法1: ,适用条件: 。
如分离菠菜中的色素。
方法2: ,适用条件: 。
如分离酒精和水。
⑶若两种物质互溶但沸点相差较小,一般不可用蒸馏的方法进行分离,而是通过化学反应使其中一种物质发生转化,转化为两种互不相溶或沸点相差较大的物质。
五、 常见物质除杂方法
序号 原物 所含杂质 除杂质试剂 主要操作方法
1 N2 O2 灼热的铜丝网 用固体转化气体
2 CO2 H2S CuSO4溶液 洗气
3 CO CO2 NaOH溶液 洗气
4 CO2 CO 灼热CuO 用固体转化气体
5 CO2 HCl 饱和的NaHCO3 洗气
6 H2S HCl 饱和的NaHS 洗气
7 SO2 HCl 饱和的NaHSO3 洗气
8 Cl2 HCl 饱和的食盐水 洗气
9 CO2 SO2 饱和的NaHCO3 洗气
10 炭粉 MnO2 浓盐酸(需加热) 过滤
11 炭粉 CuO 稀酸(如稀盐酸) 过滤
12 Al2O3 Fe2O3 NaOH(过量),CO2 过滤
13 Fe2O3 Al2O3 NaOH溶液 过滤
14 Al2O3 SiO2 盐酸`氨水 过滤
15 SiO2 ZnO HCl溶液 过滤,
16 BaSO4 BaCO3 HCl或稀H2SO4 过滤
17 NaHCO3溶液 Na2CO3 CO2 加酸转化法
18 NaCl溶液 NaHCO3 HCl 加酸转化法
19 FeCl3溶液 FeCl2 Cl2 加氧化剂转化法
20 FeCl3溶液 CuCl2 Fe 、Cl2 过滤
21 FeCl2溶液 FeCl3 Fe 加还原剂转化法
22 CuO Fe (磁铁) 吸附
23 Fe(OH)3胶体 FeCl3 蒸馏水 渗析
24 CuS FeS 稀盐酸 过滤
25 I2晶体 NaCl -------- 加热升华
26 NaCl晶体 NH4Cl -------- 加热分解
27 KNO3晶体 NaCl 蒸馏水 重结晶.
28 乙烯 SO2、H2O 碱石灰 加固体转化法
29 乙烷 C2H4 溴的四氯化碳溶液 洗气
30 溴苯 Br2 NaOH稀溶液 分液
31 甲苯 苯酚 NaOH溶液 分液
32 己醛 乙酸 饱和Na2CO3 蒸馏
33 乙醇 水(少量) 新制CaO 蒸馏
34 苯酚 苯 NaOH溶液、CO2 分液
试题枚举
【例1】提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为
A .加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量的硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量的硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量的硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量的硝酸
解析 A步骤中加入过量碳酸钠,钠离子是新杂质,此法不可用;B步骤中加入过量硫酸钾,过量的硫酸钾是新杂质,此法不可用;C步骤加入过量硫酸钠,钠离子和过量的硫酸根离子,都是新杂质,此法不可用.。只有D碳酸钾可使碳酸钡生成碳酸钡沉淀,过滤出去后,过量碳酸钾跟适量硝酸生成硝酸钾和CO2气体,硝酸钾是待提纯的物质而CO2将逸出。所以此法可用,应选D项。
答案 D
【例2】(06四川高考26) 海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三角架外,还需要用到的仪器是 (从下列仪器中选择所需的仪器,用标号字母填写在空白处)
A、烧杯 B、坩埚 C、表面皿 D、泥三角 E、酒精灯 F、干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法 。
解析 本题是以从海带中提取碘为背景,综合考查了物质的分离、检验等基本实验知识。
灼烧海带时,除需要三脚架外,还需要有坩埚、泥三角和酒精灯。步骤③是由海带灰悬浊液得到含碘离子的溶液,因此需要进行过滤。步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,只能采用蒸馏的方法。步骤④反应的离子方程式利用实验室制取Cl2的知识;选择用苯来提取碘的理由是因为苯与水互不相溶且碘在苯中的溶解度比在水中大;根据碘单质遇淀粉变蓝这一实验现象可以通过取少量提取碘后的溶液,加入淀粉看是否变蓝来检验。
答案(1)灼烧海带需要坩埚(盛放海带)、搁放坩埚的泥三角、火源酒精灯。注意不要干燥器。BDE (2)分离悬浊液和溶液应用过滤、分离出碘和苯用蒸馏。
(3)2I-+MnO4-+4H+==Mn2++I2+2H2O(4)苯与水互不相溶,碘在苯中的溶解度比在水中大。(5)检验单质碘方法:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘)。
【例3】(2002·广东)已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
序号 实验步骤 简述实验操作(不必叙述如何组装实验装置)
① 溶解 将混合物放入烧杯中,加入98% H2SO4 ,充分搅拌直到固体不再溶解。
②
③
④
⑤ 洗涤沉淀
⑥ 检验沉淀是否洗净
解析 本题通过对混合物的分离考查实验设计和化学实验基本操作。
题中给出了信息“化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶”,又给出了第一步实验操作“将混合物放入烧杯中,加入98% H2SO4 ,充分搅拌直到固体不再溶解”。综合分析两个信息,应该知道实验设计的大体思路:用浓硫酸将甲溶解,过滤出乙后,滤液加入水中稀释同时析出甲,再过滤。
知道了实验设计的大体思路之后,就需要考虑操作的细节问题了:含浓硫酸的滤液与水混合时应怎样操作?过滤得到的沉淀物需要洗涤,怎样洗?怎样才算洗干净了?等等。
答案②过滤 将烧杯中物质倒入耐酸过滤器中过滤,得滤液。
③析出沉淀 将滤液沿烧杯壁慢慢倒入足量水中,并不段搅拌,直至析出全部固体。
④过滤 将此烧杯中的物质倒入过滤器中过滤,得固体。
⑤用蒸馏水冲洗滤纸上的固体若干次,直至洗净。
⑥取新得到的洗出液少许,滴入用盐酸酸化的BaCl2 溶液 ,若没有白色浑浊出现,则说明沉淀已洗净,若有白色浑浊出现,则说明沉淀没有洗净。
21世纪教育网
www.
w.w.w.k.s.5.u.c.o.m
www.
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
