物质的量课件
图片预览








文档简介
课件35张PPT。物质的量梅李中学 陆亚教学过程设问:一个原子有多重啊?设问、分析教师讲解、点评学生练习布置课外作业曹操:“这头大象有多重啊?”曹冲:“我有办法,我有办法!” 化整为零“一个原子有多重啊”“我有办法 ! 我有办法?” 积少成多微观粒子的数目宏观物质的质量 质 的
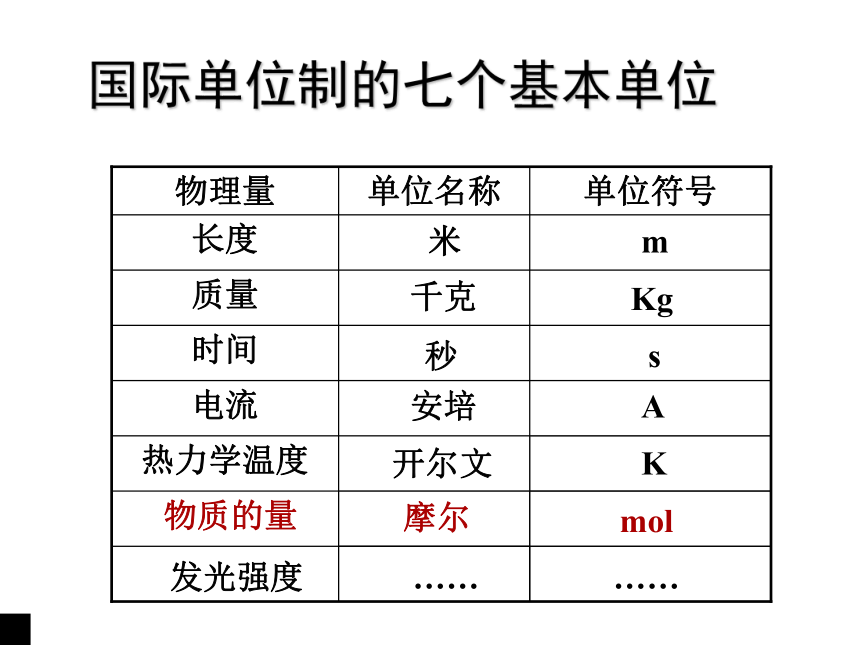
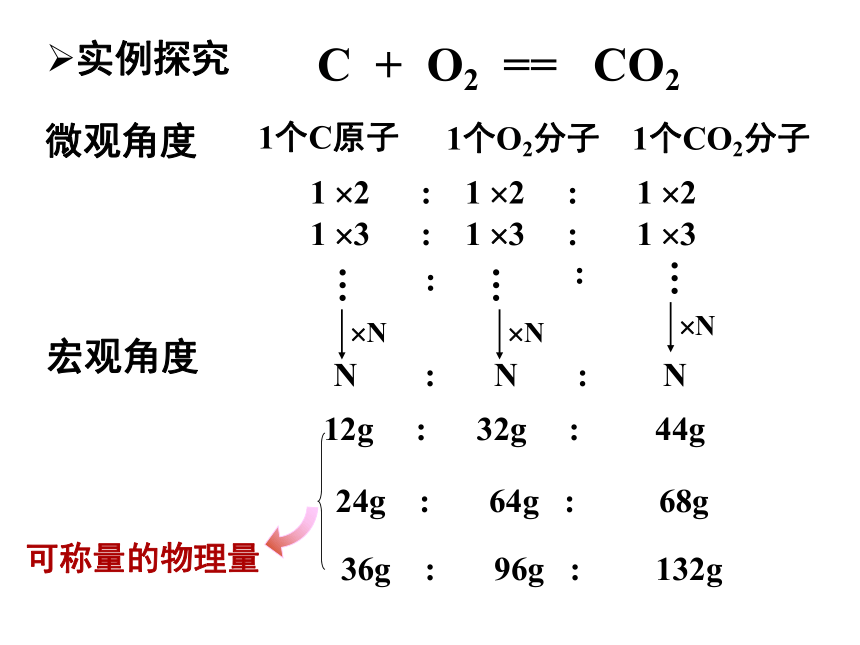
物 量想想看: 你如何得知10kg小米有多少粒?18g 水中含有多少个H2O分子?国际单位制的七个基本单位米发光强度 …… ……安培A开尔文K摩尔mol千克秒mKgs物质的量C + O2 == CO2微观角度宏观角度1个C原子1个O2分子1个CO2分子?N?N?N12g : 32g : 44g36g : 96g : 132g24g : 64g : 68g可称量的物理量1 ?2 : 1 ?2 : 1 ?21 ?3 : 1 ?3 : 1 ?3实例探究 N : N : N物质的量① 物质的量是国际单位制中七个基本物理量之一,它表示一定数量的粒子集体。② 符号:n③ 单位: mol1.“物质的量”是专有名词、是一个整体,
不可拆开 注意: 分子、原子、离子、质子、电子……2.微观粒子指摩尔①摩尔(mol)是物质的量的单位②基准:0、012Kg 12C中所含有的碳原子数即阿伏加德罗常数(NA)定义:0.012Kg12C中所含的碳原子的个数近似值: 6.02ㄨ1023 mol-1阿伏加德罗常数(NA)1mol任何粒子的粒子数为NA,约为6.02ㄨ1023 个602 000 000 000 000 000 000 000有多大? 喜欢下国际象棋的同学可能听说过舍罕王重赏国际象棋发现者宰相萨?班?达依尔的故事: “陛下,请您在这张棋盘的第一个小格内,赏给我一粒麦子;在第二个小格内给两粒;第三格内给四粒,照这样下去,每一小格内都比前一小格加一倍,陛下啊,把这样摆满棋盘上所有64格的麦粒,都赏给您的仆人吧!”麦粒的总数= 1 + 2 + 4 + 8 + … + 263
= 264 – 1
=1.845 × 1019这竟是全世界在2000年内所生产的全部小麦! 602 000 000 000 000 000 000 000有多大?6.02×1023粒小麦全球60亿人每人每天吃一斤,要吃 年 14万物质的量只适用于微观粒子,使用摩尔作单位时,所指粒子必须十分明确,且粒子的种类要用化学式表示。1 mol 氢 错 必须指明是 H2 或 H 或 H+2 mol CO2 正确0.3 mol OH- 正确1.5 mol e- 正确课堂练习:判断
下面叙述是否正确
(1) 每摩尔物质含有 (6.02)(1023)个微粒
(2) 摩尔是七个物理量之一
(3) 摩尔是物质的质量单位
(4) 1 摩尔氧
( 5 ) 1摩尔的大米约含有 (6.02)(1023) 个米粒
(6) 2摩尔H2O每摩尔物质含有阿伏加德 罗常数个微粒,近似值为 (6.02)(1023)
物质的量 是七个基本物理量之一 。摩尔是物质的量的单位必须指明微粒的种类,是氧原子、氧分子还是氧离子物质的量只适用于微观粒子,不能用来说明宏观物质。
正确填空 1mol C 中约含有 个C;
1mol SO42-中约含有 个SO42-;
1mol e-中约含有 个e-;
1mol O2 中约含有 个O2;2mol O2 中约含有 个O2;nmol O2 中约含有 个O2;6.02×10236.02×10236.02×10236.02×10232x6.02×1023nx6.02×1023物质的量、阿伏加德罗常数 与微粒之间的关系 物质的量(n)=物质所含微粒数目(N)阿伏加德罗常数(NA)nNX NA÷ NA = 0.5 mol ×6.02 ×1023 mol-1N(O)= 2 x n (O2) x NA例1:0、5mol 02中,含有02的分子数目是多少?含有O的数目是多少?解:O2的分子数为N = n × NA= 3.01 × 1023O的数目为= 2×0.5 mol×6.02×1 023 mol-1= 6.02 × 1023答:O2的分子数为3.01 × 1023个,0的数目为
6.02 × 1023个 例2:9、03 x 1022个H2分子的物质的量是多少?共含有多少mol e- ?解:
n(H2) = N(H2) NA=9、03 x 10226、02 x 1023 mol-1=0、15 moln(e-) = 2 x n(H2) = 2 x 0、15mol答:……= 0、30 mol 1 mol H2O中有多少 mol H,多少 mol O? H2O 11 molNA2HO212NANA1 mol2 mol 结论:微粒之间的个数之比也就是物质的量之比微粒个数微粒集团物质的量例3:1 mol Na2SO4含有 mol Na+ 2 mol SO42- 1 个氧原子 练习: 0.5 mol K2CO3含有 mol K+ 1 mol CO32- 0.5个氧原子1.5 x 6.02 x 10234 x 6.02 x 1023Na2SO4 = 2 Na+ + SO42-【思考】: 0.012kg 12C中所含的碳原子数——阿伏加德罗常数 ,含阿伏加德罗常数个粒子的粒子的物质的量是1mol。
1、1mol12C的质量是0.012kg,那么1mol其他物质的质量又是多少呢?
2、1mol任何物质都约含有6.02X1023个粒子,
那么这1mol物质的质量到底有多大?NANANANANANA1256981823173、分析以上计算结果可得出什么规律?(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。
1mol任何微粒或物质的质量是以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。摩尔质量① 单位物质的量的物质所具有的质量② 符号:M③ 单位为“g/mol”。④ 表达式:M=m/n课堂练习:1、填空:
(1)1molCu质量是 克
(2)1molO2质量是 克
(3) 1molCO2质量是 克
(4) 1molCl-质量是 克
(5) 1molNa+质量是 克
(6) 1molNaCl质量是 克64324435.52358.5课堂练习:2、(1)、O2的摩尔质量是多少?
(2)、H2SO4的摩尔质量是多少?
(3)、100molH2O的质量是多少克?
(4)、0.1molOH-的质量是多少克?(5)、24.5gH2SO4的物质的量是多少?
(6)、85.5gAl2(SO4)3中含有Al3+和SO42-的
物质的量各是多少?
课堂练习:(7)、含有1.5X1022个分子的物质,其质量
为0.7g,求该物质的相对分子质量?
(8)、122.5gKClO3中所含的Cl原子数与多少
克CaCl2中所含的Cl原子数相等?小结n物质的量(mol)N粒子数m物质质量(g)÷NA(mol-1)×NA
(mol-1)
÷M
M(g/mol)×M(g/mol)物质的量给我们的交流和解决问题带来方便了吗?讨论1:“一滴水中有多少个分子啊?”“我有办法 ?我有办法!” 讨论2约1.7万亿亿个!“这个C原子有多重啊”“我有办法 ! 我有办法!” C原子H2O分子1L H2O生物界大气地球1.993 ?10-23g讨论3
物 量想想看: 你如何得知10kg小米有多少粒?18g 水中含有多少个H2O分子?国际单位制的七个基本单位米发光强度 …… ……安培A开尔文K摩尔mol千克秒mKgs物质的量C + O2 == CO2微观角度宏观角度1个C原子1个O2分子1个CO2分子?N?N?N12g : 32g : 44g36g : 96g : 132g24g : 64g : 68g可称量的物理量1 ?2 : 1 ?2 : 1 ?21 ?3 : 1 ?3 : 1 ?3实例探究 N : N : N物质的量① 物质的量是国际单位制中七个基本物理量之一,它表示一定数量的粒子集体。② 符号:n③ 单位: mol1.“物质的量”是专有名词、是一个整体,
不可拆开 注意: 分子、原子、离子、质子、电子……2.微观粒子指摩尔①摩尔(mol)是物质的量的单位②基准:0、012Kg 12C中所含有的碳原子数即阿伏加德罗常数(NA)定义:0.012Kg12C中所含的碳原子的个数近似值: 6.02ㄨ1023 mol-1阿伏加德罗常数(NA)1mol任何粒子的粒子数为NA,约为6.02ㄨ1023 个602 000 000 000 000 000 000 000有多大? 喜欢下国际象棋的同学可能听说过舍罕王重赏国际象棋发现者宰相萨?班?达依尔的故事: “陛下,请您在这张棋盘的第一个小格内,赏给我一粒麦子;在第二个小格内给两粒;第三格内给四粒,照这样下去,每一小格内都比前一小格加一倍,陛下啊,把这样摆满棋盘上所有64格的麦粒,都赏给您的仆人吧!”麦粒的总数= 1 + 2 + 4 + 8 + … + 263
= 264 – 1
=1.845 × 1019这竟是全世界在2000年内所生产的全部小麦! 602 000 000 000 000 000 000 000有多大?6.02×1023粒小麦全球60亿人每人每天吃一斤,要吃 年 14万物质的量只适用于微观粒子,使用摩尔作单位时,所指粒子必须十分明确,且粒子的种类要用化学式表示。1 mol 氢 错 必须指明是 H2 或 H 或 H+2 mol CO2 正确0.3 mol OH- 正确1.5 mol e- 正确课堂练习:判断
下面叙述是否正确
(1) 每摩尔物质含有 (6.02)(1023)个微粒
(2) 摩尔是七个物理量之一
(3) 摩尔是物质的质量单位
(4) 1 摩尔氧
( 5 ) 1摩尔的大米约含有 (6.02)(1023) 个米粒
(6) 2摩尔H2O每摩尔物质含有阿伏加德 罗常数个微粒,近似值为 (6.02)(1023)
物质的量 是七个基本物理量之一 。摩尔是物质的量的单位必须指明微粒的种类,是氧原子、氧分子还是氧离子物质的量只适用于微观粒子,不能用来说明宏观物质。
正确填空 1mol C 中约含有 个C;
1mol SO42-中约含有 个SO42-;
1mol e-中约含有 个e-;
1mol O2 中约含有 个O2;2mol O2 中约含有 个O2;nmol O2 中约含有 个O2;6.02×10236.02×10236.02×10236.02×10232x6.02×1023nx6.02×1023物质的量、阿伏加德罗常数 与微粒之间的关系 物质的量(n)=物质所含微粒数目(N)阿伏加德罗常数(NA)nNX NA÷ NA = 0.5 mol ×6.02 ×1023 mol-1N(O)= 2 x n (O2) x NA例1:0、5mol 02中,含有02的分子数目是多少?含有O的数目是多少?解:O2的分子数为N = n × NA= 3.01 × 1023O的数目为= 2×0.5 mol×6.02×1 023 mol-1= 6.02 × 1023答:O2的分子数为3.01 × 1023个,0的数目为
6.02 × 1023个 例2:9、03 x 1022个H2分子的物质的量是多少?共含有多少mol e- ?解:
n(H2) = N(H2) NA=9、03 x 10226、02 x 1023 mol-1=0、15 moln(e-) = 2 x n(H2) = 2 x 0、15mol答:……= 0、30 mol 1 mol H2O中有多少 mol H,多少 mol O? H2O 11 molNA2HO212NANA1 mol2 mol 结论:微粒之间的个数之比也就是物质的量之比微粒个数微粒集团物质的量例3:1 mol Na2SO4含有 mol Na+ 2 mol SO42- 1 个氧原子 练习: 0.5 mol K2CO3含有 mol K+ 1 mol CO32- 0.5个氧原子1.5 x 6.02 x 10234 x 6.02 x 1023Na2SO4 = 2 Na+ + SO42-【思考】: 0.012kg 12C中所含的碳原子数——阿伏加德罗常数 ,含阿伏加德罗常数个粒子的粒子的物质的量是1mol。
1、1mol12C的质量是0.012kg,那么1mol其他物质的质量又是多少呢?
2、1mol任何物质都约含有6.02X1023个粒子,
那么这1mol物质的质量到底有多大?NANANANANANA1256981823173、分析以上计算结果可得出什么规律?(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。
1mol任何微粒或物质的质量是以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。摩尔质量① 单位物质的量的物质所具有的质量② 符号:M③ 单位为“g/mol”。④ 表达式:M=m/n课堂练习:1、填空:
(1)1molCu质量是 克
(2)1molO2质量是 克
(3) 1molCO2质量是 克
(4) 1molCl-质量是 克
(5) 1molNa+质量是 克
(6) 1molNaCl质量是 克64324435.52358.5课堂练习:2、(1)、O2的摩尔质量是多少?
(2)、H2SO4的摩尔质量是多少?
(3)、100molH2O的质量是多少克?
(4)、0.1molOH-的质量是多少克?(5)、24.5gH2SO4的物质的量是多少?
(6)、85.5gAl2(SO4)3中含有Al3+和SO42-的
物质的量各是多少?
课堂练习:(7)、含有1.5X1022个分子的物质,其质量
为0.7g,求该物质的相对分子质量?
(8)、122.5gKClO3中所含的Cl原子数与多少
克CaCl2中所含的Cl原子数相等?小结n物质的量(mol)N粒子数m物质质量(g)÷NA(mol-1)×NA
(mol-1)
÷M
M(g/mol)×M(g/mol)物质的量给我们的交流和解决问题带来方便了吗?讨论1:“一滴水中有多少个分子啊?”“我有办法 ?我有办法!” 讨论2约1.7万亿亿个!“这个C原子有多重啊”“我有办法 ! 我有办法!” C原子H2O分子1L H2O生物界大气地球1.993 ?10-23g讨论3
