专题2 原子结构与元素的性质 综合复习
图片预览










文档简介
课件43张PPT。一个民族要站在科学的最高峰,就一刻也不能没有理论思维
——恩格斯 原子结构 组成物质的
最小微粒是什么?德墨克里特 (Democritus 460~360 B.C,希腊哲学家)原子是组成物质的最小粒子。他认为:
每一样东西都是由最小的部分组成,而最小的部分不能再分。物体可以不断地切割直到最小部分,这一最小部分称为atomos,该词为希腊语,意思不能分割。道尔顿 (John Dalton 1766~1844
英国化学家和物理家)道尔顿模型(1803年)
原子是不可再分成更小的部分,原子就象十分微小的钢珠,是坚硬而又光滑的圆球体,不可能再分割。原子的质量是原子的最根本特征;原子间化合时,成简单的整数比。 道尔顿道尔顿原子概念的提出,
使我们的化学进入了以原子论
为主线的新的时期。 近一百年的时间人们
都认为原子都是
不可分割的。(Thomson 1856~1940 英国科学家)汤姆生模型(1904)
原子就像一个西瓜,整个西瓜分布着正电荷,而瓜籽带负电荷,整个“西瓜”——原子显示中性。有人把这个模型又称为“西瓜模型”。
汤姆生想用粒子穿进原子
探究内部结构(质量、电性)汤姆生的学生卢瑟福卢瑟福(Rutherford 1871~1937
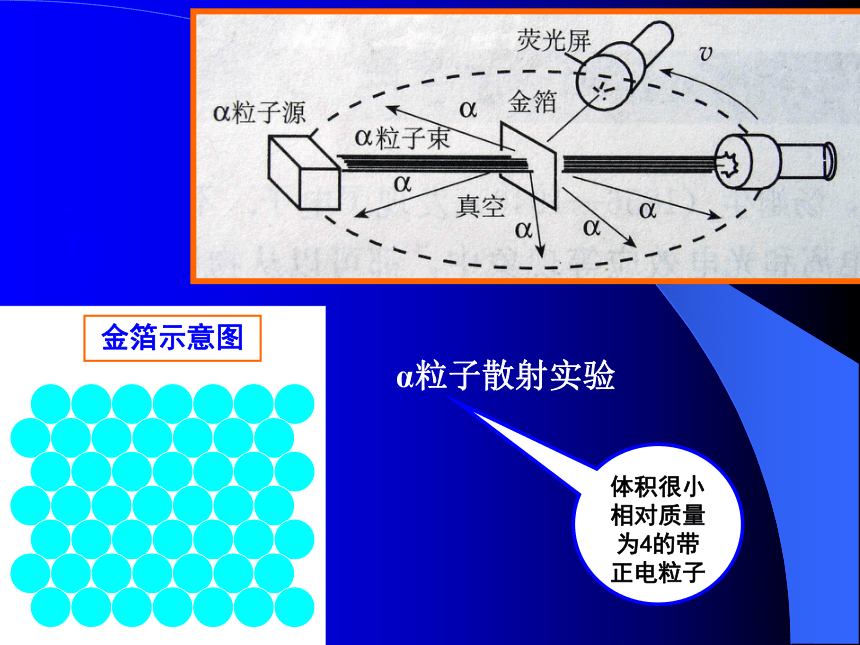
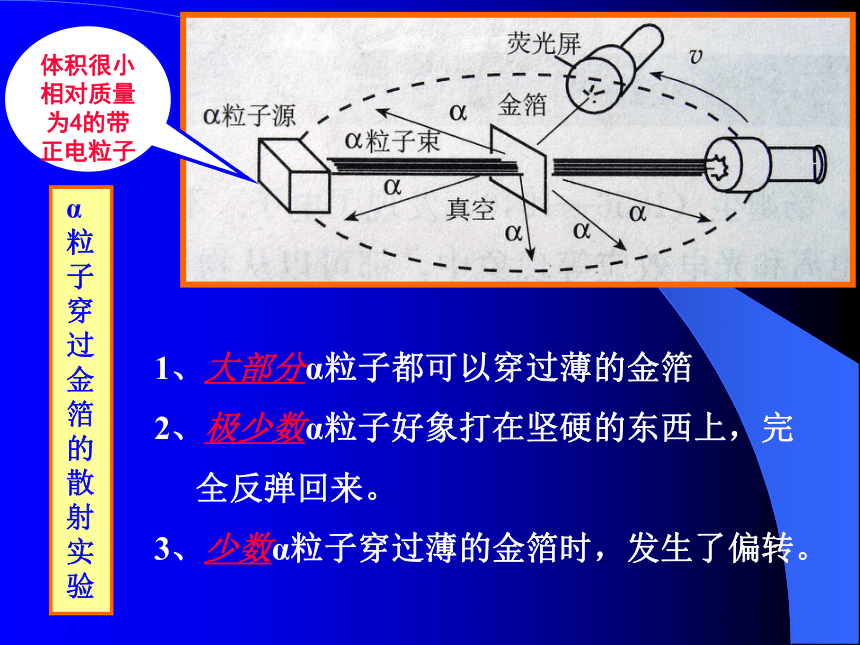
英国物理学家)α粒子穿过金箔的散射实验 金箔示意图α粒子穿过金箔的散射实验 金箔示意图体积很小相对质量为4的带正电粒子α粒子散射实验1、大部分α粒子都可以穿过薄的金箔
2、极少数α粒子好象打在坚硬的东西上,完
全反弹回来。
3、少数α粒子穿过薄的金箔时,发生了偏转。α粒子穿过金箔的散射实验体积很小相对质量为4的带正电粒子1、大部分α粒子都可以穿过薄的金
箔
2、极少数α粒子好象打在坚硬的东
西上,完 全反弹回来。
3、少数α粒子穿过薄的金箔时,发
生了偏转。α粒子穿过金箔的散射实验 金箔示意图体积很小相对质量为4的带正电粒子1、大部分α粒子都可以穿过薄的金
箔
2、极少数α粒子好象打在坚硬的东
西上,完 全反弹回来。
3、少数α粒子穿过薄的金箔时,发
生了偏转。α粒子穿过金箔的散射实验 金箔示意图体积很小相对质量为4的带正电粒子1、大部分α粒子都可以穿过薄的金
箔
2、极少数α粒子好象打在坚硬的东
西上,完 全反弹回来。
3、少数α粒子穿过薄的金箔时,发
生了偏转。α粒子穿过金箔的散射实验 金箔示意图体积很小相对质量为4的带正电粒子卢瑟福(Rutherford 1871~1937 英国物理学家)
卢瑟福通过实验推断出:
1、原子的大部分体积是空的;
2、原子核几乎集中了所有原子的质量;
3、核内有质子;
4、电子随意地围绕着一个带正电荷的很小的原子核运转;
疑问:
卢瑟福和他的学生们在实验中经常发现
原子的质量远远大于
质子和电子的质量?查得维克(Chadwick 英国物理学家)查得维克(1932年)
发现了中子,并通过
实验,得出中子和质子的
质量相同,但是它不带电。 原子结构原子原子核核外电子(-) 质子(+)中子(不带电)
电性:质子数 = 核电荷数 = 核外电子数
一个质子 1.673×10—27 千克一个中子 1.675×10—27 千克
一个电子 9.109×10—31 千克
相对质量1.0071.0081/1836质量数(A)= 质子数(Z)+ 中子数(N)电性:质量:质子数 = 核电核数 = 核外电子数 Na为何比较容易失去
一个电子?而Mg又为何比较容易失去
二个电子?卢瑟福认为:电子随意地围绕着一个带正
电荷的很小的原子核运转。电子的运动真的
没有规律吗? 使气态原子失去电子变成气态阳离子,要消耗一定的能量克服核对电子的引力,这个能量叫电离能。失去第一个电子变成气态+1阳离子时消耗的能量叫做第一电离能(I 1);从气态+1阳离子失去第二个电子变成+2阳离子时消耗的能量叫做第二电离能(I 2);依次类推。以下是镁原子的电离能数据,请你根据实验数据分析能得出什么结论。(单位MJ/mol)问题玻尔(丹麦物理学家)玻尔模型(1913年)
玻尔认为:电子不是随意占据在核的周围,而是在固定的层面上运动,当电子从一个层面跑到另一个层面时,原子变要吸收或释放能量。能量不同的电子
有不同的运动区域! 科学家经过大量的实验数据中,找出了稀有气体元素原子核外电子的排布规律。核外电子排布规律1 、电子排布总是从离核 ____ 到离核 ____ 。
即电子排布总是从能量 ___ 排到能量____ 。
2、每层电子最多不超过
3、最外层电子不超过 。
4、次外层不超过 。
5、倒数第三层不超过 。较近 较远较低 较高2n2个8个(第一层2个)18个32个电子在某区域绕核作高速运动 ,
那它的运动特征又是怎样的呢 ? 电子云(20世纪20年代以来)
电子云模型
从20世纪20年代以来,经过许多科学家的努力,建立了目前流行的电子模型,该模型证明,电子绕核运动形成一个带负电荷的云团,在一个确定的时刻不能精确测定电子的确切位置。宁波市第二中学
化学组 范彬彬 其实人们对原子结构的逐步认识过程,也是人类进步的过程,现代的科学理论,也仅仅代表人类对客观事物认识的一个阶段,而人类对客观事物的认识,今后还会不断深入发展,
当然需要我们同学的不断努力了!练习:1、描述原子的组成,并证明每种粒子的位置。
2、解释为什么原子所带电荷为零,呈电中性。3、解释为什么电子占据了原子绝大部分空间,
而它的质量可以忽略不计。4、Cl—的质量数为35,求该微粒的质子,中子和电子5、R原子质量数为a,R带n个单位负电荷时有b个电子,
求R的中子数。6、描述一下,如果你被缩小成原子般大小,你可能看到的和经历的,描绘你周围的其他原子和分子,探索你的新世界。卢瑟福(Rutherford 1871~1937 英国物理学家) 卢瑟福模型(1911年)
(小太阳系模型)
电子围绕着一个
带正电荷的很小
的原子核运转;
玻尔(丹麦物理学家)玻尔模型(1913年)
核外电子的运动是分层的,
电子在每一层中的某个区域内运
动. 使气态原子失去电子变成气态阳离子,要消耗一定的能量克服核对电子的引力,这个能量叫电离能。失去第一个电子变成气态+1阳离子时消耗的能量叫做第一电离能(I 1);从气态+1阳离子失去第二个电子变成+2阳离子时消耗的能量叫做第二电离能(I 2);依次类推。以下是几种元素原子的电离能数据,请你根据实验数据分析能得出什么结论。(单位MJ/mol)问题α粒子的散射实验:用α粒子穿过金箔
实验现象:
1、大部分α粒子都可以穿过薄的金箔
2、少数α粒子穿过薄的金箔时,发生了偏转
3、极少数α粒子好象打在坚硬的东西上,完全
反弹回来。α粒子的散射实验电子云模型(1935年)
电子绕核运动形成一个带负电荷的云团,在一个确定的时刻不能精确测定电子的确切位置,但能指出电子在某区域中出现的机会多少。填表2个8个18个32个2n2个原子可以分了!
——恩格斯 原子结构 组成物质的
最小微粒是什么?德墨克里特 (Democritus 460~360 B.C,希腊哲学家)原子是组成物质的最小粒子。他认为:
每一样东西都是由最小的部分组成,而最小的部分不能再分。物体可以不断地切割直到最小部分,这一最小部分称为atomos,该词为希腊语,意思不能分割。道尔顿 (John Dalton 1766~1844
英国化学家和物理家)道尔顿模型(1803年)
原子是不可再分成更小的部分,原子就象十分微小的钢珠,是坚硬而又光滑的圆球体,不可能再分割。原子的质量是原子的最根本特征;原子间化合时,成简单的整数比。 道尔顿道尔顿原子概念的提出,
使我们的化学进入了以原子论
为主线的新的时期。 近一百年的时间人们
都认为原子都是
不可分割的。(Thomson 1856~1940 英国科学家)汤姆生模型(1904)
原子就像一个西瓜,整个西瓜分布着正电荷,而瓜籽带负电荷,整个“西瓜”——原子显示中性。有人把这个模型又称为“西瓜模型”。
汤姆生想用粒子穿进原子
探究内部结构(质量、电性)汤姆生的学生卢瑟福卢瑟福(Rutherford 1871~1937
英国物理学家)α粒子穿过金箔的散射实验 金箔示意图α粒子穿过金箔的散射实验 金箔示意图体积很小相对质量为4的带正电粒子α粒子散射实验1、大部分α粒子都可以穿过薄的金箔
2、极少数α粒子好象打在坚硬的东西上,完
全反弹回来。
3、少数α粒子穿过薄的金箔时,发生了偏转。α粒子穿过金箔的散射实验体积很小相对质量为4的带正电粒子1、大部分α粒子都可以穿过薄的金
箔
2、极少数α粒子好象打在坚硬的东
西上,完 全反弹回来。
3、少数α粒子穿过薄的金箔时,发
生了偏转。α粒子穿过金箔的散射实验 金箔示意图体积很小相对质量为4的带正电粒子1、大部分α粒子都可以穿过薄的金
箔
2、极少数α粒子好象打在坚硬的东
西上,完 全反弹回来。
3、少数α粒子穿过薄的金箔时,发
生了偏转。α粒子穿过金箔的散射实验 金箔示意图体积很小相对质量为4的带正电粒子1、大部分α粒子都可以穿过薄的金
箔
2、极少数α粒子好象打在坚硬的东
西上,完 全反弹回来。
3、少数α粒子穿过薄的金箔时,发
生了偏转。α粒子穿过金箔的散射实验 金箔示意图体积很小相对质量为4的带正电粒子卢瑟福(Rutherford 1871~1937 英国物理学家)
卢瑟福通过实验推断出:
1、原子的大部分体积是空的;
2、原子核几乎集中了所有原子的质量;
3、核内有质子;
4、电子随意地围绕着一个带正电荷的很小的原子核运转;
疑问:
卢瑟福和他的学生们在实验中经常发现
原子的质量远远大于
质子和电子的质量?查得维克(Chadwick 英国物理学家)查得维克(1932年)
发现了中子,并通过
实验,得出中子和质子的
质量相同,但是它不带电。 原子结构原子原子核核外电子(-) 质子(+)中子(不带电)
电性:质子数 = 核电荷数 = 核外电子数
一个质子 1.673×10—27 千克一个中子 1.675×10—27 千克
一个电子 9.109×10—31 千克
相对质量1.0071.0081/1836质量数(A)= 质子数(Z)+ 中子数(N)电性:质量:质子数 = 核电核数 = 核外电子数 Na为何比较容易失去
一个电子?而Mg又为何比较容易失去
二个电子?卢瑟福认为:电子随意地围绕着一个带正
电荷的很小的原子核运转。电子的运动真的
没有规律吗? 使气态原子失去电子变成气态阳离子,要消耗一定的能量克服核对电子的引力,这个能量叫电离能。失去第一个电子变成气态+1阳离子时消耗的能量叫做第一电离能(I 1);从气态+1阳离子失去第二个电子变成+2阳离子时消耗的能量叫做第二电离能(I 2);依次类推。以下是镁原子的电离能数据,请你根据实验数据分析能得出什么结论。(单位MJ/mol)问题玻尔(丹麦物理学家)玻尔模型(1913年)
玻尔认为:电子不是随意占据在核的周围,而是在固定的层面上运动,当电子从一个层面跑到另一个层面时,原子变要吸收或释放能量。能量不同的电子
有不同的运动区域! 科学家经过大量的实验数据中,找出了稀有气体元素原子核外电子的排布规律。核外电子排布规律1 、电子排布总是从离核 ____ 到离核 ____ 。
即电子排布总是从能量 ___ 排到能量____ 。
2、每层电子最多不超过
3、最外层电子不超过 。
4、次外层不超过 。
5、倒数第三层不超过 。较近 较远较低 较高2n2个8个(第一层2个)18个32个电子在某区域绕核作高速运动 ,
那它的运动特征又是怎样的呢 ? 电子云(20世纪20年代以来)
电子云模型
从20世纪20年代以来,经过许多科学家的努力,建立了目前流行的电子模型,该模型证明,电子绕核运动形成一个带负电荷的云团,在一个确定的时刻不能精确测定电子的确切位置。宁波市第二中学
化学组 范彬彬 其实人们对原子结构的逐步认识过程,也是人类进步的过程,现代的科学理论,也仅仅代表人类对客观事物认识的一个阶段,而人类对客观事物的认识,今后还会不断深入发展,
当然需要我们同学的不断努力了!练习:1、描述原子的组成,并证明每种粒子的位置。
2、解释为什么原子所带电荷为零,呈电中性。3、解释为什么电子占据了原子绝大部分空间,
而它的质量可以忽略不计。4、Cl—的质量数为35,求该微粒的质子,中子和电子5、R原子质量数为a,R带n个单位负电荷时有b个电子,
求R的中子数。6、描述一下,如果你被缩小成原子般大小,你可能看到的和经历的,描绘你周围的其他原子和分子,探索你的新世界。卢瑟福(Rutherford 1871~1937 英国物理学家) 卢瑟福模型(1911年)
(小太阳系模型)
电子围绕着一个
带正电荷的很小
的原子核运转;
玻尔(丹麦物理学家)玻尔模型(1913年)
核外电子的运动是分层的,
电子在每一层中的某个区域内运
动. 使气态原子失去电子变成气态阳离子,要消耗一定的能量克服核对电子的引力,这个能量叫电离能。失去第一个电子变成气态+1阳离子时消耗的能量叫做第一电离能(I 1);从气态+1阳离子失去第二个电子变成+2阳离子时消耗的能量叫做第二电离能(I 2);依次类推。以下是几种元素原子的电离能数据,请你根据实验数据分析能得出什么结论。(单位MJ/mol)问题α粒子的散射实验:用α粒子穿过金箔
实验现象:
1、大部分α粒子都可以穿过薄的金箔
2、少数α粒子穿过薄的金箔时,发生了偏转
3、极少数α粒子好象打在坚硬的东西上,完全
反弹回来。α粒子的散射实验电子云模型(1935年)
电子绕核运动形成一个带负电荷的云团,在一个确定的时刻不能精确测定电子的确切位置,但能指出电子在某区域中出现的机会多少。填表2个8个18个32个2n2个原子可以分了!
