原电池的工作原理
图片预览







文档简介
课件22张PPT。原电池的工作原理泰安五中 钱 永生活中我们常使用各种各样的电池用于“神七”的太阳能电池笔记本电脑专用电池手机专用电池教学目标 知识与技能:
1.理解原电池的工作原理,能判断原电池的正负极,能写出电极反应式。
2.通过实验与分析,初步掌握形成原电池的基本条件。
过程与方法:
1.学习通过实验手段进行科学探究的一般方法,能设计并完成一些基本的化学实验。
2.学会运用观察、实验等多种手段获取信息,运用比较分析等方法对信息进行加工。
情感态度与价值观:
1.在学习过程中体验并享受探究带来的快乐,感受化学世界的奇妙。
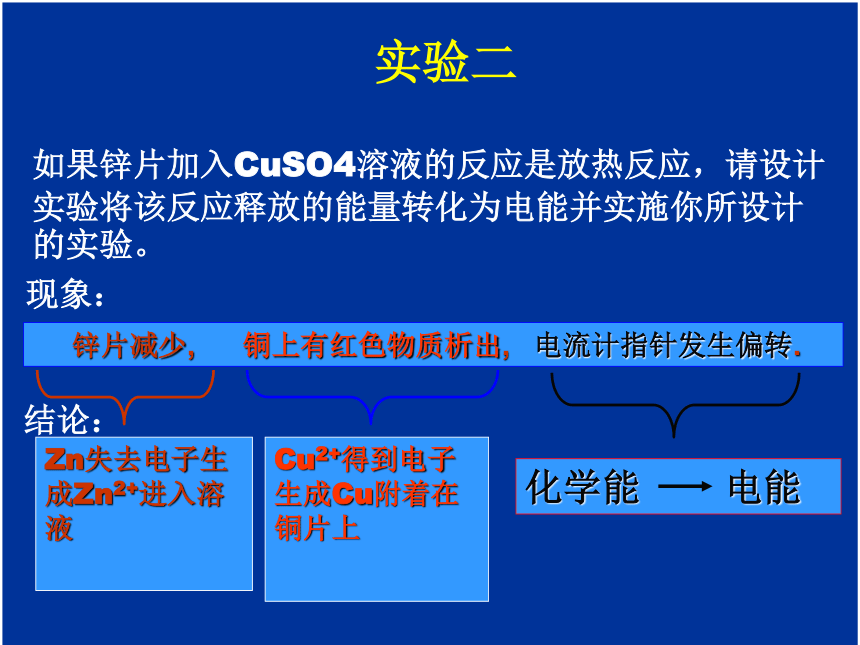
2.通过本节内容的学习,使学生进一步从能量的角度理解化学科学对人类生活的重要贡献,增强学习化学的信心。重点难点 本节教材的重点是原电池的工作原理,写出简单的电极反应和电池反应;难点是双液原电池的工作原理。 将锌粉加入CuSO4溶液中,测量溶液温度的变化,分析能量变化的情况。记录实验1的现象和结论。现象:锌粉溶解,有红色物质析出,温度计显示温度迅速上升.结论(反应的实质):Zn+ Cu2+ = Zn2+ + Cu实验一实验二如果锌片加入CuSO4溶液的反应是放热反应,请设计实验将该反应释放的能量转化为电能并实施你所设计的实验。
现象:结论: 锌片减少, 铜上有红色物质析出, 电流计指针发生偏转.Zn失去电子生成Zn2+进入溶液
Cu2+得到电子生成Cu附着在铜片上
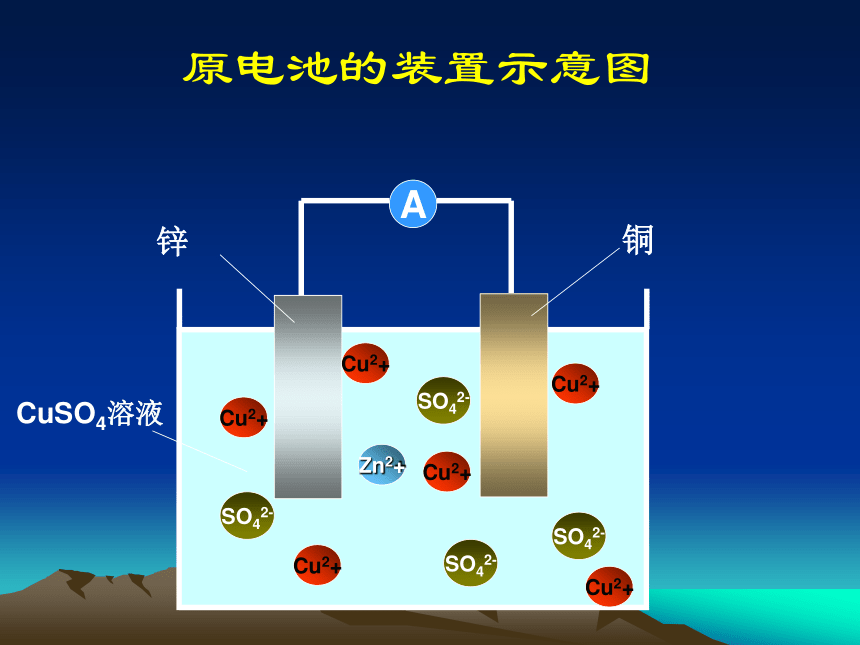
原电池的装置示意图A锌铜SO42-Cu2+SO42-Cu2+Cu2+Zn2+Cu2+Cu2+SO42-CuSO4溶液Cu2+SO42-原电池的定义 电化学上将能把化学能转化为电能的装置叫做原电池 实验三 给你一节干电池,设计实验证明铜锌原电池的正负极。 测干电池时,电流计指针偏向正极方向,测铜锌原电池时,电流计指针偏向铜片方向。现象结论锌片为负极,铜片为正极。 原电池的工作原理示意图A锌e-e-—铜SO42-Cu2+SO42-Cu2+Cu2+Zn2+Cu2+Cu2+SO42-CuSO4溶液Cu2+SO42-e-e-e-e-+阴极阳极 在外电路中电子由负极向正极定向移动。
在内电路中阴阳离子分别向阳极和阴极定向移动,形成闭合回路,从而使两个电极反应不断进行,发生有序的电子转移,产生电流。(1)电极反应式: 负极(Zn):(氧化反应) 正极(Cu):(还原反应) Zn→Zn2++2e- Cu2++2e-→Cu (正极、负极得失电子数目相等) (2)电池反应: 原电池的两个电极反应组成电池的总反应, 这个总反应叫做原电池的电池反应。电池反应式: Zn+Cu2+==Zn2++Cu (离子反应方程式) Zn+CuSO4==ZnSO4+Cu (化学方程式) ( 3)电子流向: 由负极流出,经导线,流入正极电流方向:由正极流出,经导线,流入负极 (4)电解质溶液中: 阳离子:阴离子: 向阴极定向移动 向阳极极定向移动 (5)能量转换: 化学能→电能分析思考一 结合教材第20页,插图1-3-3,思考原电池的电池反应与锌片直接跟硫酸铜溶液的反应有何异同?相同点:反应方程式相同,即本
质相同。 不同点:电子转移途径不同。
锌片直接跟硫酸铜溶液的反应:氧化反应和还原反应是同时同位置进行,电子直接转移给氧化剂。
原电池:氧化反应和还原反应是同时但在不同位置进行(正极发生还原反应,负极发生氧化反应),电子经导线由还原剂(锌)转移给氧化剂(铜离子)。电极反应式:负极(—):Mg+2OH- 2e-+Mg(OH)2
正极( + ): 2H2O+2e- H2 ↑+2 OH-分析思考二1、如果用比锌活泼的金属镁代替铜片,用ZnSO4溶液代替CuSO4溶液与锌组成原电池,如何判断正负极?锌片上将发生什么电极反应?
2、原电池中电极反应的反应物一定来源于电极材料和电解质溶液吗?负极上是电极材料失电子而发生电极反 应;正极上是电解质溶液中氧化性最强的阳离子得电子而发生电极反应。常见阳离子的放电顺序 : Ag+>Hg2+>Fe3+>Cu2+>
H+>Pb2+>Sn2+>Fe2+>Zn2+实验四 请同学们按照图示,组成装置,据实验现象判断哪些装置能构成原电池?(x)(x)(x)(∨)(∨)(1)(2)(3)(4)(5)构成原电池的条件 (1)有两种活动性不同的金属(或一种是非金 属导体)作电极(活泼金属做负极)
(2)电极材料均插入电解质溶液中
(3)两极相连形成闭合回路注意:负极材料和电解质溶液之间必须能发生自发的氧化还原反应分析思考三 此装置能否构成原电池?如能请写出电极反应式和电池反应式。负极:Cu →Cu2+ + 2e-
正极:2H+ + 2e- → H2↑电池反应:Cu + H2SO4=CuSO4 + H2 ↑(x)(x)分析思考四下列装置能否实现化学能向电能的转化?如果不行,将如何改进使其形成原电池?
改进的装置
盐桥:在U形管中装满用饱和KCl溶液和琼胶作成的冻胶。
盐桥的作用:使Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极,使电流持续传导。负极:Zn-2e-→Zn2+ (氧化反应)正极:Cu2++2e-→Cu(还原反应)电池反应:Zn+ Cu2+ = Zn2+ + Cu
此原电池的氧化反应和还原反应分别在两个电极上进行,与前面讲的铜锌原电池在本质上是完全相同的。特点:①锌片不与硫酸铜溶液直接接触,反应后溶液的温度不变,没有能量损失。
②电流强度大,电流持续稳定。
③化学能转化为电能的效率高ZnSO4CuSO4巩固应用1、如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化) ( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高, B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
D2、判断下列两个装置,哪个构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式和总反应式。巩固应用(1)(2) 负极(Fe):Fe-2e- →Fe
正极(C):2H++2e-→H2↑
电池反应:Fe+2H+= Fe2++H2↑
×∨课堂总结 原电池的工作原理及构成条件
原电池与电解池的区别与联系谢 谢
1.理解原电池的工作原理,能判断原电池的正负极,能写出电极反应式。
2.通过实验与分析,初步掌握形成原电池的基本条件。
过程与方法:
1.学习通过实验手段进行科学探究的一般方法,能设计并完成一些基本的化学实验。
2.学会运用观察、实验等多种手段获取信息,运用比较分析等方法对信息进行加工。
情感态度与价值观:
1.在学习过程中体验并享受探究带来的快乐,感受化学世界的奇妙。
2.通过本节内容的学习,使学生进一步从能量的角度理解化学科学对人类生活的重要贡献,增强学习化学的信心。重点难点 本节教材的重点是原电池的工作原理,写出简单的电极反应和电池反应;难点是双液原电池的工作原理。 将锌粉加入CuSO4溶液中,测量溶液温度的变化,分析能量变化的情况。记录实验1的现象和结论。现象:锌粉溶解,有红色物质析出,温度计显示温度迅速上升.结论(反应的实质):Zn+ Cu2+ = Zn2+ + Cu实验一实验二如果锌片加入CuSO4溶液的反应是放热反应,请设计实验将该反应释放的能量转化为电能并实施你所设计的实验。
现象:结论: 锌片减少, 铜上有红色物质析出, 电流计指针发生偏转.Zn失去电子生成Zn2+进入溶液
Cu2+得到电子生成Cu附着在铜片上
原电池的装置示意图A锌铜SO42-Cu2+SO42-Cu2+Cu2+Zn2+Cu2+Cu2+SO42-CuSO4溶液Cu2+SO42-原电池的定义 电化学上将能把化学能转化为电能的装置叫做原电池 实验三 给你一节干电池,设计实验证明铜锌原电池的正负极。 测干电池时,电流计指针偏向正极方向,测铜锌原电池时,电流计指针偏向铜片方向。现象结论锌片为负极,铜片为正极。 原电池的工作原理示意图A锌e-e-—铜SO42-Cu2+SO42-Cu2+Cu2+Zn2+Cu2+Cu2+SO42-CuSO4溶液Cu2+SO42-e-e-e-e-+阴极阳极 在外电路中电子由负极向正极定向移动。
在内电路中阴阳离子分别向阳极和阴极定向移动,形成闭合回路,从而使两个电极反应不断进行,发生有序的电子转移,产生电流。(1)电极反应式: 负极(Zn):(氧化反应) 正极(Cu):(还原反应) Zn→Zn2++2e- Cu2++2e-→Cu (正极、负极得失电子数目相等) (2)电池反应: 原电池的两个电极反应组成电池的总反应, 这个总反应叫做原电池的电池反应。电池反应式: Zn+Cu2+==Zn2++Cu (离子反应方程式) Zn+CuSO4==ZnSO4+Cu (化学方程式) ( 3)电子流向: 由负极流出,经导线,流入正极电流方向:由正极流出,经导线,流入负极 (4)电解质溶液中: 阳离子:阴离子: 向阴极定向移动 向阳极极定向移动 (5)能量转换: 化学能→电能分析思考一 结合教材第20页,插图1-3-3,思考原电池的电池反应与锌片直接跟硫酸铜溶液的反应有何异同?相同点:反应方程式相同,即本
质相同。 不同点:电子转移途径不同。
锌片直接跟硫酸铜溶液的反应:氧化反应和还原反应是同时同位置进行,电子直接转移给氧化剂。
原电池:氧化反应和还原反应是同时但在不同位置进行(正极发生还原反应,负极发生氧化反应),电子经导线由还原剂(锌)转移给氧化剂(铜离子)。电极反应式:负极(—):Mg+2OH- 2e-+Mg(OH)2
正极( + ): 2H2O+2e- H2 ↑+2 OH-分析思考二1、如果用比锌活泼的金属镁代替铜片,用ZnSO4溶液代替CuSO4溶液与锌组成原电池,如何判断正负极?锌片上将发生什么电极反应?
2、原电池中电极反应的反应物一定来源于电极材料和电解质溶液吗?负极上是电极材料失电子而发生电极反 应;正极上是电解质溶液中氧化性最强的阳离子得电子而发生电极反应。常见阳离子的放电顺序 : Ag+>Hg2+>Fe3+>Cu2+>
H+>Pb2+>Sn2+>Fe2+>Zn2+实验四 请同学们按照图示,组成装置,据实验现象判断哪些装置能构成原电池?(x)(x)(x)(∨)(∨)(1)(2)(3)(4)(5)构成原电池的条件 (1)有两种活动性不同的金属(或一种是非金 属导体)作电极(活泼金属做负极)
(2)电极材料均插入电解质溶液中
(3)两极相连形成闭合回路注意:负极材料和电解质溶液之间必须能发生自发的氧化还原反应分析思考三 此装置能否构成原电池?如能请写出电极反应式和电池反应式。负极:Cu →Cu2+ + 2e-
正极:2H+ + 2e- → H2↑电池反应:Cu + H2SO4=CuSO4 + H2 ↑(x)(x)分析思考四下列装置能否实现化学能向电能的转化?如果不行,将如何改进使其形成原电池?
改进的装置
盐桥:在U形管中装满用饱和KCl溶液和琼胶作成的冻胶。
盐桥的作用:使Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极,使电流持续传导。负极:Zn-2e-→Zn2+ (氧化反应)正极:Cu2++2e-→Cu(还原反应)电池反应:Zn+ Cu2+ = Zn2+ + Cu
此原电池的氧化反应和还原反应分别在两个电极上进行,与前面讲的铜锌原电池在本质上是完全相同的。特点:①锌片不与硫酸铜溶液直接接触,反应后溶液的温度不变,没有能量损失。
②电流强度大,电流持续稳定。
③化学能转化为电能的效率高ZnSO4CuSO4巩固应用1、如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化) ( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高, B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
D2、判断下列两个装置,哪个构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式和总反应式。巩固应用(1)(2) 负极(Fe):Fe-2e- →Fe
正极(C):2H++2e-→H2↑
电池反应:Fe+2H+= Fe2++H2↑
×∨课堂总结 原电池的工作原理及构成条件
原电池与电解池的区别与联系谢 谢
