化学:5.3《硫酸》教案(第2课时)(沪科版)
文档属性
| 名称 | 化学:5.3《硫酸》教案(第2课时)(沪科版) |

|
|
| 格式 | rar | ||
| 文件大小 | 50.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-09-24 12:08:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
5.3 硫酸(共三课时)
第2课时 浓硫酸的强氧化性
[设计思想]
对于酸的通性、浓硫酸的部分特性(吸水性和脱水性),在本节第一课时里进行了较为系统的学习和巩固。作为浓硫酸的强氧化性,即浓硫酸的最主要的特性,学生从本节课开始接触。使学生掌握浓硫酸的强氧化性,不但使学生全面掌握硫酸的性质,而且为今后学习硝酸等强氧化性酸的性质打好基础。所以,浓硫酸的强氧化性是本节的重点。
强调浓硫酸的强氧化性,并不是说一般酸没有氧化性,这一点往往是学生在学习中容易混淆的地方。为了突破这个难点,通过稀硫酸和浓硫酸的对比及浓硫酸与铜的实验探究,分析浓硫酸与铜反应的本质,从而揭示浓硫酸强氧化性的核心所在。因此,做好浓硫酸与铜的演示实验实验,引导学生仔细观察实验,分析实验现象成为该课的关键之一。
一.教学目标
1.知识与技能
浓硫酸的强氧化性(B)。
2.过程与方法
通过浓硫酸的性质实验,经历观察、思考、发现问题、实验探究解决问题的过程,认识用实验进行探究的方法。
3.情感态度与价值观
通过铜与硫酸实验的探究,体验创新的同时,加强学生的环保意识和安全意识。
二.教学重点和难点
浓硫酸的强氧化性。
三.教学用品
浓硫酸、铜片、铝片、品红溶液、浸有碱液的棉花、玻璃棒、试管、铁架台、铁夹、导管、酒精灯、火柴、多媒体。
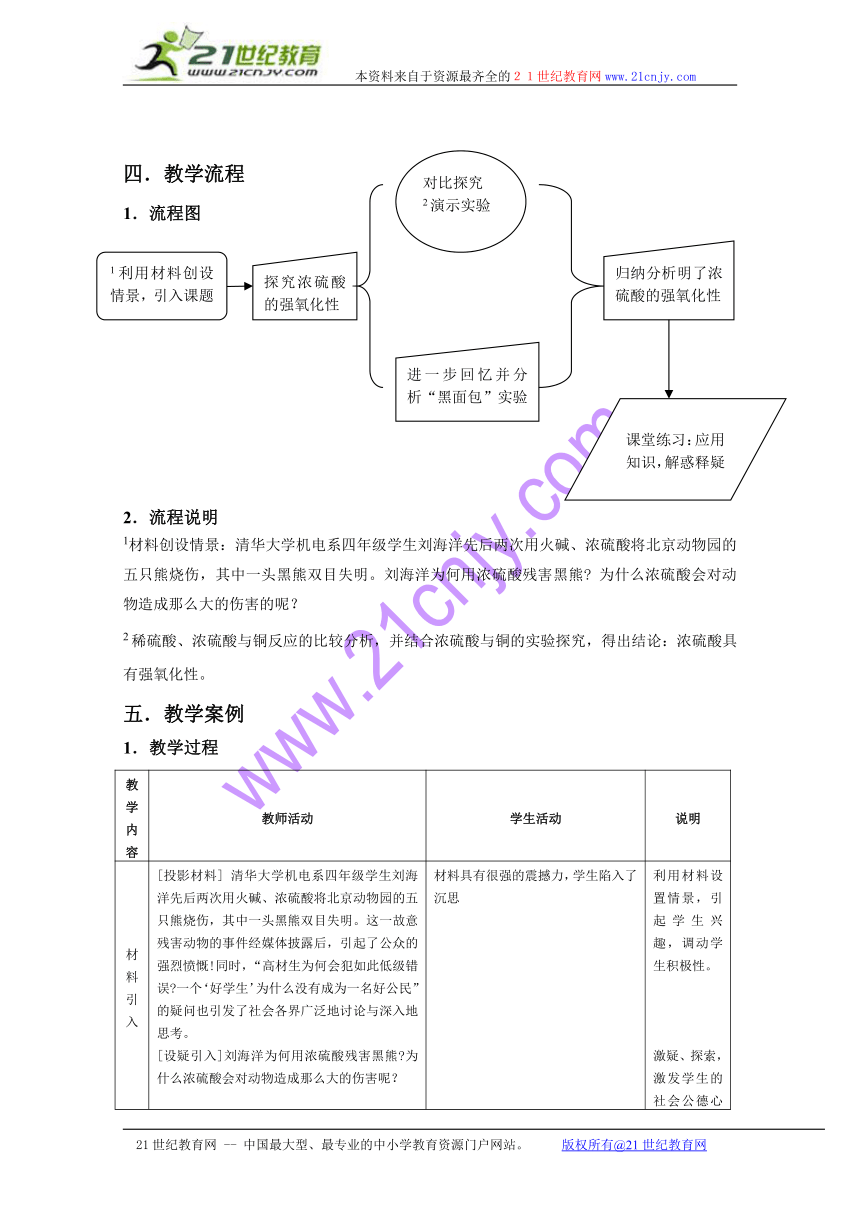
四.教学流程
1.流程图
2.流程说明
1材料创设情景:清华大学机电系四年级学生刘海洋先后两次用火碱、浓硫酸将北京动物园的五只熊烧伤,其中一头黑熊双目失明。刘海洋为何用浓硫酸残害黑熊 为什么浓硫酸会对动物造成那么大的伤害的呢?
2稀硫酸、浓硫酸与铜反应的比较分析,并结合浓硫酸与铜的实验探究,得出结论:浓硫酸具有强氧化性。
五.教学案例
1.教学过程
教学内容 教师活动 学生活动 说明
材料引入 [投影材料] 清华大学机电系四年级学生刘海洋先后两次用火碱、浓硫酸将北京动物园的五只熊烧伤,其中一头黑熊双目失明。这一故意残害动物的事件经媒体披露后,引起了公众的强烈愤慨!同时,“高材生为何会犯如此低级错误 一个‘好学生’为什么没有成为一名好公民”的疑问也引发了社会各界广泛地讨论与深入地思考。[设疑引入]刘海洋为何用浓硫酸残害黑熊 为什么浓硫酸会对动物造成那么大的伤害呢? 材料具有很强的震撼力,学生陷入了沉思 利用材料设置情景,引起学生兴趣,调动学生积极性。激疑、探索,激发学生的社会公德心和社会责任感。
引出浓硫酸的强氧化性 [过渡]稀硫酸具有酸的通性,能与活泼金属反应生成氢气。浓硫酸是否也能与金属反应呢?是否也生成氢气呢?(启发学生从浓、稀硫酸的成分及其与金属的反应分析。)[提问]铜能与稀硫酸反应吗?为什么?[设问]铜能与浓硫酸反应吗? 推理并回答:不能。因为在金属活动顺序中铜排在氢的后面。讨论,迷惑不解。讨论并回顾浓硫酸的吸水性、脱水性。引出浓硫酸的强氧化性。 激发好奇心。
铜与浓硫酸的实验与讨论 [演示实验]浓硫酸与铜反应,要求学生注意反应现象。[强调]生成的气体使品红溶液褪色后,应用碱液吸收尾气。[讲解]实验中的灰黑色物质是副产物CuS等,原因较为复杂,因为时间的关系,这个问题留到课外再进行细致的探究。[展示]浓硫酸与铜反应后的溶液长时间冷却后的现象,观察。[引导讨论] 1、铜片与浓硫酸反应的条件是什么?2、根据反应现象你认为反应后的生成物是什么?写出反应方程式。并指出氧化剂、还原剂。反应中的浓硫酸表现出什么性质?[设问]浓硫酸是否也能氧化金属活动性顺序中氢以前的金属呢?[演示实验]把铝片放入盛有浓硫酸的试管中,观察现象。加热观察。[设问]为什么浓硫酸能与铜反应,而活泼的铝放入其中无明显现象呢?[讲解]对。若加热就会发生反应。但是没加热就真的没发生反应吗?不是的,这是因为浓硫酸具有强氧化性,它可以使某些金属如铁、铝等表面发生“钝化”。解释“钝化”现象。[展示图片]运输浓硫酸的槽车图片。[板书]浓硫酸与金属活动顺序氢以前的金属反应是否也生成氢气呢?为什么? 观察、描述现象:不加热时无明显现象。加热时产生的气体能使品红溶液褪色。溶液底部有灰黑色固体析出。冷却稀释后溶液呈蓝色。学生回答:有白色晶体析出。分析思考并回答:1、加热能反应。2、能使品红溶液褪色,加热溶液又呈红色说明生成了二氧化硫;溶液稀释后呈蓝色说明有铜离子生成。且长时间冷却后有白色晶体析出 证明生成的产物是硫酸铜。化学方程式:铜是还原剂,浓硫酸是氧化剂,浓硫酸既表现出氧化性又体现出了酸性。推理并回答:不能。因为浓硫酸的强氧化性表现在+6价的硫上。 培养实验观察能力。培养逻辑思维能力。激发求知欲。解惑,加深对浓硫酸的强氧化性的认识。
浓硫酸强氧化性的分析与小结 [小结、板书] 3、强氧化性[板书](1)氧化大多数金属单质(除Pt、Au不反应)KCa…Pb(H) … Cu Hg Ag。常温:反应 不反应(除Fe、Al钝化) 加热:反应 反应(不放出H2) (放出SO2)[回忆设疑、过渡]在“黑面包”实验中,为什么体积会膨胀,形成疏松多孔的海绵状炭,如同一个“黑面包”,这又体现浓硫酸的什么性质呢?请根据现象分析生成物是什么?写出反应方程式。[板书](2)氧化某些非金属单质(C、S)[组织讨论]通过刚才的学习我们了解浓硫酸具有强的氧化性,请分析为什么浓硫酸作干燥剂时不能干燥H2S、HI、HBr气体? 讨论、释疑:蔗糖加入浓硫酸炭化时,在蔗糖内加了几滴水,浓硫酸吸水放出大量的热,使浓硫酸与生成的碳发生氧化还原反应,有大量气体产生,生成的刺激性气味的气体是浓硫酸被还原所生成的二氧化硫,碳又被浓硫酸氧化成二氧化碳,因此会出现体积膨胀,疏松多孔海绵状炭及刺激性气味产生的现象。这体现了浓硫酸的氧化性。讨论得出因为浓硫酸的强氧化性。 培养推理、综合运用知识的能力。回忆前面的实验现象,激发学生继续探索。培养分析解决问题的能力。前后呼应,加深对浓硫酸的强氧化性的认识。学会辩证的认识问题。
本节内容的小结 [本节小结]这节课我们重点探究的是浓硫酸的化学特性。因为量变导致质变,所以浓硫酸体现以下与稀硫酸不同的特性:吸水性、脱水性、强氧化性。 师生小结:稀硫酸——可与活泼金属反应,生成H2;浓硫酸——强氧化性——加热时可与绝大多数金属和某些非金属反应,通常生成SO2——氧化性由S体现。 进一步理解量变引起质变的规律,树立辩证唯物主义的世界观。培养归纳总结能力。
课堂练习,巩固新知 [课堂练习]1、请说出下列现象中硫酸表现出来的性质:(1)敞口放置浓硫酸,溶液质量增加。(2)锌粒放入稀硫酸时,有气体放出。(3)铜片放入热的浓硫酸中,有气体放出。(4)把浓硫酸滴在滤纸上,滤纸往往发焦变黑。2、写出金属铁与稀硫酸反应的化学方程式,指出氧化剂和还原剂。铁和浓硫酸在加热时反应,生成硫酸铁、二氧化硫和水,写出化学方程式,并指出氧化剂和还原剂。[作业]P22页第6题。 学生讨论,得出结论。 巩固所学知识,培养运用所学知识解决问题的能力。
2.板书记录
一、纯硫酸的物理性质:
二、浓硫酸的特性:
1、 吸水性
2、脱水性
3、强氧化性
(1)氧化大多数金属反应(除Pt、Au不反应)
K Ca ……Pb(H) Cu Hg Ag。
常温:反应(除Fe、Al钝化)。 不反应。
加热:反应,不放出H2。 反应,放出SO2。
(2)氧化某些非金属单质(C、S)
3.相关链接
浓硫酸与铜反应的实验改进
①实验用品: 带支管的试管一只(2×18厘米),一段长约10厘米、内径2厘米玻璃管,一个不漏气的塑料袋,铁架台,酒精灯,一段长20厘米的粗铜丝(或铁丝)一个3号胶塞,一个4号胶塞,一段长4厘米的铁丝.浓硫酸,细铜丝一束(约5厘米长),品红试纸一片(1.5×1厘米)
②装置(见下图):1、铁架台 2、铁夹 3、酒精灯 4、浓硫酸溶液 5、细铜丝 6、具支试管 7、胶塞 8、粗钢丝 9、带一段铁丝的胶塞 10、品红试纸 11、玻璃管 12、塑料袋
③仪器制作
带粗铜丝胶塞的制作:取适合具支试管的4号胶塞一个,用一端较尖的粗铜丝(长约20厘米)穿透胶塞,粗铜丝在胶塞上能够上下活动即可,然后在铜丝伸入试管内的一端束上一束长约5厘米的细铜丝。
带塑料袋的玻璃管的制作:取一支试管(2 ×18厘米)截取10厘米,截取断口束上一个塑料袋(塑料袋在束的过程中不要扎破)
支管上胶塞的制作:取一只3号塞,按支管口径在中心打好孔,然后在胶塞的小头插入一根长约4厘米的铁丝,然后在距胶塞1.5厘米处弯成90°,再把末端弯一小钩以便用来挂品红试纸。
④实验方法:
首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
向试管中加入约10毫升的浓硫酸,加热,(在加热浓硫酸时,把粗铜丝向上提,细铜丝先不要伸入浓硫酸中),当加热至沸腾时,把粗铜丝向下按,使细铜丝完全浸入浓硫酸中,反应即刻发生。
⑤实验现象
当细铜丝接触浓硫酸时,有大量的白雾状气体放出(白雾状气体是由于二氧化硫气体与水结合形成亚硫酸小液滴缘故)并沿支管口喷在品红试纸上,使品红试纸的红色开始褪色,而且原来无色硫酸溶液开始变绿(变绿的原因是因为浓硫酸中含水少,如果把此溶液稀释后变蓝),当品红试纸完全褪成白色后,把粗铜丝向上提使细铜丝离开浓硫酸溶液,反应马上停止(这样做的原因,可保证细铜丝能够重复实验用)。
六.教学反思
本节通过设疑引入、演示实验、引导启发、知识对比、归纳总结生等方法的综合运用,较大程度的激发学生的学习积极性,从而促进教学目标的实现。对于本课时重难点的处理,主要采取以下做法:
1.用演示实验法和引导启发相结合,突出重点
新课的中心内容是浓硫酸的强氧化性,而强氧化性主要是通过浓硫酸与铜的演示实验及结果分析得出的,因此,做好这个实验,引导学生仔细观察实验,分析实验现象成为该课的关键之一。为了证明实验中产生的是二氧化硫,而不是氢气,用润湿的品红溶液,学生从品红试纸的褪色现象,很快推出正确结果,由此说明浓硫酸跟金属的反应是较复杂的氧化还原反应。再观察稀释后试管里溶液的颜色,便可推知反应还生成了硫酸铜,这样就可以让学生自己写出这个反应的化学方程式。
2.用新旧知识对比突破难点
为了突破浓硫酸与铜反应的本质这个难点,将浓硫酸与铜反应和稀硫酸与金属反应进行对比分析,从电子得失的角度剖析酸的通性和强氧化性的本质区别,从中得出以下结论,稀硫酸的氧化性实质是氢离子的氧化性,而氢离子的氧化性就是酸的通性之一,但浓硫酸的强氧化性是+6价的硫在特定条件下的氧化性。然后,顺理成章导出浓硫酸的强氧化性的其他表现,这样既突破难点,又调动了学生思维,提高了学生的思维能力。
21世纪教育网
www.
w.w.w.k.s.5.u.c.o.m
www.
1利用材料创设情景,引入课题
探究浓硫酸的强氧化性
对比探究
2演示实验
进一步回忆并分析“黑面包”实验
归纳分析明了浓硫酸的强氧化性
课堂练习:应用知识,解惑释疑
展示样品1探究归纳
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
5.3 硫酸(共三课时)
第2课时 浓硫酸的强氧化性
[设计思想]
对于酸的通性、浓硫酸的部分特性(吸水性和脱水性),在本节第一课时里进行了较为系统的学习和巩固。作为浓硫酸的强氧化性,即浓硫酸的最主要的特性,学生从本节课开始接触。使学生掌握浓硫酸的强氧化性,不但使学生全面掌握硫酸的性质,而且为今后学习硝酸等强氧化性酸的性质打好基础。所以,浓硫酸的强氧化性是本节的重点。
强调浓硫酸的强氧化性,并不是说一般酸没有氧化性,这一点往往是学生在学习中容易混淆的地方。为了突破这个难点,通过稀硫酸和浓硫酸的对比及浓硫酸与铜的实验探究,分析浓硫酸与铜反应的本质,从而揭示浓硫酸强氧化性的核心所在。因此,做好浓硫酸与铜的演示实验实验,引导学生仔细观察实验,分析实验现象成为该课的关键之一。
一.教学目标
1.知识与技能
浓硫酸的强氧化性(B)。
2.过程与方法
通过浓硫酸的性质实验,经历观察、思考、发现问题、实验探究解决问题的过程,认识用实验进行探究的方法。
3.情感态度与价值观
通过铜与硫酸实验的探究,体验创新的同时,加强学生的环保意识和安全意识。
二.教学重点和难点
浓硫酸的强氧化性。
三.教学用品
浓硫酸、铜片、铝片、品红溶液、浸有碱液的棉花、玻璃棒、试管、铁架台、铁夹、导管、酒精灯、火柴、多媒体。
四.教学流程
1.流程图
2.流程说明
1材料创设情景:清华大学机电系四年级学生刘海洋先后两次用火碱、浓硫酸将北京动物园的五只熊烧伤,其中一头黑熊双目失明。刘海洋为何用浓硫酸残害黑熊 为什么浓硫酸会对动物造成那么大的伤害的呢?
2稀硫酸、浓硫酸与铜反应的比较分析,并结合浓硫酸与铜的实验探究,得出结论:浓硫酸具有强氧化性。
五.教学案例
1.教学过程
教学内容 教师活动 学生活动 说明
材料引入 [投影材料] 清华大学机电系四年级学生刘海洋先后两次用火碱、浓硫酸将北京动物园的五只熊烧伤,其中一头黑熊双目失明。这一故意残害动物的事件经媒体披露后,引起了公众的强烈愤慨!同时,“高材生为何会犯如此低级错误 一个‘好学生’为什么没有成为一名好公民”的疑问也引发了社会各界广泛地讨论与深入地思考。[设疑引入]刘海洋为何用浓硫酸残害黑熊 为什么浓硫酸会对动物造成那么大的伤害呢? 材料具有很强的震撼力,学生陷入了沉思 利用材料设置情景,引起学生兴趣,调动学生积极性。激疑、探索,激发学生的社会公德心和社会责任感。
引出浓硫酸的强氧化性 [过渡]稀硫酸具有酸的通性,能与活泼金属反应生成氢气。浓硫酸是否也能与金属反应呢?是否也生成氢气呢?(启发学生从浓、稀硫酸的成分及其与金属的反应分析。)[提问]铜能与稀硫酸反应吗?为什么?[设问]铜能与浓硫酸反应吗? 推理并回答:不能。因为在金属活动顺序中铜排在氢的后面。讨论,迷惑不解。讨论并回顾浓硫酸的吸水性、脱水性。引出浓硫酸的强氧化性。 激发好奇心。
铜与浓硫酸的实验与讨论 [演示实验]浓硫酸与铜反应,要求学生注意反应现象。[强调]生成的气体使品红溶液褪色后,应用碱液吸收尾气。[讲解]实验中的灰黑色物质是副产物CuS等,原因较为复杂,因为时间的关系,这个问题留到课外再进行细致的探究。[展示]浓硫酸与铜反应后的溶液长时间冷却后的现象,观察。[引导讨论] 1、铜片与浓硫酸反应的条件是什么?2、根据反应现象你认为反应后的生成物是什么?写出反应方程式。并指出氧化剂、还原剂。反应中的浓硫酸表现出什么性质?[设问]浓硫酸是否也能氧化金属活动性顺序中氢以前的金属呢?[演示实验]把铝片放入盛有浓硫酸的试管中,观察现象。加热观察。[设问]为什么浓硫酸能与铜反应,而活泼的铝放入其中无明显现象呢?[讲解]对。若加热就会发生反应。但是没加热就真的没发生反应吗?不是的,这是因为浓硫酸具有强氧化性,它可以使某些金属如铁、铝等表面发生“钝化”。解释“钝化”现象。[展示图片]运输浓硫酸的槽车图片。[板书]浓硫酸与金属活动顺序氢以前的金属反应是否也生成氢气呢?为什么? 观察、描述现象:不加热时无明显现象。加热时产生的气体能使品红溶液褪色。溶液底部有灰黑色固体析出。冷却稀释后溶液呈蓝色。学生回答:有白色晶体析出。分析思考并回答:1、加热能反应。2、能使品红溶液褪色,加热溶液又呈红色说明生成了二氧化硫;溶液稀释后呈蓝色说明有铜离子生成。且长时间冷却后有白色晶体析出 证明生成的产物是硫酸铜。化学方程式:铜是还原剂,浓硫酸是氧化剂,浓硫酸既表现出氧化性又体现出了酸性。推理并回答:不能。因为浓硫酸的强氧化性表现在+6价的硫上。 培养实验观察能力。培养逻辑思维能力。激发求知欲。解惑,加深对浓硫酸的强氧化性的认识。
浓硫酸强氧化性的分析与小结 [小结、板书] 3、强氧化性[板书](1)氧化大多数金属单质(除Pt、Au不反应)KCa…Pb(H) … Cu Hg Ag。常温:反应 不反应(除Fe、Al钝化) 加热:反应 反应(不放出H2) (放出SO2)[回忆设疑、过渡]在“黑面包”实验中,为什么体积会膨胀,形成疏松多孔的海绵状炭,如同一个“黑面包”,这又体现浓硫酸的什么性质呢?请根据现象分析生成物是什么?写出反应方程式。[板书](2)氧化某些非金属单质(C、S)[组织讨论]通过刚才的学习我们了解浓硫酸具有强的氧化性,请分析为什么浓硫酸作干燥剂时不能干燥H2S、HI、HBr气体? 讨论、释疑:蔗糖加入浓硫酸炭化时,在蔗糖内加了几滴水,浓硫酸吸水放出大量的热,使浓硫酸与生成的碳发生氧化还原反应,有大量气体产生,生成的刺激性气味的气体是浓硫酸被还原所生成的二氧化硫,碳又被浓硫酸氧化成二氧化碳,因此会出现体积膨胀,疏松多孔海绵状炭及刺激性气味产生的现象。这体现了浓硫酸的氧化性。讨论得出因为浓硫酸的强氧化性。 培养推理、综合运用知识的能力。回忆前面的实验现象,激发学生继续探索。培养分析解决问题的能力。前后呼应,加深对浓硫酸的强氧化性的认识。学会辩证的认识问题。
本节内容的小结 [本节小结]这节课我们重点探究的是浓硫酸的化学特性。因为量变导致质变,所以浓硫酸体现以下与稀硫酸不同的特性:吸水性、脱水性、强氧化性。 师生小结:稀硫酸——可与活泼金属反应,生成H2;浓硫酸——强氧化性——加热时可与绝大多数金属和某些非金属反应,通常生成SO2——氧化性由S体现。 进一步理解量变引起质变的规律,树立辩证唯物主义的世界观。培养归纳总结能力。
课堂练习,巩固新知 [课堂练习]1、请说出下列现象中硫酸表现出来的性质:(1)敞口放置浓硫酸,溶液质量增加。(2)锌粒放入稀硫酸时,有气体放出。(3)铜片放入热的浓硫酸中,有气体放出。(4)把浓硫酸滴在滤纸上,滤纸往往发焦变黑。2、写出金属铁与稀硫酸反应的化学方程式,指出氧化剂和还原剂。铁和浓硫酸在加热时反应,生成硫酸铁、二氧化硫和水,写出化学方程式,并指出氧化剂和还原剂。[作业]P22页第6题。 学生讨论,得出结论。 巩固所学知识,培养运用所学知识解决问题的能力。
2.板书记录
一、纯硫酸的物理性质:
二、浓硫酸的特性:
1、 吸水性
2、脱水性
3、强氧化性
(1)氧化大多数金属反应(除Pt、Au不反应)
K Ca ……Pb(H) Cu Hg Ag。
常温:反应(除Fe、Al钝化)。 不反应。
加热:反应,不放出H2。 反应,放出SO2。
(2)氧化某些非金属单质(C、S)
3.相关链接
浓硫酸与铜反应的实验改进
①实验用品: 带支管的试管一只(2×18厘米),一段长约10厘米、内径2厘米玻璃管,一个不漏气的塑料袋,铁架台,酒精灯,一段长20厘米的粗铜丝(或铁丝)一个3号胶塞,一个4号胶塞,一段长4厘米的铁丝.浓硫酸,细铜丝一束(约5厘米长),品红试纸一片(1.5×1厘米)
②装置(见下图):1、铁架台 2、铁夹 3、酒精灯 4、浓硫酸溶液 5、细铜丝 6、具支试管 7、胶塞 8、粗钢丝 9、带一段铁丝的胶塞 10、品红试纸 11、玻璃管 12、塑料袋
③仪器制作
带粗铜丝胶塞的制作:取适合具支试管的4号胶塞一个,用一端较尖的粗铜丝(长约20厘米)穿透胶塞,粗铜丝在胶塞上能够上下活动即可,然后在铜丝伸入试管内的一端束上一束长约5厘米的细铜丝。
带塑料袋的玻璃管的制作:取一支试管(2 ×18厘米)截取10厘米,截取断口束上一个塑料袋(塑料袋在束的过程中不要扎破)
支管上胶塞的制作:取一只3号塞,按支管口径在中心打好孔,然后在胶塞的小头插入一根长约4厘米的铁丝,然后在距胶塞1.5厘米处弯成90°,再把末端弯一小钩以便用来挂品红试纸。
④实验方法:
首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
向试管中加入约10毫升的浓硫酸,加热,(在加热浓硫酸时,把粗铜丝向上提,细铜丝先不要伸入浓硫酸中),当加热至沸腾时,把粗铜丝向下按,使细铜丝完全浸入浓硫酸中,反应即刻发生。
⑤实验现象
当细铜丝接触浓硫酸时,有大量的白雾状气体放出(白雾状气体是由于二氧化硫气体与水结合形成亚硫酸小液滴缘故)并沿支管口喷在品红试纸上,使品红试纸的红色开始褪色,而且原来无色硫酸溶液开始变绿(变绿的原因是因为浓硫酸中含水少,如果把此溶液稀释后变蓝),当品红试纸完全褪成白色后,把粗铜丝向上提使细铜丝离开浓硫酸溶液,反应马上停止(这样做的原因,可保证细铜丝能够重复实验用)。
六.教学反思
本节通过设疑引入、演示实验、引导启发、知识对比、归纳总结生等方法的综合运用,较大程度的激发学生的学习积极性,从而促进教学目标的实现。对于本课时重难点的处理,主要采取以下做法:
1.用演示实验法和引导启发相结合,突出重点
新课的中心内容是浓硫酸的强氧化性,而强氧化性主要是通过浓硫酸与铜的演示实验及结果分析得出的,因此,做好这个实验,引导学生仔细观察实验,分析实验现象成为该课的关键之一。为了证明实验中产生的是二氧化硫,而不是氢气,用润湿的品红溶液,学生从品红试纸的褪色现象,很快推出正确结果,由此说明浓硫酸跟金属的反应是较复杂的氧化还原反应。再观察稀释后试管里溶液的颜色,便可推知反应还生成了硫酸铜,这样就可以让学生自己写出这个反应的化学方程式。
2.用新旧知识对比突破难点
为了突破浓硫酸与铜反应的本质这个难点,将浓硫酸与铜反应和稀硫酸与金属反应进行对比分析,从电子得失的角度剖析酸的通性和强氧化性的本质区别,从中得出以下结论,稀硫酸的氧化性实质是氢离子的氧化性,而氢离子的氧化性就是酸的通性之一,但浓硫酸的强氧化性是+6价的硫在特定条件下的氧化性。然后,顺理成章导出浓硫酸的强氧化性的其他表现,这样既突破难点,又调动了学生思维,提高了学生的思维能力。
21世纪教育网
www.
w.w.w.k.s.5.u.c.o.m
www.
1利用材料创设情景,引入课题
探究浓硫酸的强氧化性
对比探究
2演示实验
进一步回忆并分析“黑面包”实验
归纳分析明了浓硫酸的强氧化性
课堂练习:应用知识,解惑释疑
展示样品1探究归纳
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
