第二节 富集在海水中的元素--氯 教学设计
文档属性
| 名称 | 第二节 富集在海水中的元素--氯 教学设计 |

|
|
| 格式 | rar | ||
| 文件大小 | 18.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-09-24 00:00:00 | ||
图片预览


文档简介
富集在海水中的元素——氯
一、教学背景分析
1.教学内容分析
氯是一种比较典型的、重要的非金属元素,教材选择氯气的性质、用途以及Cl—的检验等内容进行比较全面的学习和研究,可以让学生了解典型非金属元素及其化合物的性质,对学生全面认识化学元素,掌握正确的学习方法具有重要作用。而且氯是海水中富集的一种元素,资源丰富,食盐、漂白粉等含氯的化合物非常熟悉,容易产生求知的欲望。
本节教学内容涉及到氯气的物理性质;氯气的化学性质中氯气与水的反应,包括氯水的成分、性质以及漂白原理;氯气与碱的反应,这也是漂白液、漂白粉的制取原理;此外,可以从研究氯水成分中初步介绍氯离子的检验方法。
2.学生情况分析
学生在初中化学的学习中知道应该从哪些方面描述物质的物理性质,学习过盐酸、NaCl与AgNO3溶液的反应,也在第一章学习蒸馏操作时接触过自来水中Cl-的检验方法。本节课学生应从离子反应、氧化还原反应等不同角度来理解和认识所涉及的化学反应,并结合第二章中学习到的分类方法,进行新知识的学习。
二、本课教学目标设计
1.知识与技能
(1)了解氯元素的存在及氯气的物理性质
(2)知道氯气与水、碱溶液反应的性质
(3)了解新制氯水的主要成分和次氯酸的漂白性
2.过程与方法
(1)通过引导学生完成研究氯气性质的微型实验,培养学生观察能力、分析问题能力和归纳总结的能力
(2)通过对氯气与水、氢氧化钠溶液反应的观察和分析,以及氯水漂白性的分析,让学生认识对比实验的方法,体会实验对认识和研究物质性质的重要作用
3.情感态度与价值观
(1)通过微量实验和对氯气跟氢氧化钠溶液反应的观察,激发学生的学习兴趣,逐步树立透过实验现象揭示化学本质的科学思想
(2)通过对身边清洁剂、消毒剂使用问题的分析,以及微量实验的设计,让学生体会化学与生活、化学与环境保护的关系,注意理论联系实际,培养学生关注社会的意识和责任感
三、教学重难点
重点:氯气与水反应、与碱反应的性质
难点:氯水的成分,氯气与氢氧化钠溶液的反应
四、教学方法与手段
教学方法:讲授与实验相结合
教学手段:多媒体辅助教学
五、教学用品
1.演示实验
(1)仪器:注射器(20 mL)、小烧杯、洗瓶
(2)试剂:NaOH溶液、蒸馏水
(3)用品:充满氯气的集气瓶、充满Cl2的矿泉水瓶
(4)教学设备:多媒体电脑、投影仪
2.学生实验
(1)仪器:小烧杯、胶头滴管、镊子、洗瓶
(2)试剂:84消毒液、稀硫酸、AgNO3溶液、NaOH溶液、蒸馏水
(3)用品:磁盘盒、蓝色石蕊试纸、红纸片
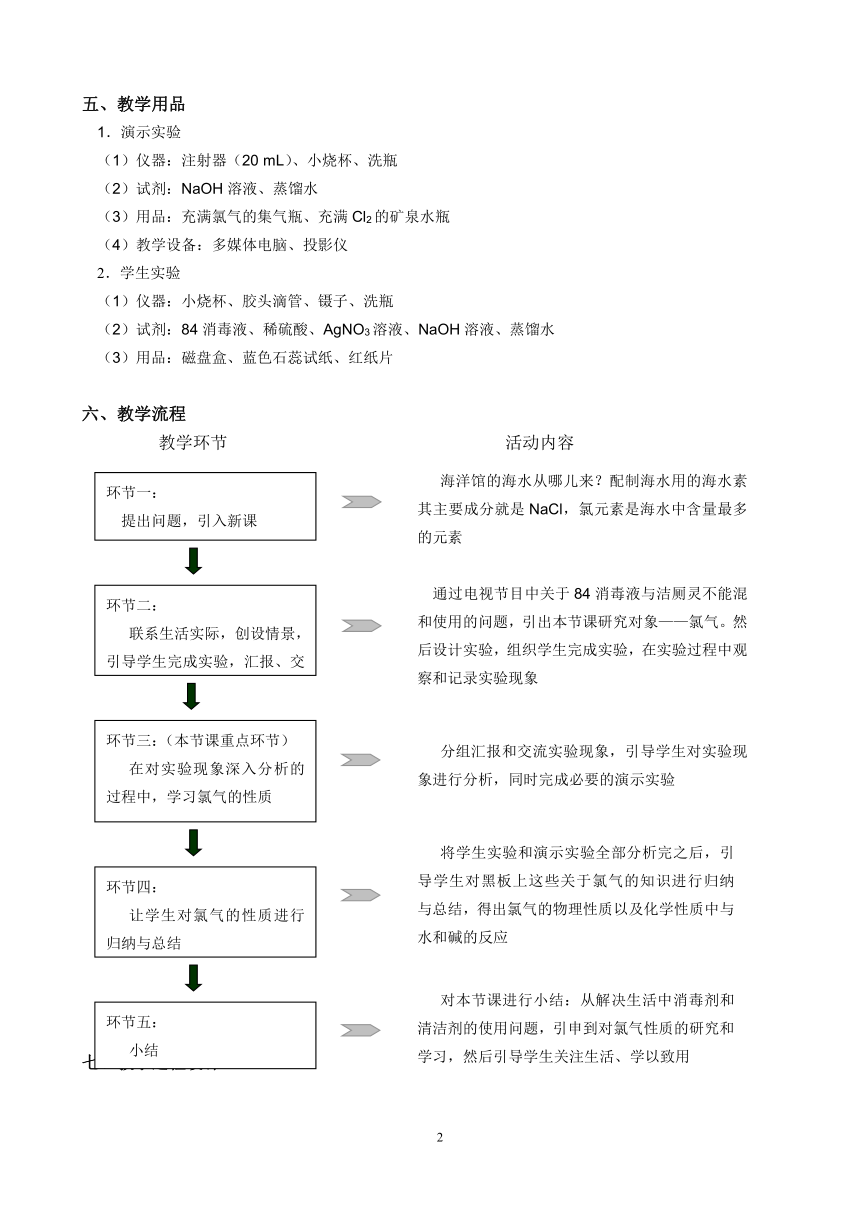
六、教学流程
教学环节 活动内容
七、教学过程设计
教学环节 教师活动 学生活动 设计意图
新课引入 [图片、提问]北京海洋馆的图片。你知道海洋馆的海水是从哪儿来的吗?[讲述、投影]海洋馆的海水是用海水素配制而成,海水素的主要成分就是各种盐类,其中NaCl的含量最多。氯元素是海水中含量最多的元素。[板书]富集在海水中的元素——氯 回答倾听 激发学生兴趣,紧扣主题让学生体会氯元素是一种重要的成盐元素
创设情景,引导学生完成实验 [讲述]海水中的氯元素是以Cl-的形式存在,生活中还有其它形式的氯元素,比如84消毒液中的NaClO。[视频]BTV-7《生活面对面》的一期节目:84消毒液和洁厕灵不能混合使用。[过渡]二者为什么不能混合使用呢?84消毒液的有效成分是NaClO,洁厕灵的主要成分是酸,它们混合后会出现什么现象?[实验]引导学生按照投影所示的实验步骤完成实验。 倾听 完成实验 创设情景,实验活动作铺垫培养学生操作能力和观察能力
分组汇报交流讨论 [汇报、交流]分组汇报实验现象,组间交流。[讲述]84消毒液中产生的气体就是氯气,它是一种有毒的气体,会损伤人的喉粘膜和肺,严重时会窒息致死。因此不能将84消毒液与洁厕灵等酸性物质混合使用。 分组讨论、交流现象:① 84消毒液中产生气泡② 干红纸无明显现象③ 湿红纸褪色④ 蓝色试纸先变红后褪色⑤ AgNO3溶液产生白色沉淀⑥ NaOH溶液无明显现象 培养学生合作学习的意识培养学生记录、分析整理实验现象的能力
引导学生对实验现象进行全面分析 [展示、提问]收集在集气瓶中的Cl2,仔细观察,你又对Cl2有哪些了解?[思考]Cl2是一种有毒的气体,如何闻它的气味?[过渡] 下面的实验现象实际是84消毒液中产生的Cl2扩散开来,跟不同物质发生作用的结果。[板书]一、氯气(Cl2)[思考]请你分析干燥红纸和湿润红纸的现象,能够得到什么结论?[提问]除了这两个实验,还有哪些实验现象可以说明Cl2与水反应了?[思考]湿润的红纸褪色、蓝色试纸最终也变成白色,是什么把它们漂白的呢?Cl2、H2O、HCl有漂白性吗?还是存在着另外一种物质?[讲解]Cl2跟水反应除了生成HCl外还生成另外一种产物:HClO(次氯酸)。它有强氧化性,可以漂白一些有机色素。[板书]Cl2 + H2O = HCl + HClO 次氯酸(强氧化性酸)[演示实验]将Cl2与水混合仅仅发生反应吗?我来给大家做的实验:向充满Cl2的矿泉水瓶中注入约20 mL 水。[提问]在你们的实验中NaOH溶液没有明显现象,是Cl2没有跟NaOH反应吗?[演示实验] 向另一只充满Cl2的矿泉水瓶中注入约20 mL NaOH溶液。观察现象。[思考]Cl2跟NaOH反应的产物有什么?试着写出Cl2跟Ca(OH)2反应的方程式。[板书]Cl2 + 2NaOH = NaCl + NaClO + H2O2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O[讲述]这两个反应就是制取84消毒液和漂白粉的原理。 观察、回答: 黄绿色气体、密度比空气大演示闻气味的方法回答:有刺激性气味思考回答:Cl2与水反应思考、回答:蓝色石蕊试纸先变红、AgNO3溶液出现白色沉淀可以说明。 观察 回答:Cl2能溶于水思考回答观察回答:矿泉水瓶变瘪,黄绿色气体消失思考回答 引导学生体会对比实验的方法在化学研究中的重要作用培养学生观察能力,逐步树立透过实验现象揭示化学本质的科学思想
引导学生对知识进行归纳和总结 [归纳、总结] 刚才我们通过对实验现象的分析,了解了许多Cl2的性质,下面请你将这些知识进行归纳和总结。[板书] 1.物理性质 2.化学性质(1)与水反应(2)与碱反应[投影、思考] 84消毒液说明书中的注意事项。如果身边的人使用时,你对他还有什么建议吗?[小结]今天节课我们了解了一个生活中应该知道的知识,就是不能将84消毒液与洁厕灵混合使用,在解决这个问题的过程中我们还学习了Cl2的性质。其实化学就在我们身边,关注生活我们也可以从中学到很多化学知识,并且还能够学以致用。 思考 回答 回答:提示他注意84消毒液不能与酸性物质混合使用 培养学生对知识进行整理、归纳和总结的意识和能力让学生体会化学与生活、化学与环境保护的关系,注意理论联系实际,培养学生关注社会的意识和责任感
板 书 设 计
八、教学反思
富集在海水中的元素——氯
一、氯气
1.物理性质
2.化学性质
(1)跟水反应
Cl2 + H2O = HCl + HClO
次氯酸(强氧化性酸)
(2)跟碱反应
Cl2 + 2 NaOH = NaCl + NaClO + H2O
2 Cl2 + 2 Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2 H2O
环节三:(本节课重点环节)
在对实验现象深入分析的过程中,学习氯气的性质
环节二:
联系生活实际,创设情景,引导学生完成实验,汇报、交流
环节一:
提出问题,引入新课
对本节课进行小结:从解决生活中消毒剂和清洁剂的使用问题,引申到对氯气性质的研究和学习,然后引导学生关注生活、学以致用
将学生实验和演示实验全部分析完之后,引导学生对黑板上这些关于氯气的知识进行归纳与总结,得出氯气的物理性质以及化学性质中与水和碱的反应
分组汇报和交流实验现象,引导学生对实验现象进行分析,同时完成必要的演示实验
通过电视节目中关于84消毒液与洁厕灵不能混和使用的问题,引出本节课研究对象——氯气。然后设计实验,组织学生完成实验,在实验过程中观察和记录实验现象
海洋馆的海水从哪儿来?配制海水用的海水素其主要成分就是NaCl,氯元素是海水中含量最多的元素
环节四:
让学生对氯气的性质进行归纳与总结
环节五:
小结
PAGE
1
一、教学背景分析
1.教学内容分析
氯是一种比较典型的、重要的非金属元素,教材选择氯气的性质、用途以及Cl—的检验等内容进行比较全面的学习和研究,可以让学生了解典型非金属元素及其化合物的性质,对学生全面认识化学元素,掌握正确的学习方法具有重要作用。而且氯是海水中富集的一种元素,资源丰富,食盐、漂白粉等含氯的化合物非常熟悉,容易产生求知的欲望。
本节教学内容涉及到氯气的物理性质;氯气的化学性质中氯气与水的反应,包括氯水的成分、性质以及漂白原理;氯气与碱的反应,这也是漂白液、漂白粉的制取原理;此外,可以从研究氯水成分中初步介绍氯离子的检验方法。
2.学生情况分析
学生在初中化学的学习中知道应该从哪些方面描述物质的物理性质,学习过盐酸、NaCl与AgNO3溶液的反应,也在第一章学习蒸馏操作时接触过自来水中Cl-的检验方法。本节课学生应从离子反应、氧化还原反应等不同角度来理解和认识所涉及的化学反应,并结合第二章中学习到的分类方法,进行新知识的学习。
二、本课教学目标设计
1.知识与技能
(1)了解氯元素的存在及氯气的物理性质
(2)知道氯气与水、碱溶液反应的性质
(3)了解新制氯水的主要成分和次氯酸的漂白性
2.过程与方法
(1)通过引导学生完成研究氯气性质的微型实验,培养学生观察能力、分析问题能力和归纳总结的能力
(2)通过对氯气与水、氢氧化钠溶液反应的观察和分析,以及氯水漂白性的分析,让学生认识对比实验的方法,体会实验对认识和研究物质性质的重要作用
3.情感态度与价值观
(1)通过微量实验和对氯气跟氢氧化钠溶液反应的观察,激发学生的学习兴趣,逐步树立透过实验现象揭示化学本质的科学思想
(2)通过对身边清洁剂、消毒剂使用问题的分析,以及微量实验的设计,让学生体会化学与生活、化学与环境保护的关系,注意理论联系实际,培养学生关注社会的意识和责任感
三、教学重难点
重点:氯气与水反应、与碱反应的性质
难点:氯水的成分,氯气与氢氧化钠溶液的反应
四、教学方法与手段
教学方法:讲授与实验相结合
教学手段:多媒体辅助教学
五、教学用品
1.演示实验
(1)仪器:注射器(20 mL)、小烧杯、洗瓶
(2)试剂:NaOH溶液、蒸馏水
(3)用品:充满氯气的集气瓶、充满Cl2的矿泉水瓶
(4)教学设备:多媒体电脑、投影仪
2.学生实验
(1)仪器:小烧杯、胶头滴管、镊子、洗瓶
(2)试剂:84消毒液、稀硫酸、AgNO3溶液、NaOH溶液、蒸馏水
(3)用品:磁盘盒、蓝色石蕊试纸、红纸片
六、教学流程
教学环节 活动内容
七、教学过程设计
教学环节 教师活动 学生活动 设计意图
新课引入 [图片、提问]北京海洋馆的图片。你知道海洋馆的海水是从哪儿来的吗?[讲述、投影]海洋馆的海水是用海水素配制而成,海水素的主要成分就是各种盐类,其中NaCl的含量最多。氯元素是海水中含量最多的元素。[板书]富集在海水中的元素——氯 回答倾听 激发学生兴趣,紧扣主题让学生体会氯元素是一种重要的成盐元素
创设情景,引导学生完成实验 [讲述]海水中的氯元素是以Cl-的形式存在,生活中还有其它形式的氯元素,比如84消毒液中的NaClO。[视频]BTV-7《生活面对面》的一期节目:84消毒液和洁厕灵不能混合使用。[过渡]二者为什么不能混合使用呢?84消毒液的有效成分是NaClO,洁厕灵的主要成分是酸,它们混合后会出现什么现象?[实验]引导学生按照投影所示的实验步骤完成实验。 倾听 完成实验 创设情景,实验活动作铺垫培养学生操作能力和观察能力
分组汇报交流讨论 [汇报、交流]分组汇报实验现象,组间交流。[讲述]84消毒液中产生的气体就是氯气,它是一种有毒的气体,会损伤人的喉粘膜和肺,严重时会窒息致死。因此不能将84消毒液与洁厕灵等酸性物质混合使用。 分组讨论、交流现象:① 84消毒液中产生气泡② 干红纸无明显现象③ 湿红纸褪色④ 蓝色试纸先变红后褪色⑤ AgNO3溶液产生白色沉淀⑥ NaOH溶液无明显现象 培养学生合作学习的意识培养学生记录、分析整理实验现象的能力
引导学生对实验现象进行全面分析 [展示、提问]收集在集气瓶中的Cl2,仔细观察,你又对Cl2有哪些了解?[思考]Cl2是一种有毒的气体,如何闻它的气味?[过渡] 下面的实验现象实际是84消毒液中产生的Cl2扩散开来,跟不同物质发生作用的结果。[板书]一、氯气(Cl2)[思考]请你分析干燥红纸和湿润红纸的现象,能够得到什么结论?[提问]除了这两个实验,还有哪些实验现象可以说明Cl2与水反应了?[思考]湿润的红纸褪色、蓝色试纸最终也变成白色,是什么把它们漂白的呢?Cl2、H2O、HCl有漂白性吗?还是存在着另外一种物质?[讲解]Cl2跟水反应除了生成HCl外还生成另外一种产物:HClO(次氯酸)。它有强氧化性,可以漂白一些有机色素。[板书]Cl2 + H2O = HCl + HClO 次氯酸(强氧化性酸)[演示实验]将Cl2与水混合仅仅发生反应吗?我来给大家做的实验:向充满Cl2的矿泉水瓶中注入约20 mL 水。[提问]在你们的实验中NaOH溶液没有明显现象,是Cl2没有跟NaOH反应吗?[演示实验] 向另一只充满Cl2的矿泉水瓶中注入约20 mL NaOH溶液。观察现象。[思考]Cl2跟NaOH反应的产物有什么?试着写出Cl2跟Ca(OH)2反应的方程式。[板书]Cl2 + 2NaOH = NaCl + NaClO + H2O2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O[讲述]这两个反应就是制取84消毒液和漂白粉的原理。 观察、回答: 黄绿色气体、密度比空气大演示闻气味的方法回答:有刺激性气味思考回答:Cl2与水反应思考、回答:蓝色石蕊试纸先变红、AgNO3溶液出现白色沉淀可以说明。 观察 回答:Cl2能溶于水思考回答观察回答:矿泉水瓶变瘪,黄绿色气体消失思考回答 引导学生体会对比实验的方法在化学研究中的重要作用培养学生观察能力,逐步树立透过实验现象揭示化学本质的科学思想
引导学生对知识进行归纳和总结 [归纳、总结] 刚才我们通过对实验现象的分析,了解了许多Cl2的性质,下面请你将这些知识进行归纳和总结。[板书] 1.物理性质 2.化学性质(1)与水反应(2)与碱反应[投影、思考] 84消毒液说明书中的注意事项。如果身边的人使用时,你对他还有什么建议吗?[小结]今天节课我们了解了一个生活中应该知道的知识,就是不能将84消毒液与洁厕灵混合使用,在解决这个问题的过程中我们还学习了Cl2的性质。其实化学就在我们身边,关注生活我们也可以从中学到很多化学知识,并且还能够学以致用。 思考 回答 回答:提示他注意84消毒液不能与酸性物质混合使用 培养学生对知识进行整理、归纳和总结的意识和能力让学生体会化学与生活、化学与环境保护的关系,注意理论联系实际,培养学生关注社会的意识和责任感
板 书 设 计
八、教学反思
富集在海水中的元素——氯
一、氯气
1.物理性质
2.化学性质
(1)跟水反应
Cl2 + H2O = HCl + HClO
次氯酸(强氧化性酸)
(2)跟碱反应
Cl2 + 2 NaOH = NaCl + NaClO + H2O
2 Cl2 + 2 Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2 H2O
环节三:(本节课重点环节)
在对实验现象深入分析的过程中,学习氯气的性质
环节二:
联系生活实际,创设情景,引导学生完成实验,汇报、交流
环节一:
提出问题,引入新课
对本节课进行小结:从解决生活中消毒剂和清洁剂的使用问题,引申到对氯气性质的研究和学习,然后引导学生关注生活、学以致用
将学生实验和演示实验全部分析完之后,引导学生对黑板上这些关于氯气的知识进行归纳与总结,得出氯气的物理性质以及化学性质中与水和碱的反应
分组汇报和交流实验现象,引导学生对实验现象进行分析,同时完成必要的演示实验
通过电视节目中关于84消毒液与洁厕灵不能混和使用的问题,引出本节课研究对象——氯气。然后设计实验,组织学生完成实验,在实验过程中观察和记录实验现象
海洋馆的海水从哪儿来?配制海水用的海水素其主要成分就是NaCl,氯元素是海水中含量最多的元素
环节四:
让学生对氯气的性质进行归纳与总结
环节五:
小结
PAGE
1
