《物质的分类转化》教学课件
图片预览









文档简介
课件33张PPT。化学家眼中的物质世界第一单元 :丰富多彩 化学物质 一 物质的分类[回顾]一 分类方法
(1)单一分类法
(2 )交叉分类法
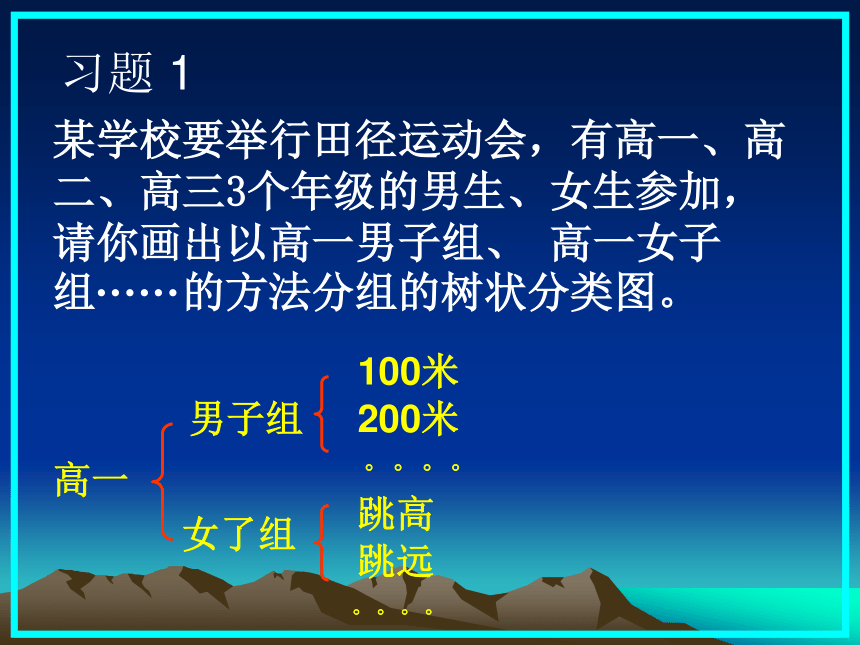
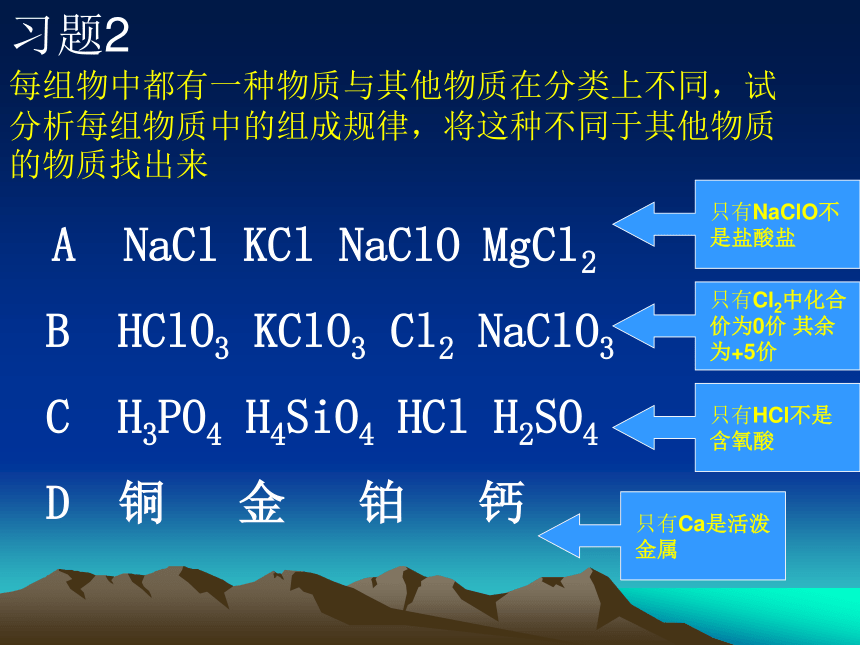
(3)树状分类法某学校要举行田径运动会,有高一、高二、高三3个年级的男生、女生参加,请你画出以高一男子组、 高一女子组······的方法分组的树状分类图。 习题 1男子组高一女了组100米200米。。。。跳高跳远。。。。习题2每组物中都有一种物质与其他物质在分类上不同,试分析每组物质中的组成规律,将这种不同于其他物质的物质找出来 A NaCl KCl NaClO MgCl2
B HClO3 KClO3 Cl2 NaClO3
C H3PO4 H4SiO4 HCl H2SO4
D 铜 金 铂 钙第一单元 :丰富多彩 化学物质 一 物质的分类专题一:化学家眼中的物质世界(一) 分类方法
(1)单一分类法 (2 )交叉分类法 (3)树状分类法(二) 物质间的转化有一定的条件,也有一定的规律(二) 物质间的转化1.按物质的类别研究物质的转化[交流与讨论](1).物质的转化类型(不同类别 物质相互转化)CaO +H2O====Ca(OH)2
H2SO4 +2NaOH====Na2SO4 +2H2O
CO2+H2O====H2CO3
NaOH +HCl====NaCl+H2O
Fe +CuSO4====FeSO4+Cu
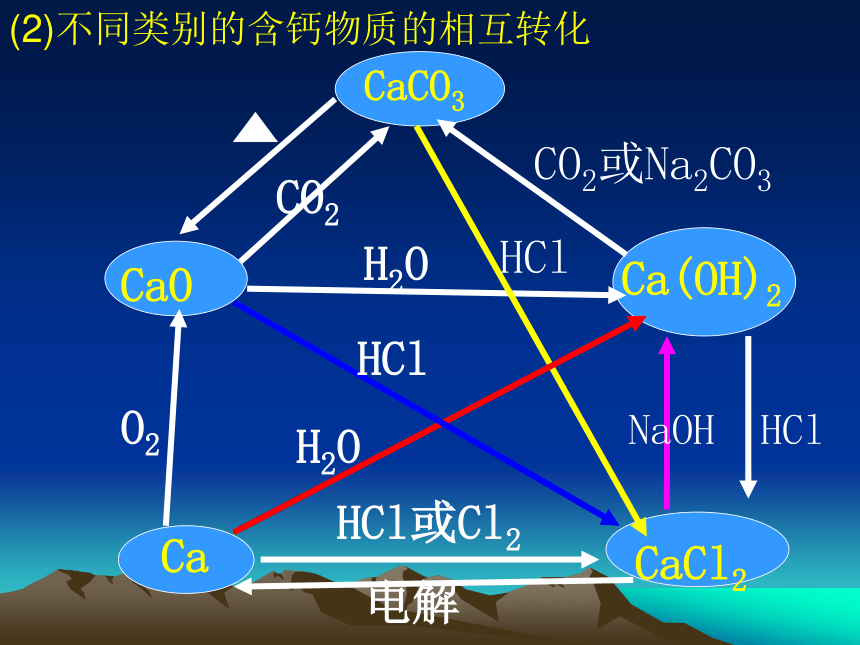
碳酸钙生成氧化钙二氧化碳生成葡萄糖CaCO3CaOCa(OH)2CaCl2CaCO2CO2或Na2CO3 H2OO2 H2O HCl HCl HClHCl或Cl2 NaOH(2)不同类别的含钙物质的相互转化 电解(二) 物质间的转化1.按物质的类别研究物质的转化(1).物质的转化类型(不同类别物质相互转化)(2)不同类别的含钙物质的相互转化
2.按反应类型研究物质的转化(1). 四种基本类型的化学反应化合反应分解反应置换反应复分解反应A+B=ABAB=A+BAB+C=A+BCAB+CD=AD+CBH2SO4 +2NaOH====Na2SO4 +2H2O
(2) 两类反应发生的条件(1)在水溶液中,发生的复分解反应,至少要具备下列条件之一:
a: 生成沉淀(包括微溶物)b:生成挥发性物质(气体)c:生成难电离物(如水)(2)在水溶液中,一种金属与另一种可溶性金属的盐溶液发生置换反应具备的条件是:活动性强的金属置换活动性弱的金属作业:把不同类别的含钙物质的相互转化的方程式,写出转化类型及反应类型。化学反应化合反应分解反应置换反应复分解反应依据:据反应物或生成物的类别化学反应氧化还原反应非氧化还原反应氧化还原反应:
有元素化合价发生变化的反应第二课时 复分解反应解读“两性”反应 1. 酸 + 碱容易HCl + NaOH = NaCl + H2O 容易3HCl+Fe(OH)3=FeCl3+3H2O不反应H2CO3 + Mg(OH)2 —HCl + NaOHHCl + Fe(OH)3H2CO3 + Mg(OH)2练一练判断下列各组物质能发生反应的是( )
A、HNO3与Cu(OH)2
B、H2SO4与Ca(OH)2
C、H2CO3与Fe(OH)3强酸 弱碱强酸 强碱弱酸 弱碱AB“两性”反应 2.酸+碱性氧化物 容易6HCl+Fe2O3=2FeCl3+2H3O 容易2CH3COOH+CaO=Ca(CH3COO)2+H2O 不反应H2CO3+CuO —HCl+Fe2O3CH3COOH+CaOH2CO3+CuO练一练判断下列各组物质能发生反应的是( )
A、HNO3与CuO
B、H2SO4与Na2O
C、H2CO3与MgO强酸 弱碱性氧化物强酸 强碱性氧化物弱酸 弱碱性氧化物AB“两性”反应 3.酸性氧化物 +碱容易CO2+2NaOH=Na2CO3+H2O容易CO2+2NH3·H2O=(NH4)2CO3+H2O不反应CO2+Mg(OH)2—CO2 + NaOHCO2 + NH3·H2OCO2 + Mg(OH)2练一练判断下列各组物质能发生反应的是( )
A、CO2 与 KOH
B、CO2 与 Ba(OH)2
C、CO2 与 Fe(OH)2弱酸性氧化物 强碱AB弱酸性氧化物 强碱弱酸性氧化物 弱碱“两性”反应 4.酸性氧化物 +碱性氧化物 容易CO2+CaO=CaCO3不反应CO2+CuO —CO2+CaOCO2+CuO练一练判断下列各组物质能发生反应的是( )
A、CO2 与 Na2O
B、CO2 与 Fe2O3弱酸性氧化物 强碱性氧化物 A弱酸性氧化物 弱碱性氧化物 以“强”制“弱”的反应 1. 以较强的酸制取较弱的酸CH3COONa+HCl=CH3COOH+NaCl2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O 酸性 强酸>CH3COOH>H2CO3 2CH3COOH+Na2CO3=2CH3COONa+H2CO 3练一练判断下列各组物质能发生反应的是( )
A、HNO3与CaCO3
B、H2SO4与CH3COONa
C、H2CO3与CaCl2强酸 弱酸盐强酸 弱酸盐弱酸 强酸盐AB以“强”制“弱”的反应 2. 以较强的碱制取较弱的碱NaOH+NH4Cl=NH3·H2O+NaCl碱性 强碱>NH3·H2O>Cu(OH)2(等) 2NH3·H2O+CuSO4=Cu(OH)2↓+ (NH4)2SO4练一练判断下列各组物质能发生反应的是( )
A、NaOH与FeCl3
B、Ca(OH)2与NaCl强碱 弱碱盐强碱 强碱盐A第三课时 复分解反应条件解读以“大”制“小”的反应 即:化合物与化合物之间的反应,溶解度大
的物质可制取溶解度小的物质NaCl + AgNO3=AgCl↓ + NaNO3 易溶 易溶 难溶 易溶 溶
解
度 NaCl
AgNO3 >AgCl以“大”制“小”的反应 写出能反应生成BaSO4的化学方程式过
程
与
方
法1. 确定含钡的可溶性化合物 Ba(OH)2 BaCl2 Ba(NO3)22. 确定含SO42-的可溶性化合物 H2SO4 Na2SO4 K2SO4 MgSO4
Al2(SO4)3 ZnSO4 Fe2(SO4)3 FeSO4
CuSO4 (NH4)2SO4 以“大”制“小”的反应 写出能反应生成BaSO4的化学方程式过
程
与
方
法3. 两两组合写出反应的化学方程式 3BaCl2 + Fe2(SO4)3 = 3 BaSO4 ↓ +2 FeCl3可写出的化学方程式有30个[学生活动] 写出能反应生成CaCO3的化学方程式1. 确定含钙的可溶性化合物Ca(OH)2 CaCl2 Ca(NO3)22. 确定含CO32-的可溶性化合物 Na2CO3 K2CO3 (NH4)2CO33. 两两组合写出反应的化学方程式 可写出的化学方程式有9个[方法点拨] 关键:常见物质的溶解性 判断化学方程式 是否正确BaCl2 + CaCO3 = BaCO3↓+ CaCl2CaCO3 + H2SO4 = CaSO4 + CO2↑+ H2O错误正确复分解反应条件的解读 生成物中有沉淀、气体、水三者之一生成 沉淀以“大”制“小”气体以“强”制“弱”水“两性”间的反应
(1)单一分类法
(2 )交叉分类法
(3)树状分类法某学校要举行田径运动会,有高一、高二、高三3个年级的男生、女生参加,请你画出以高一男子组、 高一女子组······的方法分组的树状分类图。 习题 1男子组高一女了组100米200米。。。。跳高跳远。。。。习题2每组物中都有一种物质与其他物质在分类上不同,试分析每组物质中的组成规律,将这种不同于其他物质的物质找出来 A NaCl KCl NaClO MgCl2
B HClO3 KClO3 Cl2 NaClO3
C H3PO4 H4SiO4 HCl H2SO4
D 铜 金 铂 钙第一单元 :丰富多彩 化学物质 一 物质的分类专题一:化学家眼中的物质世界(一) 分类方法
(1)单一分类法 (2 )交叉分类法 (3)树状分类法(二) 物质间的转化有一定的条件,也有一定的规律(二) 物质间的转化1.按物质的类别研究物质的转化[交流与讨论](1).物质的转化类型(不同类别 物质相互转化)CaO +H2O====Ca(OH)2
H2SO4 +2NaOH====Na2SO4 +2H2O
CO2+H2O====H2CO3
NaOH +HCl====NaCl+H2O
Fe +CuSO4====FeSO4+Cu
碳酸钙生成氧化钙二氧化碳生成葡萄糖CaCO3CaOCa(OH)2CaCl2CaCO2CO2或Na2CO3 H2OO2 H2O HCl HCl HClHCl或Cl2 NaOH(2)不同类别的含钙物质的相互转化 电解(二) 物质间的转化1.按物质的类别研究物质的转化(1).物质的转化类型(不同类别物质相互转化)(2)不同类别的含钙物质的相互转化
2.按反应类型研究物质的转化(1). 四种基本类型的化学反应化合反应分解反应置换反应复分解反应A+B=ABAB=A+BAB+C=A+BCAB+CD=AD+CBH2SO4 +2NaOH====Na2SO4 +2H2O
(2) 两类反应发生的条件(1)在水溶液中,发生的复分解反应,至少要具备下列条件之一:
a: 生成沉淀(包括微溶物)b:生成挥发性物质(气体)c:生成难电离物(如水)(2)在水溶液中,一种金属与另一种可溶性金属的盐溶液发生置换反应具备的条件是:活动性强的金属置换活动性弱的金属作业:把不同类别的含钙物质的相互转化的方程式,写出转化类型及反应类型。化学反应化合反应分解反应置换反应复分解反应依据:据反应物或生成物的类别化学反应氧化还原反应非氧化还原反应氧化还原反应:
有元素化合价发生变化的反应第二课时 复分解反应解读“两性”反应 1. 酸 + 碱容易HCl + NaOH = NaCl + H2O 容易3HCl+Fe(OH)3=FeCl3+3H2O不反应H2CO3 + Mg(OH)2 —HCl + NaOHHCl + Fe(OH)3H2CO3 + Mg(OH)2练一练判断下列各组物质能发生反应的是( )
A、HNO3与Cu(OH)2
B、H2SO4与Ca(OH)2
C、H2CO3与Fe(OH)3强酸 弱碱强酸 强碱弱酸 弱碱AB“两性”反应 2.酸+碱性氧化物 容易6HCl+Fe2O3=2FeCl3+2H3O 容易2CH3COOH+CaO=Ca(CH3COO)2+H2O 不反应H2CO3+CuO —HCl+Fe2O3CH3COOH+CaOH2CO3+CuO练一练判断下列各组物质能发生反应的是( )
A、HNO3与CuO
B、H2SO4与Na2O
C、H2CO3与MgO强酸 弱碱性氧化物强酸 强碱性氧化物弱酸 弱碱性氧化物AB“两性”反应 3.酸性氧化物 +碱容易CO2+2NaOH=Na2CO3+H2O容易CO2+2NH3·H2O=(NH4)2CO3+H2O不反应CO2+Mg(OH)2—CO2 + NaOHCO2 + NH3·H2OCO2 + Mg(OH)2练一练判断下列各组物质能发生反应的是( )
A、CO2 与 KOH
B、CO2 与 Ba(OH)2
C、CO2 与 Fe(OH)2弱酸性氧化物 强碱AB弱酸性氧化物 强碱弱酸性氧化物 弱碱“两性”反应 4.酸性氧化物 +碱性氧化物 容易CO2+CaO=CaCO3不反应CO2+CuO —CO2+CaOCO2+CuO练一练判断下列各组物质能发生反应的是( )
A、CO2 与 Na2O
B、CO2 与 Fe2O3弱酸性氧化物 强碱性氧化物 A弱酸性氧化物 弱碱性氧化物 以“强”制“弱”的反应 1. 以较强的酸制取较弱的酸CH3COONa+HCl=CH3COOH+NaCl2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O 酸性 强酸>CH3COOH>H2CO3 2CH3COOH+Na2CO3=2CH3COONa+H2CO 3练一练判断下列各组物质能发生反应的是( )
A、HNO3与CaCO3
B、H2SO4与CH3COONa
C、H2CO3与CaCl2强酸 弱酸盐强酸 弱酸盐弱酸 强酸盐AB以“强”制“弱”的反应 2. 以较强的碱制取较弱的碱NaOH+NH4Cl=NH3·H2O+NaCl碱性 强碱>NH3·H2O>Cu(OH)2(等) 2NH3·H2O+CuSO4=Cu(OH)2↓+ (NH4)2SO4练一练判断下列各组物质能发生反应的是( )
A、NaOH与FeCl3
B、Ca(OH)2与NaCl强碱 弱碱盐强碱 强碱盐A第三课时 复分解反应条件解读以“大”制“小”的反应 即:化合物与化合物之间的反应,溶解度大
的物质可制取溶解度小的物质NaCl + AgNO3=AgCl↓ + NaNO3 易溶 易溶 难溶 易溶 溶
解
度 NaCl
AgNO3 >AgCl以“大”制“小”的反应 写出能反应生成BaSO4的化学方程式过
程
与
方
法1. 确定含钡的可溶性化合物 Ba(OH)2 BaCl2 Ba(NO3)22. 确定含SO42-的可溶性化合物 H2SO4 Na2SO4 K2SO4 MgSO4
Al2(SO4)3 ZnSO4 Fe2(SO4)3 FeSO4
CuSO4 (NH4)2SO4 以“大”制“小”的反应 写出能反应生成BaSO4的化学方程式过
程
与
方
法3. 两两组合写出反应的化学方程式 3BaCl2 + Fe2(SO4)3 = 3 BaSO4 ↓ +2 FeCl3可写出的化学方程式有30个[学生活动] 写出能反应生成CaCO3的化学方程式1. 确定含钙的可溶性化合物Ca(OH)2 CaCl2 Ca(NO3)22. 确定含CO32-的可溶性化合物 Na2CO3 K2CO3 (NH4)2CO33. 两两组合写出反应的化学方程式 可写出的化学方程式有9个[方法点拨] 关键:常见物质的溶解性 判断化学方程式 是否正确BaCl2 + CaCO3 = BaCO3↓+ CaCl2CaCO3 + H2SO4 = CaSO4 + CO2↑+ H2O错误正确复分解反应条件的解读 生成物中有沉淀、气体、水三者之一生成 沉淀以“大”制“小”气体以“强”制“弱”水“两性”间的反应
