《共价键的类型》教学课件
图片预览



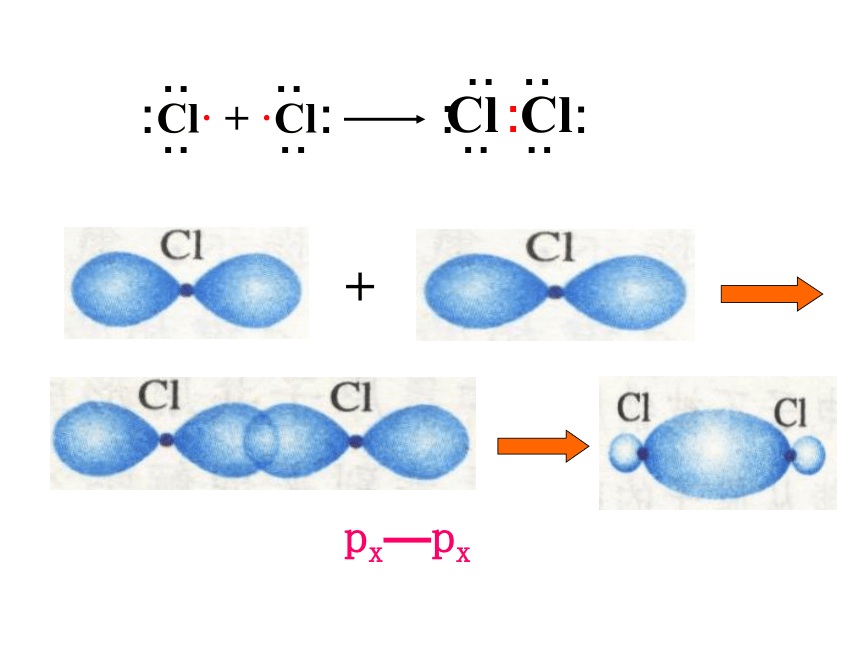
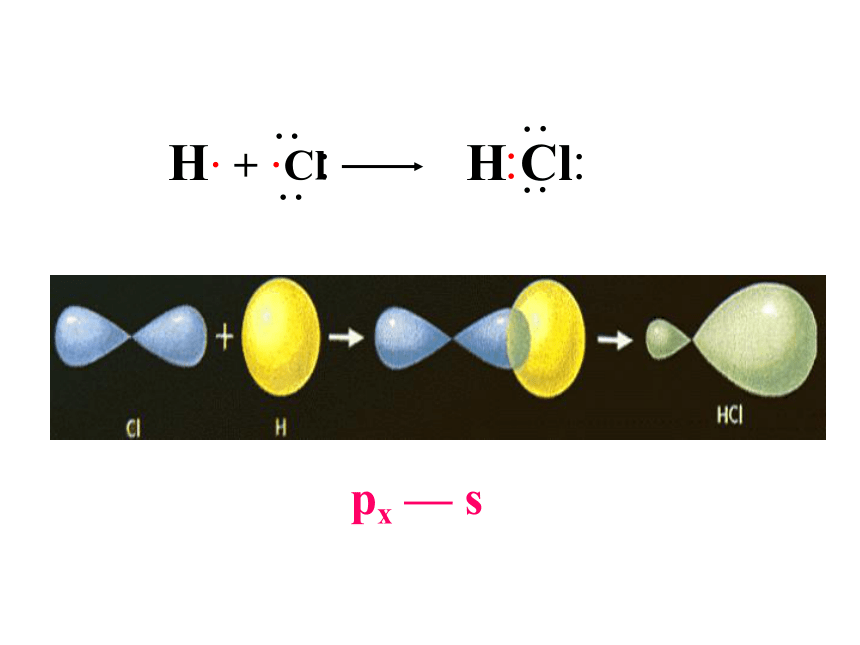
文档简介
(共39张PPT)
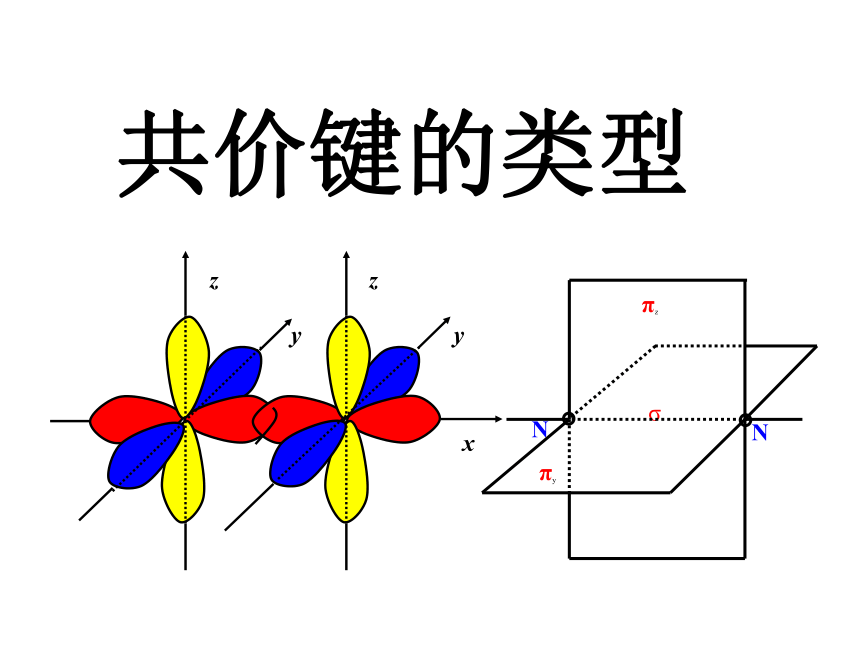
共价键的类型
z
z
y
y
x
σ
N
N
πz
πy
一、共价键
1、定义:
2、成键微粒:
3、成键本质:
4、成键原因:
原子间通过共用电子对所形成的的化学键。
原 子
共用电子对
不稳定要趋于稳定;体系能量降低
复习
5、成键的条件:
电负性相同或差值小的非金属原子之间且成键的原子
最外层未达到饱和状态,即成键原子有未成对电子。
二、共价键的形成本质
重叠
相反
未成对
共用电子对
增 加
降低
成键原子相互接近时,原子轨道发生 ,自
旋方向 的 电子形成 ,两原
子核间的电子密度 ,体系的能 。
三、共价键的特征
1、具有饱和性
形成的共价键数 = 未成对电子数
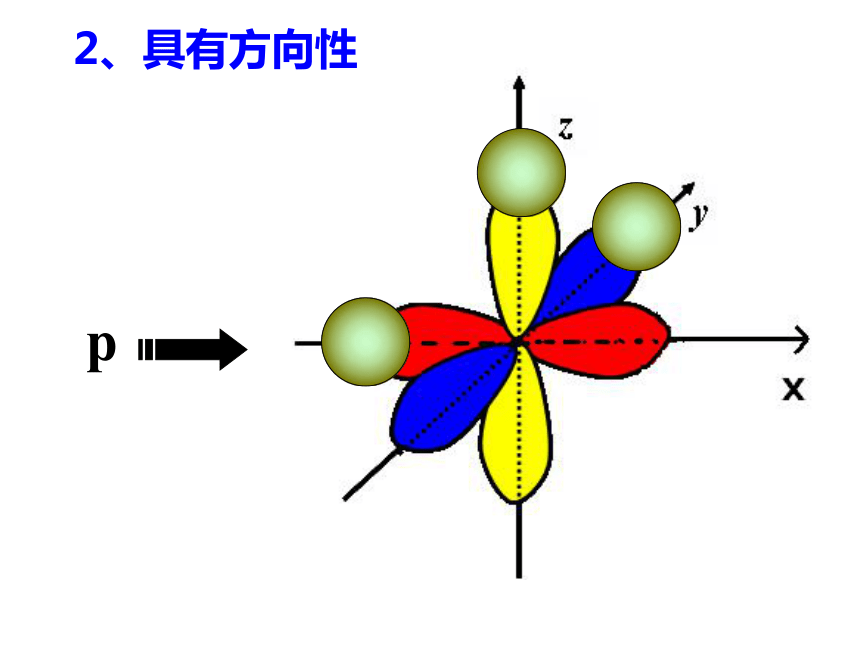
2、具有方向性
p
氮气的化学性质不活泼,通常难以与其他物质发生化学反应。请你写出氮分子的电子式和结构式,分析氮分子中氮原子的原子轨道是如何重叠形成共价键的,并与同学交流讨论。
z
z
y
y
x
σ
N
N
πz
πy
氮分子中原子轨道重叠方式示意图
(1)头碰头重叠——σ键
相互
靠拢
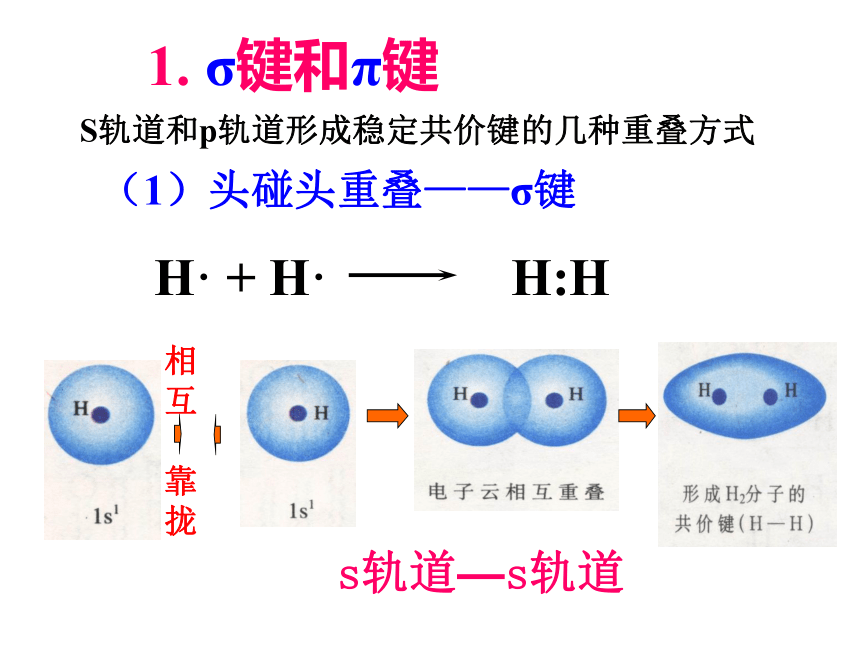
H· + H· H:H
s轨道—s轨道
S轨道和p轨道形成稳定共价键的几种重叠方式
1. σ键和π键
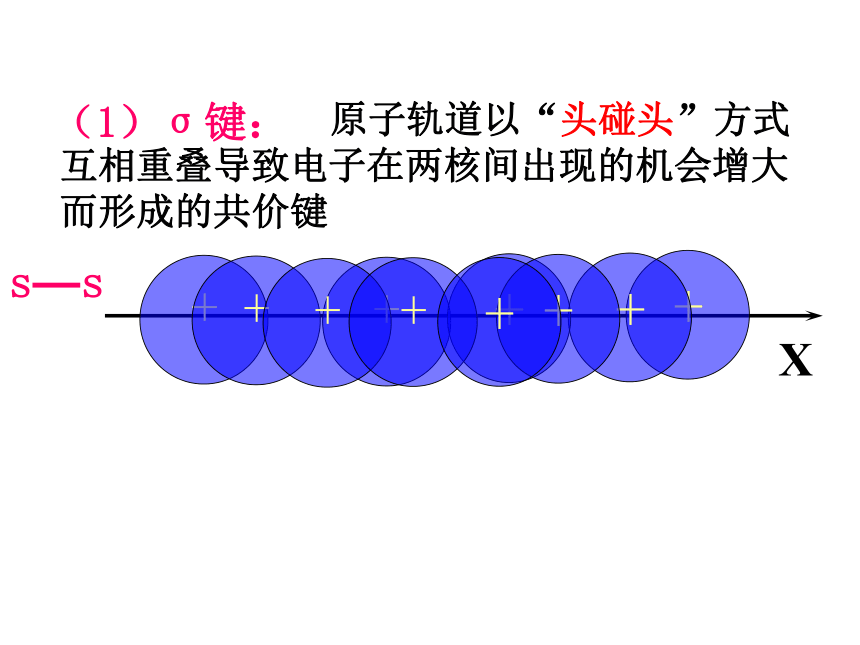
(1)σ键:
X
+
+
s—s
+
+
+
+
+
+
+
+
原子轨道以“头碰头”方式互相重叠导致电子在两核间出现的机会增大而形成的共价键
+
-
X
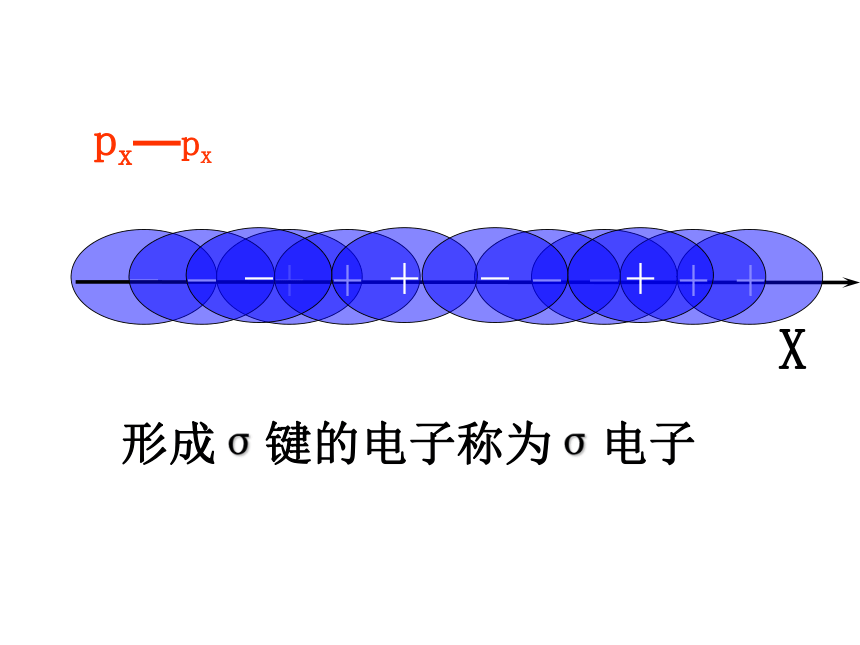
px—px
+
-
+
-
+
-
+
-
+
-
形成σ键的电子称为σ电子
px—px
+
Cl· + ·Cl Cl Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
X
+
+
-
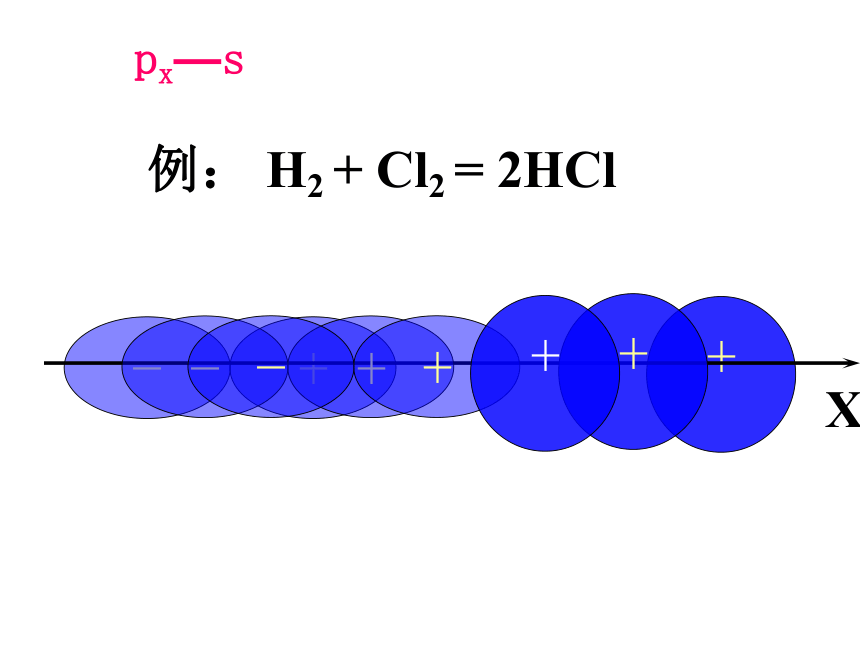
px—s
+
-
+
+
-
+
例: H2 + Cl2 = 2HCl
H· + ·Cl H Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
px — s
(2)π键:
原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的概率增大而形成的共价键
+
|
X
pZ—pZ
+
|
+
|
+
|
+
|
+
|
+
|
+
|
Z Z
σ键的类型
π键的类型
s—s(σ键)
px—px (σ键)
s—px (σ键)
pz—pz (π键)
py—py (π键)
小结:
σ 键与π键的比较
σ 键 π键
重叠方式
与单键、双键、三键的关系
牢固程度
“头碰头”重叠
肩并肩重叠
单键是σ键,双键、
三键中只有一个是
σ键
单键不可能是π键,
双键中有一个、三键
中有两个是π键
重叠程度较大,
比较牢固
重叠程度较小,
较易断裂
教科书 P42
请写出乙烯、乙炔与溴发生加成反应的反应方程式。并思考:在乙烯、乙炔和溴发生的加成反应中,乙烯、乙炔分子断裂什么类型的共价键?
乙烯分子中原子轨道重叠方式示意图
乙炔分子中轨道重叠方式示意图
有机物中的共价键
1、C – H 是σ键。
2、C—C 是σ键。
3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。
乙烷: 个σ键;乙烯: 个σ键 个π键;乙炔: 个σ键 个π键
7
5
1
3
2
请指出乙烷、乙烯、乙炔分子中存在哪些类型的共价键,分别有几个σ键,几个π键?
1.σ键的常见类型有(1)s-s, (2)s-px,
(3)px-px,请指出下列分子σ键所属类型:
A. HF
B. NH3
C. F2
D. H2
s-px
s-px
px-px
s-s
7
3
教科书P43
1. 根据氢原子和氟原子的核外电子排布,你知道F2和HF分子中形成的共价键有什么不同吗?
2. 根据元素电负性的强弱,你能判断F2和HF分子中共用电子对是否发生便移吗?
(1)非极性键:
两个成键原子吸引电子的能力 (电负性 ),共用电子对 偏移的共价键
相 同
不发生
相 同
(2)极性键:
两个成键原子吸引电子的能力 (电负性 ),共用电子对 偏移的共价键
不 同
发 生
不 同
2. 极性键和非极性键
氯氯键非极性键
氢氯键极性键
(3)一般情况下,同种元素的原子之间形成 共价键,不同种元素的原子之间形成 共价键。
非极性
极 性
(4)在极性共价键中,成键原子吸引电子能的差别越大,共用电子对的偏移程度 ,共价键的极性 。
越大
越 大
练 习
1. 下列分子中含有非极性键的共价化合物是 ( )
A. F2 B. C2H2 C. Na2O2 D. NH3 E. C2H6 F. H2O2
G. CO2
B.E.F
2.关于乙醇分子的说法正确的是( )
A. 分子中共含有8个极性键
B. 分子中不含非极性键
C. 分子中只含σ键
D. 分子中含有1个π键
C
3.下列分子中不含有π键的是( )
A. Na2O2 B. CaC2
C. F2 D. C6H6 E. 氯乙烯
练 习
A.C
4.下列物质分子中无π键的是 ( )
A. N2 B. O2 C. Cl2 D. C2H4
C
5. H2S分子中两个共价键的夹角接近90°,其原因是 ( )
A.共价键的饱和性 B.s原子电子排布
C.共价键的方向性 D.s原子中p轨道的形状
CD
在水溶液中,NH3能与H+结合生成NH4+请用电子式表示N和H形成NH3的过程并讨论NH3和H+是如何形成NH4+的
教科书 P44
氨分子中,氮原子和氢原子通过什么键结合?
极性共价键
写出氨分子的电子式和结构式。
﹕
H N
﹕
﹕
﹕
H
H
H﹣N
H
H
写出氨与盐酸反应的化学方程式和离子方程式。
NH3 + HCl = NH4Cl
NH3 + H+ = NH4+
氨分子中各原子均达稳定结构,为什么还
能与氢离子结合?
﹕
H N
﹕
﹕
﹕
H
H
H+
氮原子有孤对电子,氢离子有空轨道。
+
→
﹕
H N H
﹕
﹕
﹕
H
H
+
或
H-N →H
H
H
+
共用电子对全部由氮原子提供。
配 位 键
由一个原子提供孤对电子,另一个原子提
供空轨道形成的共价键称配位键。
氨根离子与水合氢离子等是通过配位键形成的。
H
﹕
﹕
H O
﹕
﹕
+
H+
+
H
﹕
﹕
H O
﹕
﹕
H
配位键用“→”表示,箭头指向接受孤对电子的原子。
如:
H
[H N H]+
H
铵根离子中的四个氮氢键完全一样(键长、键能相同)
小结:
极性键
单键
双键
三键
(1)按成键方式分
(2)按共用电子对有
无偏移分
(3)按两原子间的共用
电子对的数目分
2.一种特殊的共价键 --配位键
σ键:头碰头重叠
π键:肩并肩重叠
非极性键
(1)定义:
1.共价键
的类型
(3)配位键的存在
(2)配位键的成键条件
非极性键、极性键与配位键的比较
共
价
键 键 型 特 点 形成条件 示例
非极性键
极性键
配位键
共用电子对不
发生偏移
共用电子对
偏向一方原子
共用电子对
由一方提供
相同非金属元素原
子的电子配对成键
不同非金属元素原
子的电子配对成键
一方原子有孤电子对,另
一方原子有价层空轨道
H2
HCl
NH4+
已知水电离成为氢氧根离子和水合氢离子,试写出阳离子的结构。
H
[H O ]+
H
练 习
共价键的类型
z
z
y
y
x
σ
N
N
πz
πy
一、共价键
1、定义:
2、成键微粒:
3、成键本质:
4、成键原因:
原子间通过共用电子对所形成的的化学键。
原 子
共用电子对
不稳定要趋于稳定;体系能量降低
复习
5、成键的条件:
电负性相同或差值小的非金属原子之间且成键的原子
最外层未达到饱和状态,即成键原子有未成对电子。
二、共价键的形成本质
重叠
相反
未成对
共用电子对
增 加
降低
成键原子相互接近时,原子轨道发生 ,自
旋方向 的 电子形成 ,两原
子核间的电子密度 ,体系的能 。
三、共价键的特征
1、具有饱和性
形成的共价键数 = 未成对电子数
2、具有方向性
p
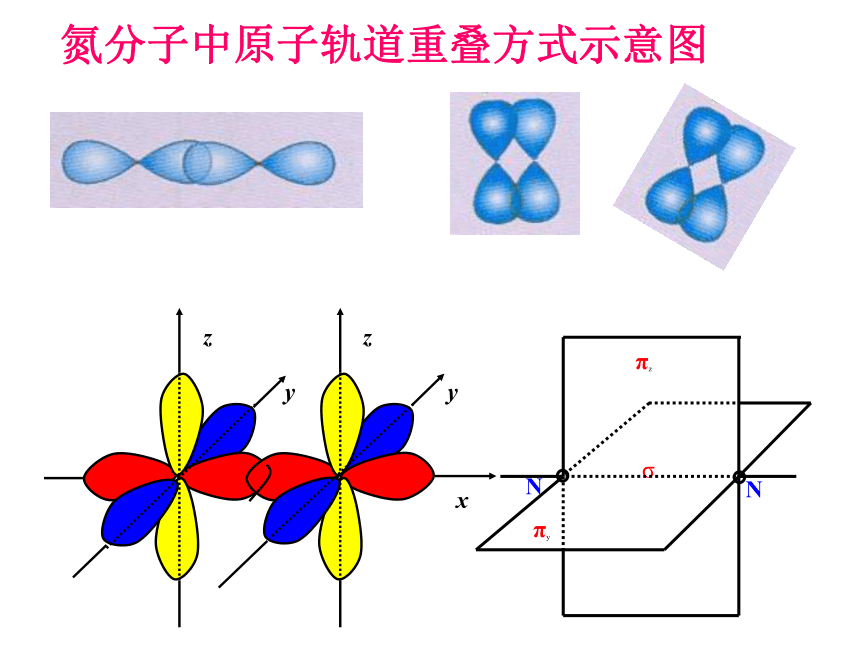
氮气的化学性质不活泼,通常难以与其他物质发生化学反应。请你写出氮分子的电子式和结构式,分析氮分子中氮原子的原子轨道是如何重叠形成共价键的,并与同学交流讨论。
z
z
y
y
x
σ
N
N
πz
πy
氮分子中原子轨道重叠方式示意图
(1)头碰头重叠——σ键
相互
靠拢
H· + H· H:H
s轨道—s轨道
S轨道和p轨道形成稳定共价键的几种重叠方式
1. σ键和π键
(1)σ键:
X
+
+
s—s
+
+
+
+
+
+
+
+
原子轨道以“头碰头”方式互相重叠导致电子在两核间出现的机会增大而形成的共价键
+
-
X
px—px
+
-
+
-
+
-
+
-
+
-
形成σ键的电子称为σ电子
px—px
+
Cl· + ·Cl Cl Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
X
+
+
-
px—s
+
-
+
+
-
+
例: H2 + Cl2 = 2HCl
H· + ·Cl H Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
px — s
(2)π键:
原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的概率增大而形成的共价键
+
|
X
pZ—pZ
+
|
+
|
+
|
+
|
+
|
+
|
+
|
Z Z
σ键的类型
π键的类型
s—s(σ键)
px—px (σ键)
s—px (σ键)
pz—pz (π键)
py—py (π键)
小结:
σ 键与π键的比较
σ 键 π键
重叠方式
与单键、双键、三键的关系
牢固程度
“头碰头”重叠
肩并肩重叠
单键是σ键,双键、
三键中只有一个是
σ键
单键不可能是π键,
双键中有一个、三键
中有两个是π键
重叠程度较大,
比较牢固
重叠程度较小,
较易断裂
教科书 P42
请写出乙烯、乙炔与溴发生加成反应的反应方程式。并思考:在乙烯、乙炔和溴发生的加成反应中,乙烯、乙炔分子断裂什么类型的共价键?
乙烯分子中原子轨道重叠方式示意图
乙炔分子中轨道重叠方式示意图
有机物中的共价键
1、C – H 是σ键。
2、C—C 是σ键。
3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。
乙烷: 个σ键;乙烯: 个σ键 个π键;乙炔: 个σ键 个π键
7
5
1
3
2
请指出乙烷、乙烯、乙炔分子中存在哪些类型的共价键,分别有几个σ键,几个π键?
1.σ键的常见类型有(1)s-s, (2)s-px,
(3)px-px,请指出下列分子σ键所属类型:
A. HF
B. NH3
C. F2
D. H2
s-px
s-px
px-px
s-s
7
3
教科书P43
1. 根据氢原子和氟原子的核外电子排布,你知道F2和HF分子中形成的共价键有什么不同吗?
2. 根据元素电负性的强弱,你能判断F2和HF分子中共用电子对是否发生便移吗?
(1)非极性键:
两个成键原子吸引电子的能力 (电负性 ),共用电子对 偏移的共价键
相 同
不发生
相 同
(2)极性键:
两个成键原子吸引电子的能力 (电负性 ),共用电子对 偏移的共价键
不 同
发 生
不 同
2. 极性键和非极性键
氯氯键非极性键
氢氯键极性键
(3)一般情况下,同种元素的原子之间形成 共价键,不同种元素的原子之间形成 共价键。
非极性
极 性
(4)在极性共价键中,成键原子吸引电子能的差别越大,共用电子对的偏移程度 ,共价键的极性 。
越大
越 大
练 习
1. 下列分子中含有非极性键的共价化合物是 ( )
A. F2 B. C2H2 C. Na2O2 D. NH3 E. C2H6 F. H2O2
G. CO2
B.E.F
2.关于乙醇分子的说法正确的是( )
A. 分子中共含有8个极性键
B. 分子中不含非极性键
C. 分子中只含σ键
D. 分子中含有1个π键
C
3.下列分子中不含有π键的是( )
A. Na2O2 B. CaC2
C. F2 D. C6H6 E. 氯乙烯
练 习
A.C
4.下列物质分子中无π键的是 ( )
A. N2 B. O2 C. Cl2 D. C2H4
C
5. H2S分子中两个共价键的夹角接近90°,其原因是 ( )
A.共价键的饱和性 B.s原子电子排布
C.共价键的方向性 D.s原子中p轨道的形状
CD
在水溶液中,NH3能与H+结合生成NH4+请用电子式表示N和H形成NH3的过程并讨论NH3和H+是如何形成NH4+的
教科书 P44
氨分子中,氮原子和氢原子通过什么键结合?
极性共价键
写出氨分子的电子式和结构式。
﹕
H N
﹕
﹕
﹕
H
H
H﹣N
H
H
写出氨与盐酸反应的化学方程式和离子方程式。
NH3 + HCl = NH4Cl
NH3 + H+ = NH4+
氨分子中各原子均达稳定结构,为什么还
能与氢离子结合?
﹕
H N
﹕
﹕
﹕
H
H
H+
氮原子有孤对电子,氢离子有空轨道。
+
→
﹕
H N H
﹕
﹕
﹕
H
H
+
或
H-N →H
H
H
+
共用电子对全部由氮原子提供。
配 位 键
由一个原子提供孤对电子,另一个原子提
供空轨道形成的共价键称配位键。
氨根离子与水合氢离子等是通过配位键形成的。
H
﹕
﹕
H O
﹕
﹕
+
H+
+
H
﹕
﹕
H O
﹕
﹕
H
配位键用“→”表示,箭头指向接受孤对电子的原子。
如:
H
[H N H]+
H
铵根离子中的四个氮氢键完全一样(键长、键能相同)
小结:
极性键
单键
双键
三键
(1)按成键方式分
(2)按共用电子对有
无偏移分
(3)按两原子间的共用
电子对的数目分
2.一种特殊的共价键 --配位键
σ键:头碰头重叠
π键:肩并肩重叠
非极性键
(1)定义:
1.共价键
的类型
(3)配位键的存在
(2)配位键的成键条件
非极性键、极性键与配位键的比较
共
价
键 键 型 特 点 形成条件 示例
非极性键
极性键
配位键
共用电子对不
发生偏移
共用电子对
偏向一方原子
共用电子对
由一方提供
相同非金属元素原
子的电子配对成键
不同非金属元素原
子的电子配对成键
一方原子有孤电子对,另
一方原子有价层空轨道
H2
HCl
NH4+
已知水电离成为氢氧根离子和水合氢离子,试写出阳离子的结构。
H
[H O ]+
H
练 习
