《离子键 离子晶体》教学课件
图片预览


文档简介
课件26张PPT。选修3专题3第二单元
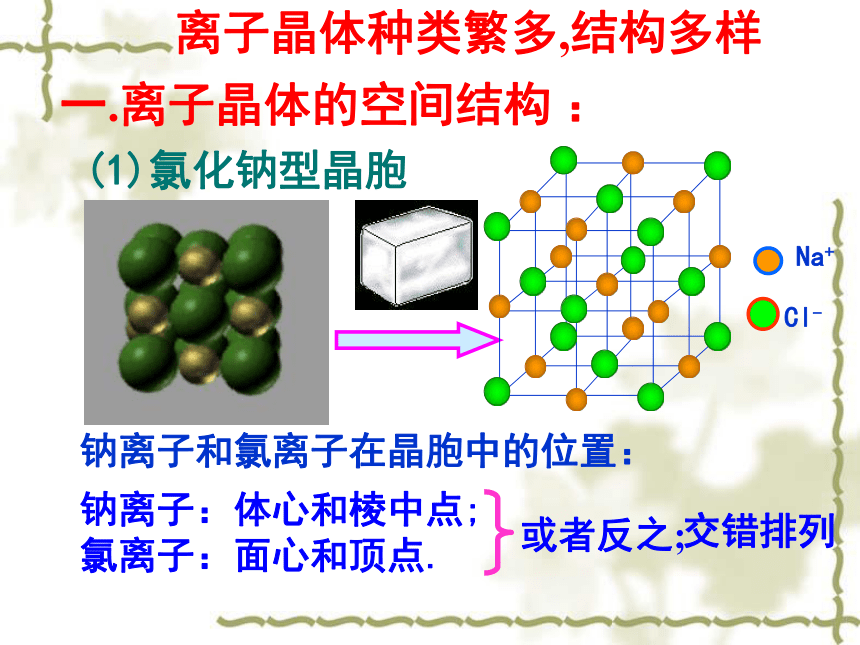
离子键 离子晶体(第二课时) 钠离子和氯离子在晶胞中的位置:一.离子晶体的空间结构 :(1)氯化钠型晶胞钠离子:体心和棱中点;
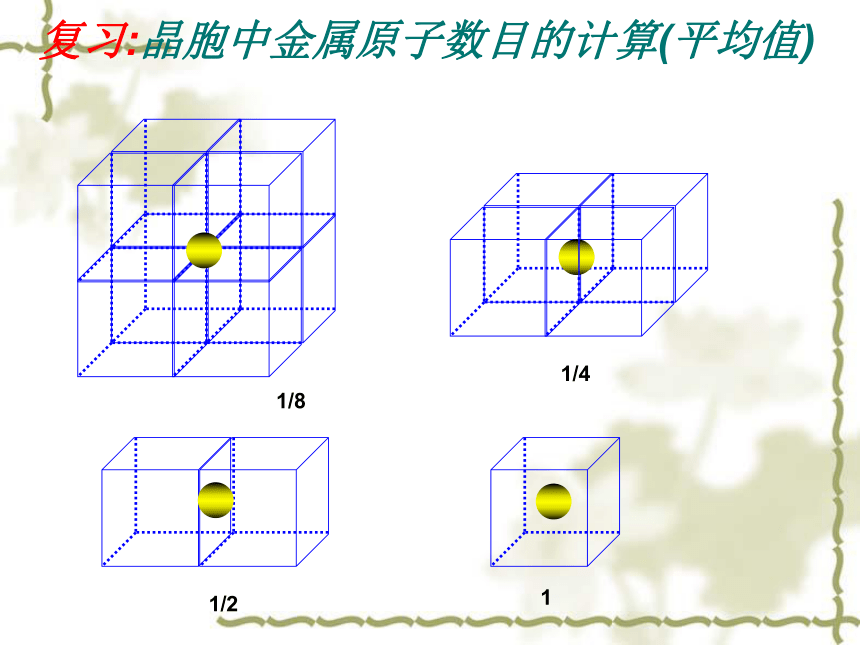
氯离子:面心和顶点.离子晶体种类繁多,结构多样或者反之;交错排列复习:晶胞中金属原子数目的计算(平均值)1/81/41/21计算方法:均摊法
顶点占1/8;棱占1/4;面心占1/2;体心占1 每个NaCl晶胞含Na+、Cl-的个数?Na+:Cl-:(2)CsCl晶胞铯离子和氯离子的位置?铯离子:
氯离子:P36问题解决1:每个晶胞含铯离子、氯离子的个数?铯离子:
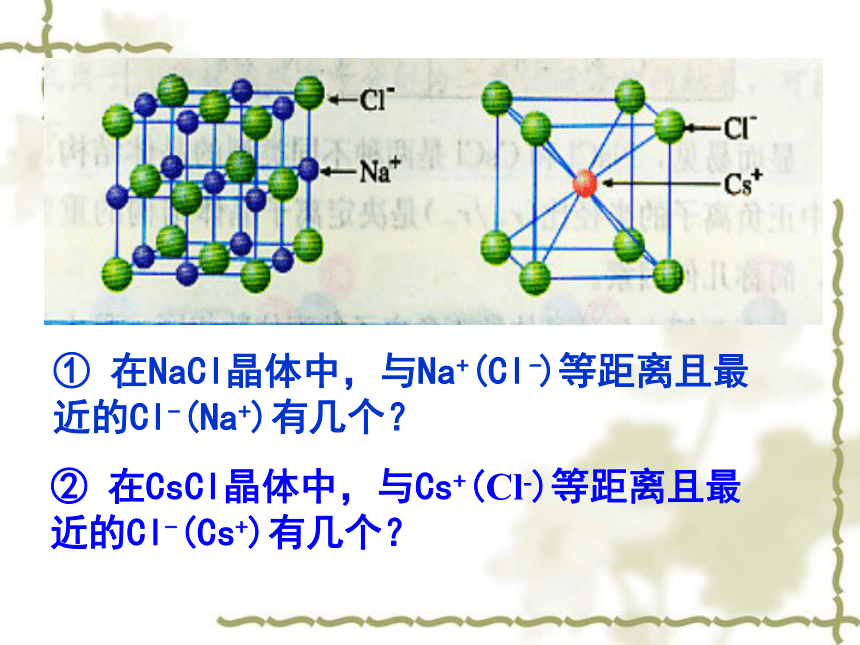
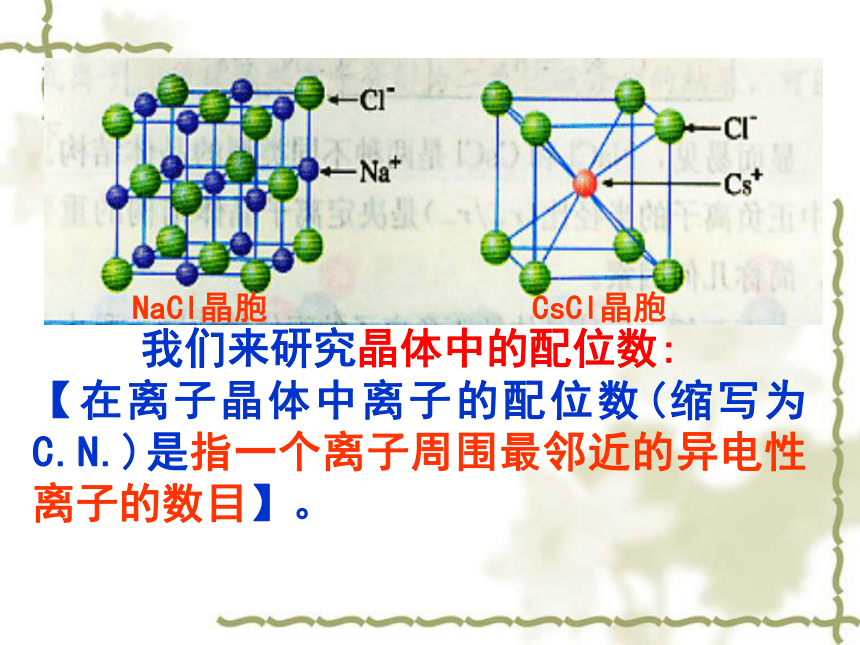
氯离子:或者反之1个;1个。体心顶点Cl-Cs+① 在NaCl晶体中,与Na+(Cl-)等距离且最近的Cl-(Na+)有几个?② 在CsCl晶体中,与Cs+(Cl-)等距离且最近的Cl-(Cs+)有几个? 我们来研究晶体中的配位数:
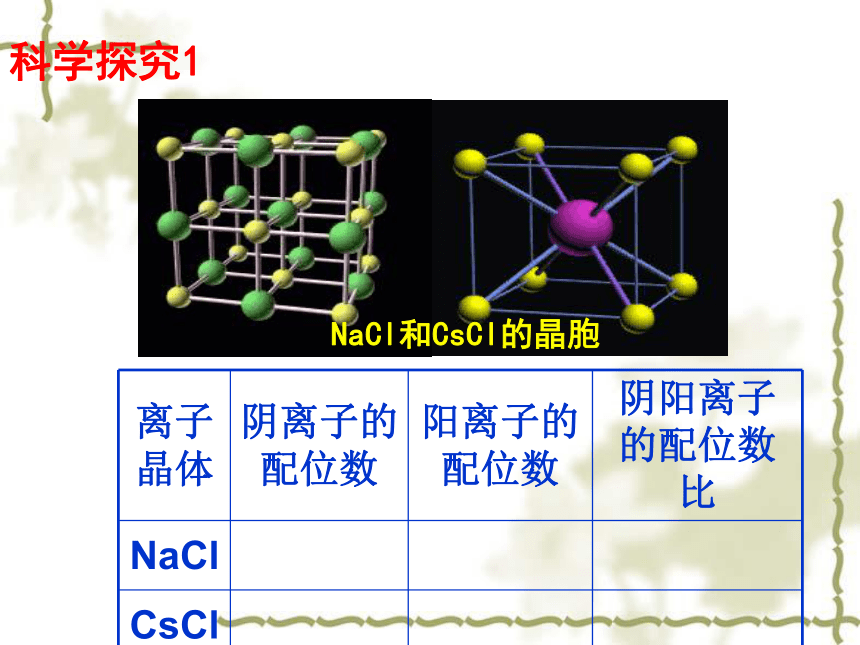
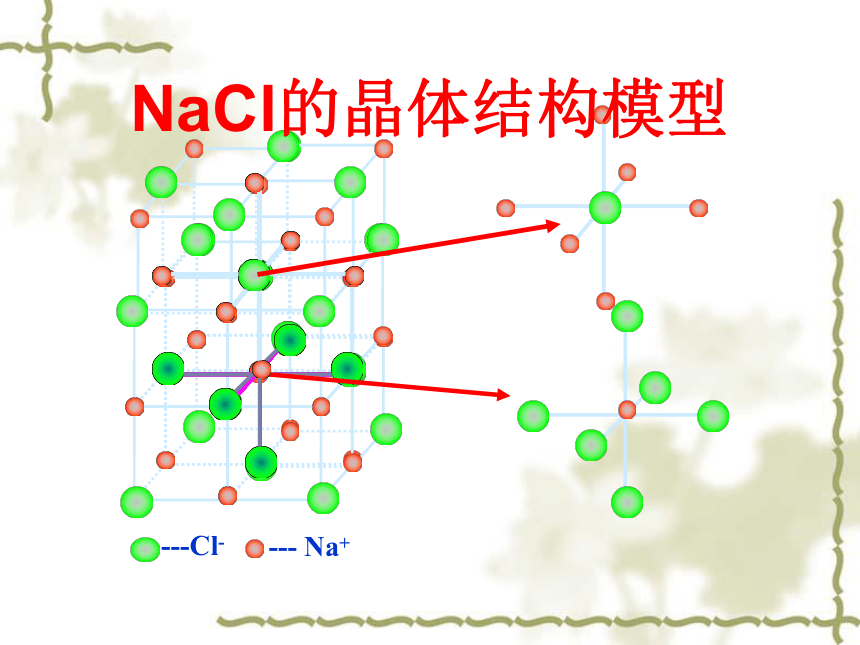
【在离子晶体中离子的配位数(缩写为C.N.)是指一个离子周围最邻近的异电性离子的数目】。NaCl和CsCl的晶胞科学探究1NaCl的晶体结构模型NaCl晶体中阴、阳离子的配位数Na+的配位数为:Cl-的配位数为:66CsCl的晶体结构及晶胞构示意图Cs+的配位数为:Cl-的配位数为:88661:1881:1科学探究1:找出NaCl、CsCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?小结:1、每个Na+同时吸引 个 Cl-,每个Cl-同时吸引 个Na+,而Na+数目与Cl-数目之比为 化学式为 2、根据氯化钠的结构模型确定晶胞,并分析其构成。每个晶胞中有 Na+,有 个Cl-3、在每个Na+周围与它最近的且距离相等的Na+有 个661:1NaCl4412小结1、每个Cs+同时吸引 个 Cl-,每个Cl-同时吸引 个Cs+,而Cs+数目与Cl-数目之为 化学式为 2、根据氯化铯的结构模型确定晶胞,并分析其构成。每个晶胞中有 Cs+,
有 个Cl-
3、在每个Cs+周围与它最近的且距离相等的Cs+有 个881:1CsCl116ZnS的晶体结构示意图 根据硫化锌的结构模型确定晶胞,并分析其构成。每个晶胞中有 个Zn2+,
有 个S2-
44 氯化钠与氯化铯均为AB型离子晶体,但两者的阴、阳离子周围带相反电荷离子的数目却不同,你认为造成这一差异的可能原因是什么? 二.离子晶体的配位数以及与 r+/r- 的关系 NaCl 六配体, CsCl八配体, 均为AB型晶体, 为何配位数不同? (1) 离子晶体稳定存在的条件离子形成晶体时,阴、阳离子总是尽可能紧密地排列,且一种离子周围所环绕的带相反电荷的离子越多,体系能量越低,所构成的离子晶体就越稳定。 (2)离子晶体的配为数:离子晶体中一种离子周围紧邻的带相反电荷的离子数目 离子晶体中的离子的电荷分布是球形对称的。它们之间的作用力的强弱只取决于它们相互之间的距离。晶体中每种离子能被多少个带相反电荷的离子所包围(离子的配位数),与它们的大小有关,与电荷数多少无关。科学探究2:根据表P383—3分析,你能得出影响离子晶体中离子配位数的什么因素?结论:
晶体中正负离子的的半径比(r+/r-)是决定离子晶体结构的重要因素,
(3)r+/r-与配位数 一般决定配位数的多少:正负离子的半径比越大,配位数越多.CaF2 (萤石)型晶胞①Ca2+的配位数:②F-的配位数:(1)立方晶系,面心立方晶胞。(2) Ca2+立方最密堆积,F-填充在全部 四面体空隙中。(3)配位数4个Ca2+和8个F-CaF2晶体中Ca2+ 和F-的位置关系如何?一个CaF2晶胞中含Ca2+ 、F-个数是多少?841.某离子晶体的结构(局部如图),X位于立方体的顶点,Y位于立方体的中心,则该晶体的化学式是X :Y= 1/8×4 : 1= 1 : 2(XY2)?
2.如右下图所示是NaCl晶胞结构示意图,请回答:
(1)???? 与某个Na+离子距
离最近的Na+离子共有
个,
(2) 这些Na+离子中心
围成的空间几何图形是
_____________。12十四面体?
3 若已知NaCl的摩尔质量为 M g/mol
晶胞的边长为a cm,设阿伏加德常数为
NA,则NaCl晶体的密度为: g/cm3
————。 晶胞法:小立方体法: 4. 如图直线交点处的圆圈为NaCl晶体中Na+或Cl-所处位置,晶体中,每个Na+周围与它最接近的且距离相等的Na+个数为:____125. 如图所示,在氯化钠晶体中,与
每个Na+等距离且最近的几个Cl-
所围 成的空间几何构型( )
A. 十二面体 B. 正八面体
C. 正六面体 D. 正四面体B谢谢!再见!
离子键 离子晶体(第二课时) 钠离子和氯离子在晶胞中的位置:一.离子晶体的空间结构 :(1)氯化钠型晶胞钠离子:体心和棱中点;
氯离子:面心和顶点.离子晶体种类繁多,结构多样或者反之;交错排列复习:晶胞中金属原子数目的计算(平均值)1/81/41/21计算方法:均摊法
顶点占1/8;棱占1/4;面心占1/2;体心占1 每个NaCl晶胞含Na+、Cl-的个数?Na+:Cl-:(2)CsCl晶胞铯离子和氯离子的位置?铯离子:
氯离子:P36问题解决1:每个晶胞含铯离子、氯离子的个数?铯离子:
氯离子:或者反之1个;1个。体心顶点Cl-Cs+① 在NaCl晶体中,与Na+(Cl-)等距离且最近的Cl-(Na+)有几个?② 在CsCl晶体中,与Cs+(Cl-)等距离且最近的Cl-(Cs+)有几个? 我们来研究晶体中的配位数:
【在离子晶体中离子的配位数(缩写为C.N.)是指一个离子周围最邻近的异电性离子的数目】。NaCl和CsCl的晶胞科学探究1NaCl的晶体结构模型NaCl晶体中阴、阳离子的配位数Na+的配位数为:Cl-的配位数为:66CsCl的晶体结构及晶胞构示意图Cs+的配位数为:Cl-的配位数为:88661:1881:1科学探究1:找出NaCl、CsCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?小结:1、每个Na+同时吸引 个 Cl-,每个Cl-同时吸引 个Na+,而Na+数目与Cl-数目之比为 化学式为 2、根据氯化钠的结构模型确定晶胞,并分析其构成。每个晶胞中有 Na+,有 个Cl-3、在每个Na+周围与它最近的且距离相等的Na+有 个661:1NaCl4412小结1、每个Cs+同时吸引 个 Cl-,每个Cl-同时吸引 个Cs+,而Cs+数目与Cl-数目之为 化学式为 2、根据氯化铯的结构模型确定晶胞,并分析其构成。每个晶胞中有 Cs+,
有 个Cl-
3、在每个Cs+周围与它最近的且距离相等的Cs+有 个881:1CsCl116ZnS的晶体结构示意图 根据硫化锌的结构模型确定晶胞,并分析其构成。每个晶胞中有 个Zn2+,
有 个S2-
44 氯化钠与氯化铯均为AB型离子晶体,但两者的阴、阳离子周围带相反电荷离子的数目却不同,你认为造成这一差异的可能原因是什么? 二.离子晶体的配位数以及与 r+/r- 的关系 NaCl 六配体, CsCl八配体, 均为AB型晶体, 为何配位数不同? (1) 离子晶体稳定存在的条件离子形成晶体时,阴、阳离子总是尽可能紧密地排列,且一种离子周围所环绕的带相反电荷的离子越多,体系能量越低,所构成的离子晶体就越稳定。 (2)离子晶体的配为数:离子晶体中一种离子周围紧邻的带相反电荷的离子数目 离子晶体中的离子的电荷分布是球形对称的。它们之间的作用力的强弱只取决于它们相互之间的距离。晶体中每种离子能被多少个带相反电荷的离子所包围(离子的配位数),与它们的大小有关,与电荷数多少无关。科学探究2:根据表P383—3分析,你能得出影响离子晶体中离子配位数的什么因素?结论:
晶体中正负离子的的半径比(r+/r-)是决定离子晶体结构的重要因素,
(3)r+/r-与配位数 一般决定配位数的多少:正负离子的半径比越大,配位数越多.CaF2 (萤石)型晶胞①Ca2+的配位数:②F-的配位数:(1)立方晶系,面心立方晶胞。(2) Ca2+立方最密堆积,F-填充在全部 四面体空隙中。(3)配位数4个Ca2+和8个F-CaF2晶体中Ca2+ 和F-的位置关系如何?一个CaF2晶胞中含Ca2+ 、F-个数是多少?841.某离子晶体的结构(局部如图),X位于立方体的顶点,Y位于立方体的中心,则该晶体的化学式是X :Y= 1/8×4 : 1= 1 : 2(XY2)?
2.如右下图所示是NaCl晶胞结构示意图,请回答:
(1)???? 与某个Na+离子距
离最近的Na+离子共有
个,
(2) 这些Na+离子中心
围成的空间几何图形是
_____________。12十四面体?
3 若已知NaCl的摩尔质量为 M g/mol
晶胞的边长为a cm,设阿伏加德常数为
NA,则NaCl晶体的密度为: g/cm3
————。 晶胞法:小立方体法: 4. 如图直线交点处的圆圈为NaCl晶体中Na+或Cl-所处位置,晶体中,每个Na+周围与它最接近的且距离相等的Na+个数为:____125. 如图所示,在氯化钠晶体中,与
每个Na+等距离且最近的几个Cl-
所围 成的空间几何构型( )
A. 十二面体 B. 正八面体
C. 正六面体 D. 正四面体B谢谢!再见!
