《海水的综合利用之镁的提
图片预览








文档简介
(共54张PPT)
镁的提取及应用
专题2 从海水中获得的化学物质
导弹
镁的广泛应用
镁在自然界中存在形式
菱镁矿(主要含MgCO3)
白云石
(主要含CaCO3·MgCO3)
镁橄榄石
(主要含Mg2SiO4)
——化合态
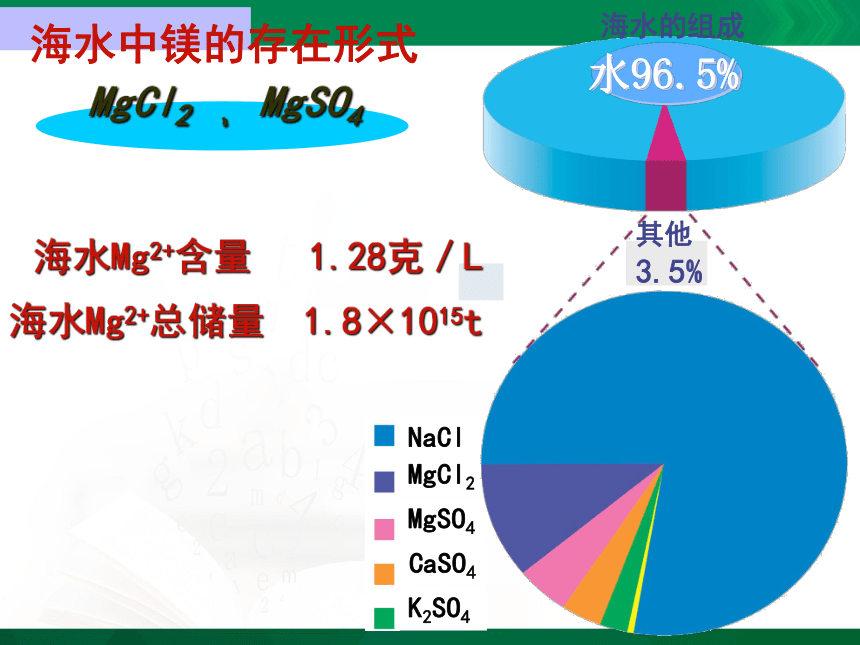
海水中镁的存在形式
NaCl
MgCl2
MgSO4
CaSO4
K2SO4
水96.5%
其他3.5%
海水的组成
MgCl2 、 MgSO4
海水Mg2+含量 1.28克/L
海水Mg2+总储量 1.8×1015t
想一想:要使海水中的镁转化为金属镁,镁元素的化合价如何变化,发生什么反应
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
热分解法
热还原法
电解法
还原金属的常用方法
(1)热分解法:适用于还原金属活动性较差的金属,如Hg与Ag.这些金属的化合物不稳定,加热即分解成金属单质。如:2HgO==2Hg + O2↑
(2)热还原法:用于金属活动性介于Zn~Cu之间的多数金属.是用还原剂(如C、CO、H2等)还原金属氧化物.如: Fe2O3+3CO === 2Fe+3CO2
(3)电解法:适用于金属活动性顺序中排在Al前的金属,由于这些金属很活泼,对应的化合物很稳定,只能靠电分解其熔融态的化合物来还原。如:2NaCl(熔融) === 2Na + Cl2↑
资料卡
高温
电解
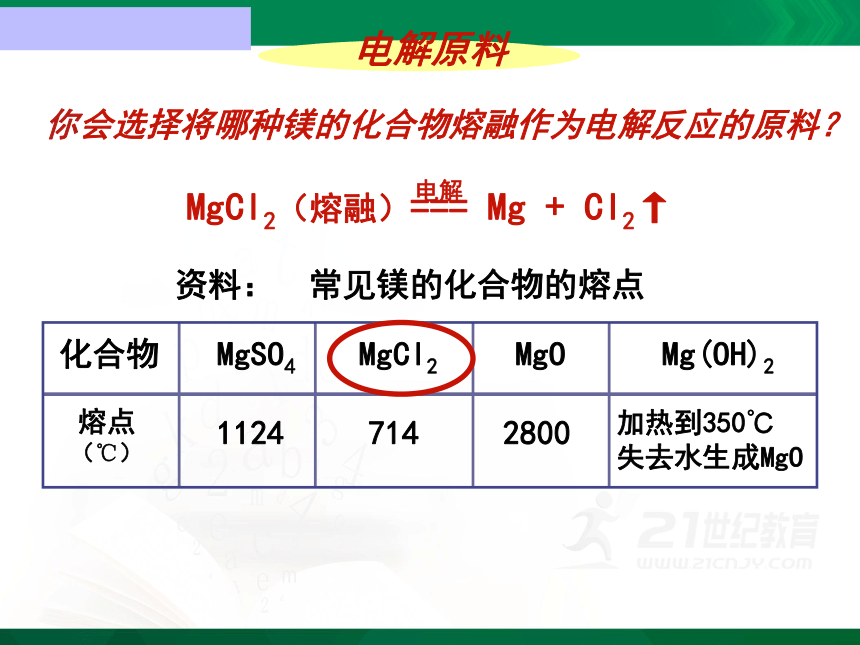
资料: 常见镁的化合物的熔点
熔点
(℃)
1124
714
2800
加热到350℃
失去水生成MgO
Mg(OH)2
MgO
MgCl2
MgSO4
化合物
MgCl2(熔融)=== Mg + Cl2↑
电解
电解原料
你会选择将哪种镁的化合物熔融作为电解反应的原料?
Mg+Cl2= MgCl2
点 燃
2Mg+CO2=2MgO+C
点燃
2Mg+O2=2MgO
点燃
3Mg+N2= Mg3N2
点燃
电解制镁要在隔绝空气
的环境中
两极产物应设法隔离
Cl2有毒应设置专用管道
收集
电解装置
电池
电极
熔融态MgCl2
(提示:生成的镁浮在熔融盐上 )
某同学设计了电解法制镁的简易装置,你能根据
Mg及Cl2的性质指出该设计的不足之处及如何改进?
海水
碱
Mg(OH)2
HCl
MgCl2液
无水MgCl2
卤水
MgCl2+2NaOH = Mg(OH)2 + 2NaCl
Mg(OH)2+2HCl = MgCl2 + 2H2O
Mg2+ + 2OH- == Mg(OH)2
Mg(OH)2+ 2H+ == Mg2+ + 2H2O
从海水中提取MgCl2
海水
无水MgCl2
海水中Mg2+浓度小而且混杂大量的Na+、Cl-等离子,
根据这一特点,请设计以海水为原料提取MgCl2的方案。
(已知: Mg(OH)2难溶于水)
试剂 氢氧化钾 氢氧化钠 氢氧化钙 氢氧化钡
价格(元/吨) 7160 2700 850 4700
资料: 常见强碱的最新市价
CaCO3
CaO
Ca(OH)2
碱的选择
CaCO3 === CaO + CO2
锻烧
CaO+H2O == Ca(OH)2
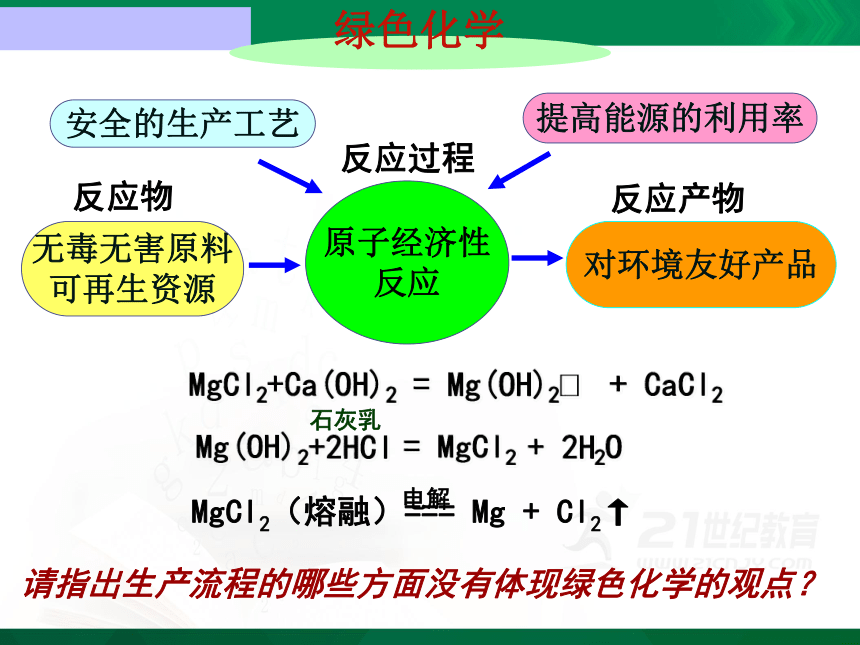
原子经济性 反应
安全的生产工艺
提高能源的利用率
无毒无害原料 可再生资源
对环境友好产品
反应物
反应过程
反应产物
绿色化学
Mg(OH)2+2HCl = MgCl2 + 2H2O
MgCl2(熔融)=== Mg + Cl2↑
电解
MgCl2+Ca(OH)2 = Mg(OH)2 + CaCl2
石灰乳
请指出生产流程的哪些方面没有体现绿色化学的观点?
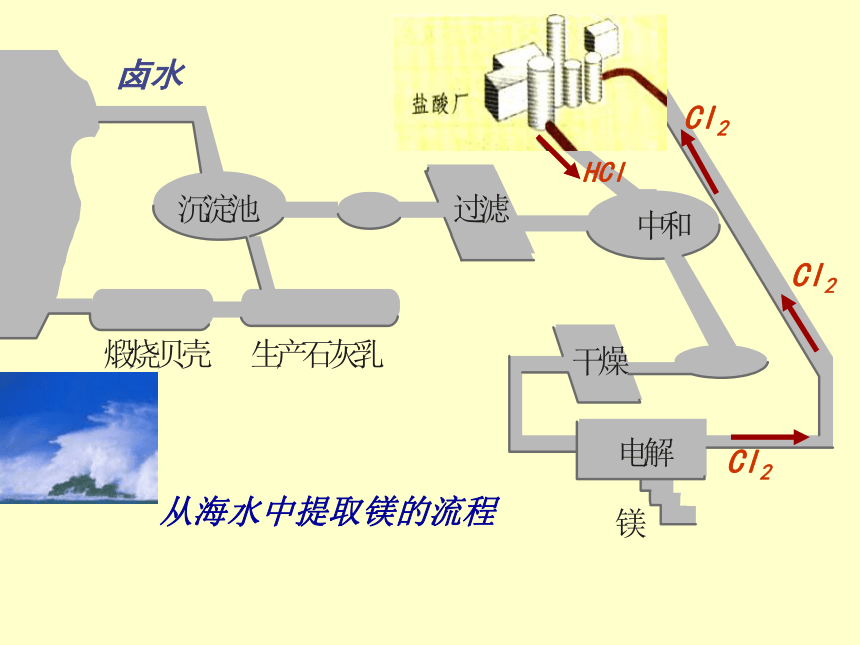
卤水
从海水中提取镁的流程
Cl2
Cl2
Cl2
HCl
专题回顾
NaCl
苦卤(含Mg2+、Br-等)
海水
电解熔融盐
Na
Cl2
H2
NaOH
HCl
Mg
Cl2
Mg(OH)2
MgCl2
电解
Br- 等
Br2
电解水溶液
让我们一起努力学习知识
利用好我们的资源
建设好我们的家园
教师寄语:
你能从“绿色化学”的概念出发为海峡西岸经济区的建设设计一座多功能的海水提炼厂吗?请用箭头、方框画出简易流程图。
你的收获
表:卤水中主要离子浓度
验证Mg2+的分离
桌面上的NaCl、MgCl2、KCl、CaCl2溶液分别模
拟卤水中的四种主要成分,请你设计实验方案验证
Mg2+的分离,并完成设计的验证实验。
Mg2+的分离:
加入碱后只有Mg2+沉淀,而其它阳离子不沉淀
卤水中
主要的四种成分 NaCl
溶液 MgCl2
溶液 KCl
溶液 CaCl2
溶液
滴加NaOH溶液
白色沉淀
无现象
无现象
无明显
现象
Mg2+ + 2OH- == Mg(OH)2
海水
镁在海水中含量很高,仅次于氯和钠,居第3位。
溴的浓度较高,平均为67×10-3 mL/L,地球上99%以上的溴都储存在海水里,故溴有“海洋元素”之称。
碘在海水中的浓度只有0.06× 10-6,属于微量元素。
钾在海水中的总量为500 ×1012 t以上。海水中所含钾的储量远远超过钾盐矿物储量。
铀海水中的总量非常可观,达45×108 t,相当于陆地储量的4500倍。
一吨海水中所含重水的核聚变反应,可释放出相当于256t石油燃烧所产生的能量。
重水核聚变反应可释放出相当能量,海水中约有200×108 t重水。
提取
海水提取镁的工艺流程图
卤水
你能从“绿色化学”的概念出发为海峡西岸经济区的建设设计一座海水炼镁厂吗?请用箭头、方框画出简易流程图。
原子经济性 反应
安全的生产工艺
提高能源的利用率
无毒无害原料 可再生资源
对环境友好产品
反应物
反应过程
反应产物
“绿色化学”的概念
绿色化学
你能指出在海水提取镁的生产过程中的优点吗?它体现了怎样的化学观点?
2. 绿色化学
绿色化学是一种以保护环境为目标来设计、生产化学产品的一门新兴学科,是一门从源头阻止污染的化学。
原料的绿色化
☆无毒、无害原料
☆可再生资源为原料
化学反应的绿色化
☆“原子经济性”反应
☆提高反应的选择性
产品的绿色化
催化剂的绿色化
☆无毒、无害催化剂
溶剂的绿色化
☆无毒、无害溶剂
绿色化学示意图
化学核心知识
(8)绿色化学
采用无毒无害的原料;
在无毒的反应条件下进行;
产品对环境友好;
具有“原子经济性” ;
满足“价廉物美”的传统原则。
含有的
主要离子 g/L
海水
Cl- 19.354
Na+ 10.773
Mg2+ 1.292
SO42- 2.712
Ca2+ 0.412
K+ 0.399
绿色化学
传统的化学工业给环境带来的污染已十分严重,目前世界每年产生的有害废物达3亿吨~4亿吨,给环境造成危害,并威胁着人类的生存。有识之士提出了绿色化学的号召,并立即得到了全世界的积极响应。
绿色化学的核心就是要利用化学原理从源头减少和消除工业生产对环境的污染。
绿色化学提倡原子经济性,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,原子利用率为100%
绿色化学又称环境友好化学,清洁化学环境无害化学,它的主要特点是:
1.充分利用资源和能源,采用无毒、无害的原料;
2.在无毒、无害的条件下进行反应,以减少废物向环境排放;
3.提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”;
4.生产出有利于环境保护、社区安全和人体健康的环境友好的产品。
绿色化学给化学家提出了一项新的挑战,国际上对此很重视。1996年,美国设立了“绿色化学挑战奖”,以表彰那些在绿色化学领域中做出杰出成就的企业和科学家。绿色化学将使化学工业改变面貌,为子孙后代造福。
(二)、海水中提取镁
如何从海水晒盐的“苦卤”中提取纯净的MgCl2并制取Mg单质
CaCO3 === CaO + CO2
Mg(OH)2+2HCl=MgCl2+2H2O
Mg2++CaO+H2O=Mg(OH)2 +Ca2+
MgCl2+6H2O=MgCl2 6H2O
MgCl2 6H2O=MgCl2+6H2O(一定条件)
MgCl2(熔融) === Mg + Cl2
电解
高温
每升海水中Mg2+仅1.29克
但总储量高达1.8×1015 t
NaCl 77.75%
MgCl2 10.88%
MgSO4 4.74%
CaSO4 3.60%
K2SO4 2.46%
含有的
主要离子 g/L
海水
Cl- 19.354
Na+ 10.773
Mg2+ 1.292
SO42- 2.712
Ca2+ 0.412
K+ 0.399
每升海水中Mg2+仅1.29克
但总储量高达1.8×1015t
高中化学应当学习的基础核心知识—支撑化学学科体系与发展的知识
物质由元素组成,元素周期表揭示了元素之间存在内在联系。周期表是对化学研究基本成果最简洁的记录,为我们提供极为丰富的化学信息。
物质由原子、分子等微粒构成的。微粒不仅是抽象的模型,还是实实在在的客体。
物质结构具有复杂性与隐蔽性,结构有层次性,层次间存在关联性。
物质性质、变化的多样性;化学反应是化学研究的中心问题,化学反应类型多样、反应及机理十分复杂,对反应条件十分敏感,反应伴随能量与混乱度的变化。实现化学反应的关键是使用催化剂提高反应速率。
实现绿色化学--采用无毒无害的原料、在无毒的反应条件下进行、产品对环境友好、具有“原子经济性”、满足“价廉物美”的传统原则。
化工生产要考虑以下几个方面:
化学反应原理
原料成本
经济效益
对环境的影响
……
提示:
镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如下:(1)为了使MgCl2转化为Mg(OH)2,试剂①可选用______ _,要使MgCl2完全转化为沉淀,加入试剂①的量应__________,验证MgCl2已完全转化为Mg(OH)2的方法是__________; (2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_________________;
(3)试剂②可以选用____________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式:__________________________________。
Mg(OH)2
溶 液
MgCl2
溶 液
无 水
MgCl2
Mg
海水:
主要含
NaCl和MgCl2等
试剂①
试剂②
电解
熔融
绿色化学
原子经济性 反应
安全的生产工艺
提高能源的利用率
无毒无害原料 可再生资源
对环境友好产品
反应物
反应过程
反应产物
绿色化学概念
1、在2支小试管里分别加入2mLNaCl溶液MgCl2溶液,分别滴加
卤水中
主要的四种成分 NaCl
溶液 MgCl2
溶液 KCl
溶液 CaCl2
溶液
滴加NaOH溶液
含有的
主要离子 g/L
海水
Cl- 19.354
Na+ 10.773
Mg2+ 1.292
SO42- 2.712
Ca2+ 0.412
K+ 0.399
每升海水中Mg2+仅1.29克
但总储量高达1.8×1015 t
每升海水中Mg2+仅1.29克
但总储量高达1.8×1015 t
向模拟卤水中的四种成分分别滴加NaOH溶液
科学探究
从卤水中分离出Mg2+
在四支试管中分别加入适量氯化钠、氯化镁、氯化钙和氯化钾溶液,分别滴加氢氧化钠溶液。
NaCl溶液
MgCl2溶液
CaCl2溶液
KCl溶液
含有离子 g/L
海水
Cl- 19.35
Na+ 10.77
Mg2+ 1.29
SO42- 2.712
Ca2+ 0.412
K+ 0.399
5、绿色化学理念(预防优于治理)
核心:利用化学原理从源头上减少和消除工业生产对环境造成的污染。又称为“环境无害化学”、“环境友好化学”、“清洁化学”。
从学科观点看:是化学基础内容的更新。(改变反应历程)
从环境观点看:强调从源头上消除污染。(从一开始就避免污染物的产生)
从经济观点看:它提倡合理利用资源和能源,降低生产成本。(尽可能提高原子利用率)
热点:原子经济性——反应物原子全部转化为最终的期望产物,原子利用率为100%
元素 离子
形态 g/L
海水
氯 Cl- 19.354
钠 Na+ 10.77
镁 Mg2+ 1.29
硫 SO42- 2.712
钙 Ca2+ 0.412
钾 K+ 0.399
想一想:如何从海水中获得MgCl2
对金属而言:
越活泼的金属,越容易与其他物质形成化合物,也就越难从化合物中还原出金属单质.
越不活泼的金属, 越不容易与其他物质形成化合物,也就越容易从化合物中还原出金属单质.
石灰乳
HCl
电解
MgCl2
海水
Mg(OH)2
Mg
请根据你所了解的金属的制备方法,设
计一套以海水为原料制备金属镁的方案,并
请你用箭头、方框画出简易的流程图。
月球探测器
引海水渠道的闸门
海面
堤坝
贮水池
蒸发池
结晶池
盐田示意图
1、如何从海水中得到NaCl呢?
海水
盐田
粗盐
引入
风吹日晒
一、海水中盐的开发和利用
过滤,加盐酸 加热 电解
海水 母液 b c
煅烧 a 浓缩
贝壳 石灰乳
a ;
b ;
c 。
MgCl2溶液
[练习]根据讨论,在下列方框中填入合适的物质的化学式完成工业上用海水提镁的工艺流程,
并写出a、b、c三个步骤的化学方程式:
CaO
Mg(OH)2
MgCl2 6H2O
MgCl2
Mg
MgCl2+Ca(OH)2=Mg(OH)2 +CaCl2
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2(熔融) = Mg+Cl2
通电
3、从海水中提取金属镁的生产步骤有:①浓缩结晶,②加熟石灰,③加盐酸,④过滤,⑤熔融电解,正确的生产步骤是__________。
0
5
10
15
20
25
30
KCl
CaCl2
MgCl2
NaCl
0.721
1.11
5.11
27.2
含量/g
每千克海水中几种氯化物的含量
海水中镁的总储量约为1.8×1015 t
0
5
10
15
20
25
30
KCl
CaCl2
MgCl2
NaCl
0.721
1.11
5.11
27.2
含量/g
每千克海水中几种氯化物的含量
怎样把Mg2+从海水中分离出来?
在众多的自然资源中,海水是十分重要的资源之一。利用海水中富含的化学物质,如:NaCl、MgCl2、NaBr、NaI等,能获得获得的非金属单质Cl2、Br2、I2,如何从海水中获得这些物质呢
想一想:要使海水中的镁转化为金属Mg,镁元素的化合价如何变化,发生什么反应
一、海水的综合利用
(一)、氯化钠的提取与利用
1、如何从海水中提取粗盐?
粗盐的成分主要有哪些?
NaCl (泥沙、Ca2+ 、Mg2+ 、Fe3+、SO42-等)
海水晒盐
粗盐水
含少量Ca2+.Mg2+
精制盐水
2、粗盐的提纯与精制
请你设计实验分析如何从粗盐中提取精盐?
Ca2+ Mg2+ Na+ Cl-SO42-
过量Ba(OH)2
Mg(OH)2 BaSO4
Ca2+ Ba2+ Na+ Cl-OH-
过量Na2CO3
CaCO3 BaCO3
Na+ Cl-OH-CO32-
过量HCl
CO2
Na+ Cl-H+
方法一:加热
方法二:加NaOH,调节PH=7
精盐(NaCl)
从根本上解决环境和生态问题,还要依靠绿色化学的发展。绿色化学使人们可以期望未来的化工企业将是零排放的,所有物质原料、中间产物都在内部循环、利用,尽量不使用有毒、有强腐蚀性的原料。
6、阅读教材96页问题解决。比较两种途径,你认为哪种路线符合绿色化学的要求?这种方法的优点是什么?
后者,没有用氢氰酸极毒物,反应只要一步反应,转化率高,没有其他生成物。
绿色化学是设计没有或只有尽可能小的对环境产生负面影响的,并在技术、经济上可行的化学品和化学过程的科学。绿色化学的目的是用化学方法在化学过程中预防污染。绿色化学要求开发新的原子经济反应。原子经济性即在化学反应过程中有多少原料的原子进入到所需的产品中。理想的原子经济反应要求原料分子百分之百在转变成产物,不产生副产物或废物,实现废物的“零排放”。
离子交换膜电解槽的组成
将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)通过,而阻止阴离子(Cl-、OH-)和气体通过。可防止H2、Cl2混合爆炸,也可防止Cl2与NaOH反应。
阳离子交换膜的作用
(2)、制备钠
你能根据电解食盐水溶液的装置来设计工业制备钠的简易装置吗?
原理:2NaCl(熔融) === 2Na + Cl2↑
电解
(3)、侯氏制碱
侯氏制碱法的主要原理:在氨饱和的NaCl 溶液中通入二氧化碳气体,生成小苏打沉淀和氯化铵溶液
讨论、研究
通入氨气与二氧化碳的顺序能对调吗 为什么?
NaCl + NH3 + CO2 + H2O == NaHCO3 + NH4Cl
2NaHCO3 ===== Na2CO3+CO2 +H2O
加热
绿色化学
原子经济 性反应高 选择性
安全的生产工艺
提高能源的利用率
无毒无害原料 可再生资源
对环境友好产品
应用无毒无害的 催化剂
应用无毒无害的溶剂
反应物
反应过程
反应产物
绿色化学示意图
电解法
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
热还原法
热分解法
活泼金属的还原方法
由于K、Ca、Na、Mg等金属很活泼,对应的化合物很稳定,采用一般的方法和还原剂很难将其从化合物中还原出来,只能靠电才能将它们还原出来称为电解法。例如:
资料卡
2NaCl(熔融) == 2Na + Cl2↑
电解
化合态的镁如何转变成镁单质
海水中含有80多种元素,大部分以盐的形式存在。如果把这些盐类物质全部提取出来,均匀地铺在陆地表面,会形成150米厚的盐层。(其中NaCl占80%以上)
海水—— 化学资源的宝库
全世界每年都要从海洋中提取大量的食盐、镁、溴、碘等有用物质,海水享有“液体化工原料”之美誉。
Cl-
Cl-
SO42-
Ca2+
Na+
I-
Mg2+
K+
Na+
Br-
9月27日17时25分,山东青岛119消防指挥中心接到报警:金谷镁业股份有限公司院内突发大火,燃烧物为金属镁。根据报警人提供的信息,接警值班人员敏锐地觉察到了事态的严重性,立即调集了消防十中队的3辆水罐消防车、1辆泡沫消防车和王哥庄中队1辆水罐消防车共40名官兵赶赴现场。当十中队消防车辆行至珠州路中段时,官兵们便看到500米开外的金谷镁业股份有限公司方位火光冲起足有5米多高,浓烟滚滚。询问知情人得知,金谷镁业股份有限公司工作人员将生产车间内高温溶化的液态镁放置于院内,在下雨时没有及时对其做防雨、防水处理,约有5吨重的镁在高温遇水后发生了剧烈的化学反应,导致火灾发生。雨越下越大,院内的剧烈燃烧镁发出耀眼的白光,并伴随着“噼噼啪啪”的响声,现场气氛相当紧张。
金属镁属活泼金属,遇湿易燃,具刺激性,燃烧时产生强烈的白光并放出高热。遇水或潮气猛烈反应放出氢气,大量放热,引起燃烧或爆炸。起火时严禁用水、泡沫、二氧化碳扑救。最好的灭火方法是用干燥石墨粉和干砂闷熄火苗,隔绝空气。
消防官兵立即展开战斗:一是立即对公司内员工进行疏散,保证员工生命安全;二是对燃烧的镁进行分区隔离,防止燃烧的态势进一步扩大;三是迅速抢救未被引燃的镁等物资,尽量减少财产损失;四是请求特勤中队和九中队的力量增援。官兵正在分头展开灭火救援行动的时候,无意中看到在于金谷镁业股份有限公司相邻的建筑工地上不断地有满载沙土的大卡车进进出出,便立即上前同建筑工地负责人进行沟通,经协调后,用大卡车将15吨沙土运入了火灾现场,借调了建筑工地的一辆铲车,将沙土一层层的推移至燃烧镁之上,10分钟后,大约有50见方的燃烧镁被全部覆盖,火光已经熄灭,烟雾逐渐消散,灭火战斗胜利结束。
青岛消防官兵成功扑救一起金属镁火灾
镁的提取及应用
专题2 从海水中获得的化学物质
导弹
镁的广泛应用
镁在自然界中存在形式
菱镁矿(主要含MgCO3)
白云石
(主要含CaCO3·MgCO3)
镁橄榄石
(主要含Mg2SiO4)
——化合态
海水中镁的存在形式
NaCl
MgCl2
MgSO4
CaSO4
K2SO4
水96.5%
其他3.5%
海水的组成
MgCl2 、 MgSO4
海水Mg2+含量 1.28克/L
海水Mg2+总储量 1.8×1015t
想一想:要使海水中的镁转化为金属镁,镁元素的化合价如何变化,发生什么反应
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
热分解法
热还原法
电解法
还原金属的常用方法
(1)热分解法:适用于还原金属活动性较差的金属,如Hg与Ag.这些金属的化合物不稳定,加热即分解成金属单质。如:2HgO==2Hg + O2↑
(2)热还原法:用于金属活动性介于Zn~Cu之间的多数金属.是用还原剂(如C、CO、H2等)还原金属氧化物.如: Fe2O3+3CO === 2Fe+3CO2
(3)电解法:适用于金属活动性顺序中排在Al前的金属,由于这些金属很活泼,对应的化合物很稳定,只能靠电分解其熔融态的化合物来还原。如:2NaCl(熔融) === 2Na + Cl2↑
资料卡
高温
电解
资料: 常见镁的化合物的熔点
熔点
(℃)
1124
714
2800
加热到350℃
失去水生成MgO
Mg(OH)2
MgO
MgCl2
MgSO4
化合物
MgCl2(熔融)=== Mg + Cl2↑
电解
电解原料
你会选择将哪种镁的化合物熔融作为电解反应的原料?
Mg+Cl2= MgCl2
点 燃
2Mg+CO2=2MgO+C
点燃
2Mg+O2=2MgO
点燃
3Mg+N2= Mg3N2
点燃
电解制镁要在隔绝空气
的环境中
两极产物应设法隔离
Cl2有毒应设置专用管道
收集
电解装置
电池
电极
熔融态MgCl2
(提示:生成的镁浮在熔融盐上 )
某同学设计了电解法制镁的简易装置,你能根据
Mg及Cl2的性质指出该设计的不足之处及如何改进?
海水
碱
Mg(OH)2
HCl
MgCl2液
无水MgCl2
卤水
MgCl2+2NaOH = Mg(OH)2 + 2NaCl
Mg(OH)2+2HCl = MgCl2 + 2H2O
Mg2+ + 2OH- == Mg(OH)2
Mg(OH)2+ 2H+ == Mg2+ + 2H2O
从海水中提取MgCl2
海水
无水MgCl2
海水中Mg2+浓度小而且混杂大量的Na+、Cl-等离子,
根据这一特点,请设计以海水为原料提取MgCl2的方案。
(已知: Mg(OH)2难溶于水)
试剂 氢氧化钾 氢氧化钠 氢氧化钙 氢氧化钡
价格(元/吨) 7160 2700 850 4700
资料: 常见强碱的最新市价
CaCO3
CaO
Ca(OH)2
碱的选择
CaCO3 === CaO + CO2
锻烧
CaO+H2O == Ca(OH)2
原子经济性 反应
安全的生产工艺
提高能源的利用率
无毒无害原料 可再生资源
对环境友好产品
反应物
反应过程
反应产物
绿色化学
Mg(OH)2+2HCl = MgCl2 + 2H2O
MgCl2(熔融)=== Mg + Cl2↑
电解
MgCl2+Ca(OH)2 = Mg(OH)2 + CaCl2
石灰乳
请指出生产流程的哪些方面没有体现绿色化学的观点?
卤水
从海水中提取镁的流程
Cl2
Cl2
Cl2
HCl
专题回顾
NaCl
苦卤(含Mg2+、Br-等)
海水
电解熔融盐
Na
Cl2
H2
NaOH
HCl
Mg
Cl2
Mg(OH)2
MgCl2
电解
Br- 等
Br2
电解水溶液
让我们一起努力学习知识
利用好我们的资源
建设好我们的家园
教师寄语:
你能从“绿色化学”的概念出发为海峡西岸经济区的建设设计一座多功能的海水提炼厂吗?请用箭头、方框画出简易流程图。
你的收获
表:卤水中主要离子浓度
验证Mg2+的分离
桌面上的NaCl、MgCl2、KCl、CaCl2溶液分别模
拟卤水中的四种主要成分,请你设计实验方案验证
Mg2+的分离,并完成设计的验证实验。
Mg2+的分离:
加入碱后只有Mg2+沉淀,而其它阳离子不沉淀
卤水中
主要的四种成分 NaCl
溶液 MgCl2
溶液 KCl
溶液 CaCl2
溶液
滴加NaOH溶液
白色沉淀
无现象
无现象
无明显
现象
Mg2+ + 2OH- == Mg(OH)2
海水
镁在海水中含量很高,仅次于氯和钠,居第3位。
溴的浓度较高,平均为67×10-3 mL/L,地球上99%以上的溴都储存在海水里,故溴有“海洋元素”之称。
碘在海水中的浓度只有0.06× 10-6,属于微量元素。
钾在海水中的总量为500 ×1012 t以上。海水中所含钾的储量远远超过钾盐矿物储量。
铀海水中的总量非常可观,达45×108 t,相当于陆地储量的4500倍。
一吨海水中所含重水的核聚变反应,可释放出相当于256t石油燃烧所产生的能量。
重水核聚变反应可释放出相当能量,海水中约有200×108 t重水。
提取
海水提取镁的工艺流程图
卤水
你能从“绿色化学”的概念出发为海峡西岸经济区的建设设计一座海水炼镁厂吗?请用箭头、方框画出简易流程图。
原子经济性 反应
安全的生产工艺
提高能源的利用率
无毒无害原料 可再生资源
对环境友好产品
反应物
反应过程
反应产物
“绿色化学”的概念
绿色化学
你能指出在海水提取镁的生产过程中的优点吗?它体现了怎样的化学观点?
2. 绿色化学
绿色化学是一种以保护环境为目标来设计、生产化学产品的一门新兴学科,是一门从源头阻止污染的化学。
原料的绿色化
☆无毒、无害原料
☆可再生资源为原料
化学反应的绿色化
☆“原子经济性”反应
☆提高反应的选择性
产品的绿色化
催化剂的绿色化
☆无毒、无害催化剂
溶剂的绿色化
☆无毒、无害溶剂
绿色化学示意图
化学核心知识
(8)绿色化学
采用无毒无害的原料;
在无毒的反应条件下进行;
产品对环境友好;
具有“原子经济性” ;
满足“价廉物美”的传统原则。
含有的
主要离子 g/L
海水
Cl- 19.354
Na+ 10.773
Mg2+ 1.292
SO42- 2.712
Ca2+ 0.412
K+ 0.399
绿色化学
传统的化学工业给环境带来的污染已十分严重,目前世界每年产生的有害废物达3亿吨~4亿吨,给环境造成危害,并威胁着人类的生存。有识之士提出了绿色化学的号召,并立即得到了全世界的积极响应。
绿色化学的核心就是要利用化学原理从源头减少和消除工业生产对环境的污染。
绿色化学提倡原子经济性,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,原子利用率为100%
绿色化学又称环境友好化学,清洁化学环境无害化学,它的主要特点是:
1.充分利用资源和能源,采用无毒、无害的原料;
2.在无毒、无害的条件下进行反应,以减少废物向环境排放;
3.提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”;
4.生产出有利于环境保护、社区安全和人体健康的环境友好的产品。
绿色化学给化学家提出了一项新的挑战,国际上对此很重视。1996年,美国设立了“绿色化学挑战奖”,以表彰那些在绿色化学领域中做出杰出成就的企业和科学家。绿色化学将使化学工业改变面貌,为子孙后代造福。
(二)、海水中提取镁
如何从海水晒盐的“苦卤”中提取纯净的MgCl2并制取Mg单质
CaCO3 === CaO + CO2
Mg(OH)2+2HCl=MgCl2+2H2O
Mg2++CaO+H2O=Mg(OH)2 +Ca2+
MgCl2+6H2O=MgCl2 6H2O
MgCl2 6H2O=MgCl2+6H2O(一定条件)
MgCl2(熔融) === Mg + Cl2
电解
高温
每升海水中Mg2+仅1.29克
但总储量高达1.8×1015 t
NaCl 77.75%
MgCl2 10.88%
MgSO4 4.74%
CaSO4 3.60%
K2SO4 2.46%
含有的
主要离子 g/L
海水
Cl- 19.354
Na+ 10.773
Mg2+ 1.292
SO42- 2.712
Ca2+ 0.412
K+ 0.399
每升海水中Mg2+仅1.29克
但总储量高达1.8×1015t
高中化学应当学习的基础核心知识—支撑化学学科体系与发展的知识
物质由元素组成,元素周期表揭示了元素之间存在内在联系。周期表是对化学研究基本成果最简洁的记录,为我们提供极为丰富的化学信息。
物质由原子、分子等微粒构成的。微粒不仅是抽象的模型,还是实实在在的客体。
物质结构具有复杂性与隐蔽性,结构有层次性,层次间存在关联性。
物质性质、变化的多样性;化学反应是化学研究的中心问题,化学反应类型多样、反应及机理十分复杂,对反应条件十分敏感,反应伴随能量与混乱度的变化。实现化学反应的关键是使用催化剂提高反应速率。
实现绿色化学--采用无毒无害的原料、在无毒的反应条件下进行、产品对环境友好、具有“原子经济性”、满足“价廉物美”的传统原则。
化工生产要考虑以下几个方面:
化学反应原理
原料成本
经济效益
对环境的影响
……
提示:
镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如下:(1)为了使MgCl2转化为Mg(OH)2,试剂①可选用______ _,要使MgCl2完全转化为沉淀,加入试剂①的量应__________,验证MgCl2已完全转化为Mg(OH)2的方法是__________; (2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_________________;
(3)试剂②可以选用____________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式:__________________________________。
Mg(OH)2
溶 液
MgCl2
溶 液
无 水
MgCl2
Mg
海水:
主要含
NaCl和MgCl2等
试剂①
试剂②
电解
熔融
绿色化学
原子经济性 反应
安全的生产工艺
提高能源的利用率
无毒无害原料 可再生资源
对环境友好产品
反应物
反应过程
反应产物
绿色化学概念
1、在2支小试管里分别加入2mLNaCl溶液MgCl2溶液,分别滴加
卤水中
主要的四种成分 NaCl
溶液 MgCl2
溶液 KCl
溶液 CaCl2
溶液
滴加NaOH溶液
含有的
主要离子 g/L
海水
Cl- 19.354
Na+ 10.773
Mg2+ 1.292
SO42- 2.712
Ca2+ 0.412
K+ 0.399
每升海水中Mg2+仅1.29克
但总储量高达1.8×1015 t
每升海水中Mg2+仅1.29克
但总储量高达1.8×1015 t
向模拟卤水中的四种成分分别滴加NaOH溶液
科学探究
从卤水中分离出Mg2+
在四支试管中分别加入适量氯化钠、氯化镁、氯化钙和氯化钾溶液,分别滴加氢氧化钠溶液。
NaCl溶液
MgCl2溶液
CaCl2溶液
KCl溶液
含有离子 g/L
海水
Cl- 19.35
Na+ 10.77
Mg2+ 1.29
SO42- 2.712
Ca2+ 0.412
K+ 0.399
5、绿色化学理念(预防优于治理)
核心:利用化学原理从源头上减少和消除工业生产对环境造成的污染。又称为“环境无害化学”、“环境友好化学”、“清洁化学”。
从学科观点看:是化学基础内容的更新。(改变反应历程)
从环境观点看:强调从源头上消除污染。(从一开始就避免污染物的产生)
从经济观点看:它提倡合理利用资源和能源,降低生产成本。(尽可能提高原子利用率)
热点:原子经济性——反应物原子全部转化为最终的期望产物,原子利用率为100%
元素 离子
形态 g/L
海水
氯 Cl- 19.354
钠 Na+ 10.77
镁 Mg2+ 1.29
硫 SO42- 2.712
钙 Ca2+ 0.412
钾 K+ 0.399
想一想:如何从海水中获得MgCl2
对金属而言:
越活泼的金属,越容易与其他物质形成化合物,也就越难从化合物中还原出金属单质.
越不活泼的金属, 越不容易与其他物质形成化合物,也就越容易从化合物中还原出金属单质.
石灰乳
HCl
电解
MgCl2
海水
Mg(OH)2
Mg
请根据你所了解的金属的制备方法,设
计一套以海水为原料制备金属镁的方案,并
请你用箭头、方框画出简易的流程图。
月球探测器
引海水渠道的闸门
海面
堤坝
贮水池
蒸发池
结晶池
盐田示意图
1、如何从海水中得到NaCl呢?
海水
盐田
粗盐
引入
风吹日晒
一、海水中盐的开发和利用
过滤,加盐酸 加热 电解
海水 母液 b c
煅烧 a 浓缩
贝壳 石灰乳
a ;
b ;
c 。
MgCl2溶液
[练习]根据讨论,在下列方框中填入合适的物质的化学式完成工业上用海水提镁的工艺流程,
并写出a、b、c三个步骤的化学方程式:
CaO
Mg(OH)2
MgCl2 6H2O
MgCl2
Mg
MgCl2+Ca(OH)2=Mg(OH)2 +CaCl2
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2(熔融) = Mg+Cl2
通电
3、从海水中提取金属镁的生产步骤有:①浓缩结晶,②加熟石灰,③加盐酸,④过滤,⑤熔融电解,正确的生产步骤是__________。
0
5
10
15
20
25
30
KCl
CaCl2
MgCl2
NaCl
0.721
1.11
5.11
27.2
含量/g
每千克海水中几种氯化物的含量
海水中镁的总储量约为1.8×1015 t
0
5
10
15
20
25
30
KCl
CaCl2
MgCl2
NaCl
0.721
1.11
5.11
27.2
含量/g
每千克海水中几种氯化物的含量
怎样把Mg2+从海水中分离出来?
在众多的自然资源中,海水是十分重要的资源之一。利用海水中富含的化学物质,如:NaCl、MgCl2、NaBr、NaI等,能获得获得的非金属单质Cl2、Br2、I2,如何从海水中获得这些物质呢
想一想:要使海水中的镁转化为金属Mg,镁元素的化合价如何变化,发生什么反应
一、海水的综合利用
(一)、氯化钠的提取与利用
1、如何从海水中提取粗盐?
粗盐的成分主要有哪些?
NaCl (泥沙、Ca2+ 、Mg2+ 、Fe3+、SO42-等)
海水晒盐
粗盐水
含少量Ca2+.Mg2+
精制盐水
2、粗盐的提纯与精制
请你设计实验分析如何从粗盐中提取精盐?
Ca2+ Mg2+ Na+ Cl-SO42-
过量Ba(OH)2
Mg(OH)2 BaSO4
Ca2+ Ba2+ Na+ Cl-OH-
过量Na2CO3
CaCO3 BaCO3
Na+ Cl-OH-CO32-
过量HCl
CO2
Na+ Cl-H+
方法一:加热
方法二:加NaOH,调节PH=7
精盐(NaCl)
从根本上解决环境和生态问题,还要依靠绿色化学的发展。绿色化学使人们可以期望未来的化工企业将是零排放的,所有物质原料、中间产物都在内部循环、利用,尽量不使用有毒、有强腐蚀性的原料。
6、阅读教材96页问题解决。比较两种途径,你认为哪种路线符合绿色化学的要求?这种方法的优点是什么?
后者,没有用氢氰酸极毒物,反应只要一步反应,转化率高,没有其他生成物。
绿色化学是设计没有或只有尽可能小的对环境产生负面影响的,并在技术、经济上可行的化学品和化学过程的科学。绿色化学的目的是用化学方法在化学过程中预防污染。绿色化学要求开发新的原子经济反应。原子经济性即在化学反应过程中有多少原料的原子进入到所需的产品中。理想的原子经济反应要求原料分子百分之百在转变成产物,不产生副产物或废物,实现废物的“零排放”。
离子交换膜电解槽的组成
将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)通过,而阻止阴离子(Cl-、OH-)和气体通过。可防止H2、Cl2混合爆炸,也可防止Cl2与NaOH反应。
阳离子交换膜的作用
(2)、制备钠
你能根据电解食盐水溶液的装置来设计工业制备钠的简易装置吗?
原理:2NaCl(熔融) === 2Na + Cl2↑
电解
(3)、侯氏制碱
侯氏制碱法的主要原理:在氨饱和的NaCl 溶液中通入二氧化碳气体,生成小苏打沉淀和氯化铵溶液
讨论、研究
通入氨气与二氧化碳的顺序能对调吗 为什么?
NaCl + NH3 + CO2 + H2O == NaHCO3 + NH4Cl
2NaHCO3 ===== Na2CO3+CO2 +H2O
加热
绿色化学
原子经济 性反应高 选择性
安全的生产工艺
提高能源的利用率
无毒无害原料 可再生资源
对环境友好产品
应用无毒无害的 催化剂
应用无毒无害的溶剂
反应物
反应过程
反应产物
绿色化学示意图
电解法
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
热还原法
热分解法
活泼金属的还原方法
由于K、Ca、Na、Mg等金属很活泼,对应的化合物很稳定,采用一般的方法和还原剂很难将其从化合物中还原出来,只能靠电才能将它们还原出来称为电解法。例如:
资料卡
2NaCl(熔融) == 2Na + Cl2↑
电解
化合态的镁如何转变成镁单质
海水中含有80多种元素,大部分以盐的形式存在。如果把这些盐类物质全部提取出来,均匀地铺在陆地表面,会形成150米厚的盐层。(其中NaCl占80%以上)
海水—— 化学资源的宝库
全世界每年都要从海洋中提取大量的食盐、镁、溴、碘等有用物质,海水享有“液体化工原料”之美誉。
Cl-
Cl-
SO42-
Ca2+
Na+
I-
Mg2+
K+
Na+
Br-
9月27日17时25分,山东青岛119消防指挥中心接到报警:金谷镁业股份有限公司院内突发大火,燃烧物为金属镁。根据报警人提供的信息,接警值班人员敏锐地觉察到了事态的严重性,立即调集了消防十中队的3辆水罐消防车、1辆泡沫消防车和王哥庄中队1辆水罐消防车共40名官兵赶赴现场。当十中队消防车辆行至珠州路中段时,官兵们便看到500米开外的金谷镁业股份有限公司方位火光冲起足有5米多高,浓烟滚滚。询问知情人得知,金谷镁业股份有限公司工作人员将生产车间内高温溶化的液态镁放置于院内,在下雨时没有及时对其做防雨、防水处理,约有5吨重的镁在高温遇水后发生了剧烈的化学反应,导致火灾发生。雨越下越大,院内的剧烈燃烧镁发出耀眼的白光,并伴随着“噼噼啪啪”的响声,现场气氛相当紧张。
金属镁属活泼金属,遇湿易燃,具刺激性,燃烧时产生强烈的白光并放出高热。遇水或潮气猛烈反应放出氢气,大量放热,引起燃烧或爆炸。起火时严禁用水、泡沫、二氧化碳扑救。最好的灭火方法是用干燥石墨粉和干砂闷熄火苗,隔绝空气。
消防官兵立即展开战斗:一是立即对公司内员工进行疏散,保证员工生命安全;二是对燃烧的镁进行分区隔离,防止燃烧的态势进一步扩大;三是迅速抢救未被引燃的镁等物资,尽量减少财产损失;四是请求特勤中队和九中队的力量增援。官兵正在分头展开灭火救援行动的时候,无意中看到在于金谷镁业股份有限公司相邻的建筑工地上不断地有满载沙土的大卡车进进出出,便立即上前同建筑工地负责人进行沟通,经协调后,用大卡车将15吨沙土运入了火灾现场,借调了建筑工地的一辆铲车,将沙土一层层的推移至燃烧镁之上,10分钟后,大约有50见方的燃烧镁被全部覆盖,火光已经熄灭,烟雾逐渐消散,灭火战斗胜利结束。
青岛消防官兵成功扑救一起金属镁火灾
