《铝的氢氧化物 》教学课件
图片预览





文档简介
(共24张PPT)
第三专题从矿物到基础材料
铝的氢氧化物
1.使学生了解两性氢氧化物的概念;
2.使学生了解氢氧化铝在生产、生活中的重要应用;
3.从“明矾净水”,了解化学科学与生产、生活的密切关系;
4.通过学习培养学生严谨、求实的科学思维品质。
教学目标
重点:氢氧化铝的化学性质
难点:氢氧化铝的两性
教学重点、难点
温馨提示:请服斯达舒
胃泛酸, 痛死了!!!
[商品名称]斯达舒
[成份]本品每粒含氢氧化铝
140毫克,维生素U50毫克,
颠茄提取物10毫克,辅料:
淀粉 。
[药理作用]本品中氢氧化铝
为抗酸药,能中和胃酸并保护溃疡面;维生素U能促进肉芽发育和黏膜再生;颠茄流浸膏可抑制腺体分泌,解除平滑痉挛引起的疼痛。
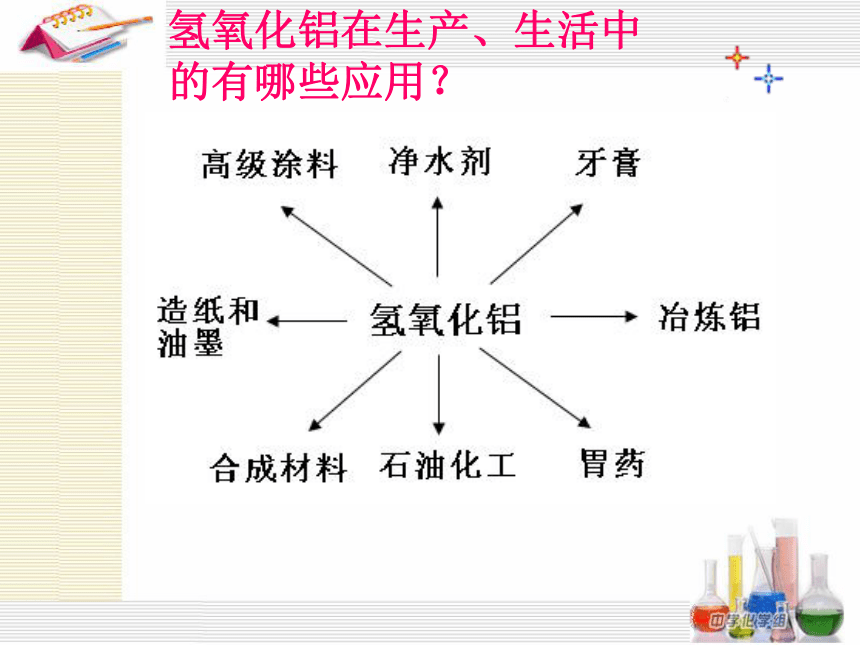
氢氧化铝在生产、生活中的有哪些应用?
【活动与探究】
如何在实验室里制备氢氧化
铝呢?请提出可行的方法。
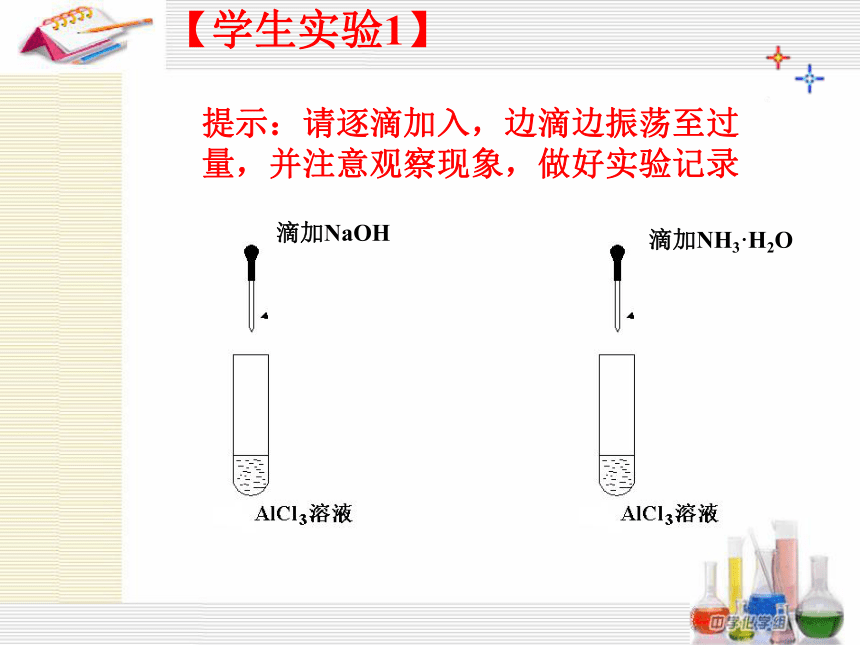
滴加NaOH
滴加NH3·H2O
提示:请逐滴加入,边滴边振荡至过 量,并注意观察现象,做好实验记录
【学生实验1】
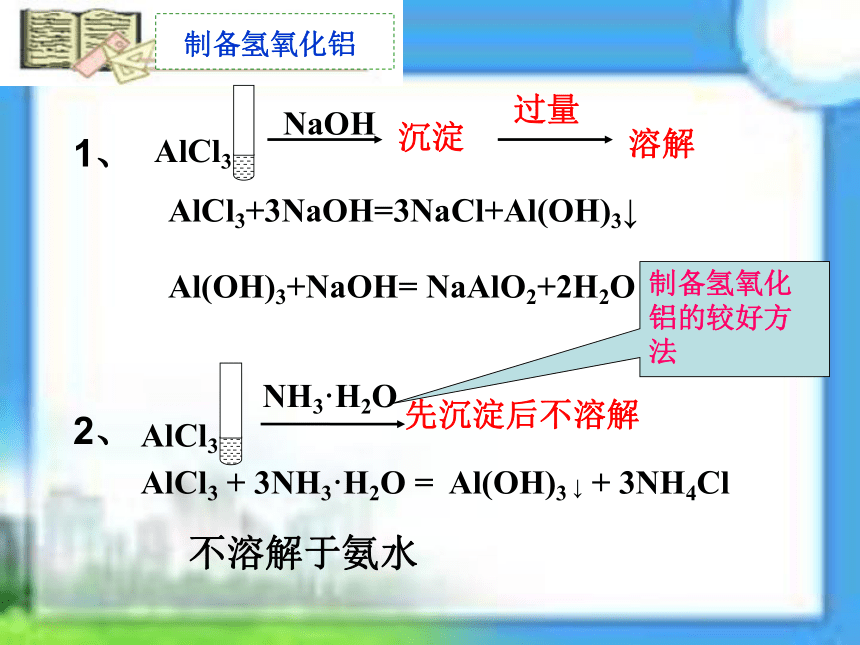
制备氢氧化铝
沉淀
AlCl3+3NaOH=3NaCl+Al(OH)3↓
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
1、
NaOH
AlCl3
2、
AlCl3
NH3·H2O
Al(OH)3+NaOH= NaAlO2+2H2O
先沉淀后不溶解
不溶解于氨水
过量
溶解
制备氢氧化铝的较好方法
溶解
溶解
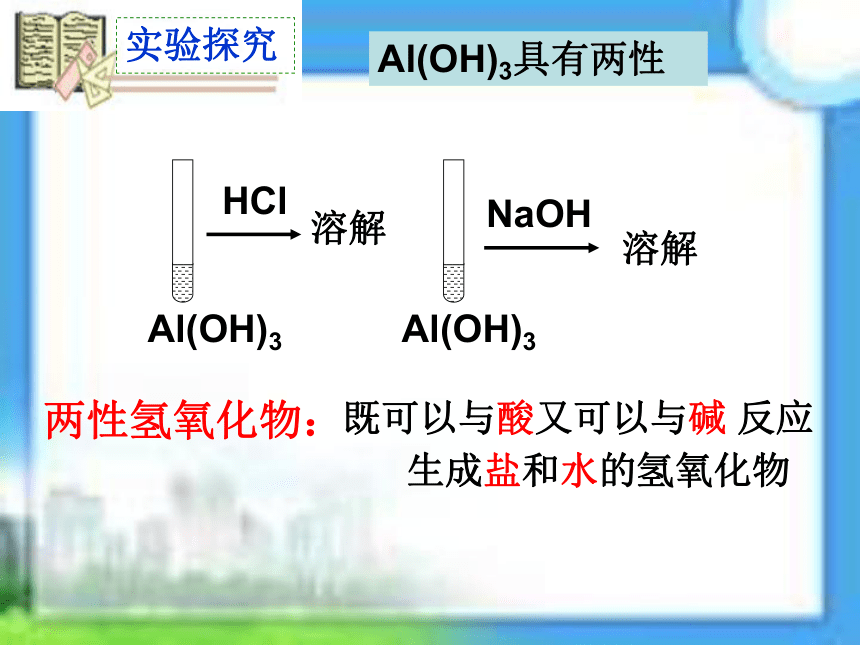
实验探究
Al(OH)3
HCl
NaOH
Al(OH)3
Al(OH)3具有两性
既可以与酸又可以与碱 反应
生成盐和水的氢氧化物
两性氢氧化物:
Al(OH)3
为什么氢氧化铝具有两性呢?
AlO2+H++H2O
Al3++3OH-
酸式电离
碱式电离
【活动与探究】
用偏铝酸钠溶液与稀盐酸反应能否制得氢氧化铝
【学生实验2】
提示:请逐滴加入,边滴边振荡至过量,并注意观察现象,做好实验记录
反思延伸
Al(OH)3 + 3HCl= AlCl3 + 3H2O
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
盐酸
NaAlO2
3、
4、
NaAlO2
CO2
沉淀
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
沉淀
过量
溶解
制备氢氧化铝
制备氢氧化铝的较好方法
HCl
NaOH或
NH3·H2O
NaOH
HCl或
CO2+H2O
Al(OH)3
AlCl3
NaAlO2
小结
氢氧化铝两性:与强酸又与强碱反应都生成盐和水
氢氧化铝的制备:铝盐与弱碱和偏铝酸盐与弱酸
下雨了水浑怎么办?
你知道明矾是怎样净水的吗?
猜猜看
洪灾过后,医务人员通常会向灾民发放一些药品,一种是用来消毒,一种是用来净水。你觉得这两种药品分别是什么?
KAl(SO4)2·12H2O
KAl(SO4)2 =K++Al3++2SO42-
明矾
无色晶体,易溶于水
Al3++3H2O
Al(OH)3 (胶体) +3H+
=
氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的。
温馨提醒
生活中铝盐除了用于净化水,还用于制作油条和粉条等各类食品中,若长期食用,会对人体健康造成危害(可能导致脑损伤,造成严重的记忆力丧失)。目前用于饮用水净化的含铝净水剂正逐步被含铁净水剂所取代。
【问题解决】
如何检验KAl(SO4)2溶液
中是否含有Al3+
通过这节课的学习,你学
到了哪些知识和方法?有哪
些体验和感受?
课堂小结
习题
1、下列实验中,先产生白色沉淀后沉淀又溶解的是( )
A.NaAlO2溶液中滴加HCl至过量 B. AlCl3溶液中滴加NaOH溶液至过量 C. NaOH溶液中滴加AlCl3溶液至过量 D.HCl 溶液中滴加NaAlO2至过量
2、以氧化铝为原料制取氢氧化铝方法有哪些?你认为最好的方法是什么?
3、铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝及其化合物在下列场合的使用须加以控制的是( )
①制铝锭 ②制易拉罐 ③制电线、电缆 ④制包糖果用的铝箔 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制胃药 ⑨制防锈油漆
A、 ① ② ④ ⑤ ⑥ ⑦ ⑧ B、 ② ⑤ ⑥ ⑦ ⑧
C、 ② ④ ⑤ ⑥ ⑦ ⑧ D、 ③ ④ ⑤ ⑥ ⑦ ⑧
提高环保意识
优化环境质量
废液请倒入废液缸
仪器洗净放回原位
温馨提示:
清洗仪器、整理台面
第三专题从矿物到基础材料
铝的氢氧化物
1.使学生了解两性氢氧化物的概念;
2.使学生了解氢氧化铝在生产、生活中的重要应用;
3.从“明矾净水”,了解化学科学与生产、生活的密切关系;
4.通过学习培养学生严谨、求实的科学思维品质。
教学目标
重点:氢氧化铝的化学性质
难点:氢氧化铝的两性
教学重点、难点
温馨提示:请服斯达舒
胃泛酸, 痛死了!!!
[商品名称]斯达舒
[成份]本品每粒含氢氧化铝
140毫克,维生素U50毫克,
颠茄提取物10毫克,辅料:
淀粉 。
[药理作用]本品中氢氧化铝
为抗酸药,能中和胃酸并保护溃疡面;维生素U能促进肉芽发育和黏膜再生;颠茄流浸膏可抑制腺体分泌,解除平滑痉挛引起的疼痛。
氢氧化铝在生产、生活中的有哪些应用?
【活动与探究】
如何在实验室里制备氢氧化
铝呢?请提出可行的方法。
滴加NaOH
滴加NH3·H2O
提示:请逐滴加入,边滴边振荡至过 量,并注意观察现象,做好实验记录
【学生实验1】
制备氢氧化铝
沉淀
AlCl3+3NaOH=3NaCl+Al(OH)3↓
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
1、
NaOH
AlCl3
2、
AlCl3
NH3·H2O
Al(OH)3+NaOH= NaAlO2+2H2O
先沉淀后不溶解
不溶解于氨水
过量
溶解
制备氢氧化铝的较好方法
溶解
溶解
实验探究
Al(OH)3
HCl
NaOH
Al(OH)3
Al(OH)3具有两性
既可以与酸又可以与碱 反应
生成盐和水的氢氧化物
两性氢氧化物:
Al(OH)3
为什么氢氧化铝具有两性呢?
AlO2+H++H2O
Al3++3OH-
酸式电离
碱式电离
【活动与探究】
用偏铝酸钠溶液与稀盐酸反应能否制得氢氧化铝
【学生实验2】
提示:请逐滴加入,边滴边振荡至过量,并注意观察现象,做好实验记录
反思延伸
Al(OH)3 + 3HCl= AlCl3 + 3H2O
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
盐酸
NaAlO2
3、
4、
NaAlO2
CO2
沉淀
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
沉淀
过量
溶解
制备氢氧化铝
制备氢氧化铝的较好方法
HCl
NaOH或
NH3·H2O
NaOH
HCl或
CO2+H2O
Al(OH)3
AlCl3
NaAlO2
小结
氢氧化铝两性:与强酸又与强碱反应都生成盐和水
氢氧化铝的制备:铝盐与弱碱和偏铝酸盐与弱酸
下雨了水浑怎么办?
你知道明矾是怎样净水的吗?
猜猜看
洪灾过后,医务人员通常会向灾民发放一些药品,一种是用来消毒,一种是用来净水。你觉得这两种药品分别是什么?
KAl(SO4)2·12H2O
KAl(SO4)2 =K++Al3++2SO42-
明矾
无色晶体,易溶于水
Al3++3H2O
Al(OH)3 (胶体) +3H+
=
氢氧化铝胶体具有很强的吸附能力,它能凝聚水中的悬浮物并使之沉降,从而达到净水的目的。
温馨提醒
生活中铝盐除了用于净化水,还用于制作油条和粉条等各类食品中,若长期食用,会对人体健康造成危害(可能导致脑损伤,造成严重的记忆力丧失)。目前用于饮用水净化的含铝净水剂正逐步被含铁净水剂所取代。
【问题解决】
如何检验KAl(SO4)2溶液
中是否含有Al3+
通过这节课的学习,你学
到了哪些知识和方法?有哪
些体验和感受?
课堂小结
习题
1、下列实验中,先产生白色沉淀后沉淀又溶解的是( )
A.NaAlO2溶液中滴加HCl至过量 B. AlCl3溶液中滴加NaOH溶液至过量 C. NaOH溶液中滴加AlCl3溶液至过量 D.HCl 溶液中滴加NaAlO2至过量
2、以氧化铝为原料制取氢氧化铝方法有哪些?你认为最好的方法是什么?
3、铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一而加以控制。铝及其化合物在下列场合的使用须加以控制的是( )
①制铝锭 ②制易拉罐 ③制电线、电缆 ④制包糖果用的铝箔 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用氢氧化铝制胃药 ⑨制防锈油漆
A、 ① ② ④ ⑤ ⑥ ⑦ ⑧ B、 ② ⑤ ⑥ ⑦ ⑧
C、 ② ④ ⑤ ⑥ ⑦ ⑧ D、 ③ ④ ⑤ ⑥ ⑦ ⑧
提高环保意识
优化环境质量
废液请倒入废液缸
仪器洗净放回原位
温馨提示:
清洗仪器、整理台面
