电解池的工作原理及应用
图片预览





文档简介
课件19张PPT。电解池的工作
原理及应用电解熔融氯化钠(见课本P17原理图)通电前, Na+ Cl- 在做 __________运动。
通电后, Na+向__ 极(与电源____相连)移动,Cl-向___极(与电源____相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生_______反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______反应。
总反应为_______________________。 阴无规则自由负极阳正极电解池阴2NaCl 2Na +Cl2↑氧化还原电源正2Na++ 2e- == 2Na2Cl --2e-==Cl2↑
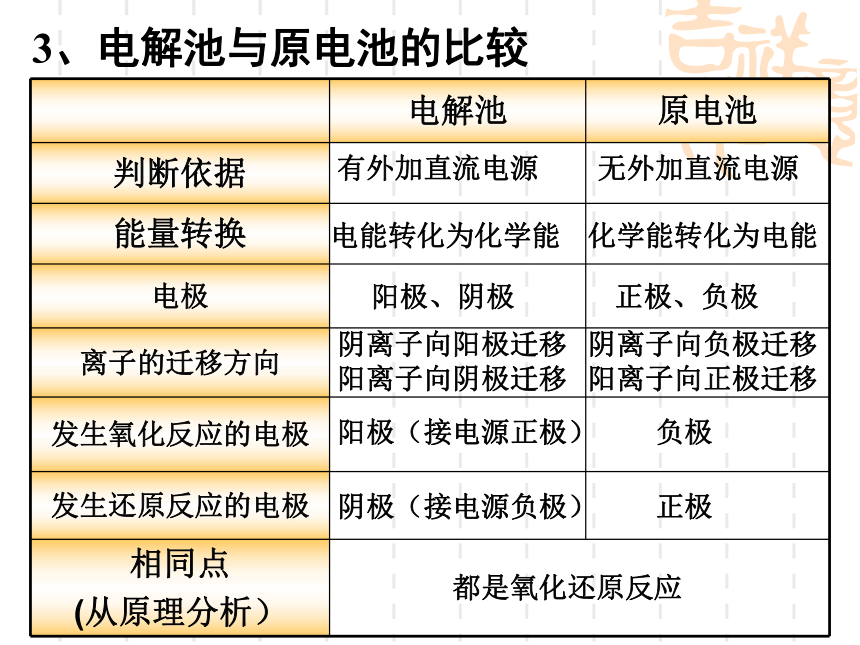
电解池(电解槽):把电能转化为化学能的装置。回顾:什么是电解池(电解槽)?回顾:什么是电解? 电解:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程。一、电解池1、定义:2、电解池的构成条件把电能转化为化学能的装置(1)外接直流电源(2)与电源相连的两个电极
电源正极——阳极,电源负极——阴极(3)电解质溶液或熔化的电解质 (4) 形成闭合回路回忆比较:电解池与原电池的区别3、电解池与原电池的比较电能转化为化学能化学能转化为电能阳极、阴极正极、负极阴离子向阳极迁移
阳离子向阴极迁移阴离子向负极迁移
阳离子向正极迁移阳极(接电源正极)负极阴极(接电源负极)正极有外加直流电源无外加直流电源都是氧化还原反应下面以石墨为电极电解氯化铜溶液为例来分析。刚才介绍的是电解熔融盐的情况。
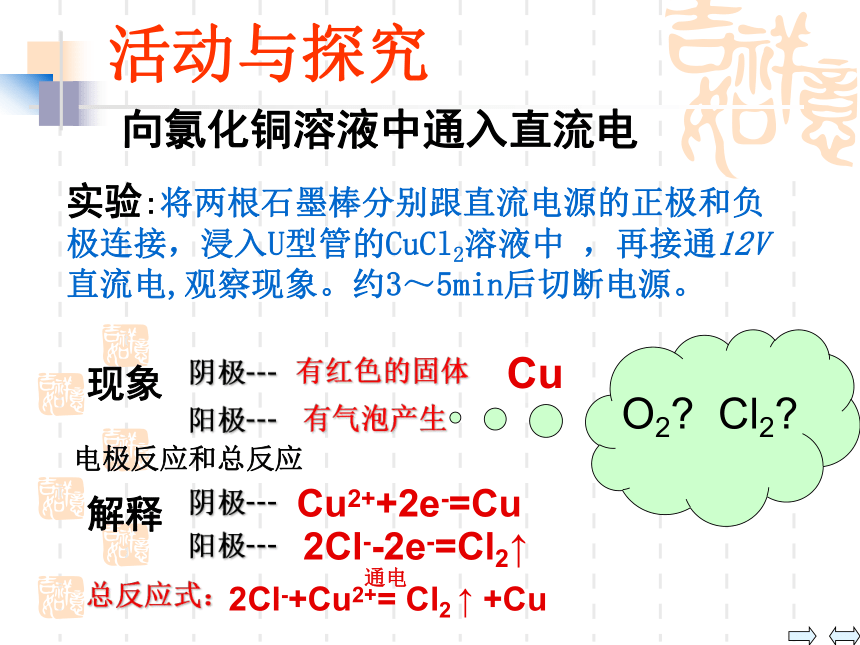
电解电解质溶液又会发生什么反应呢?活动与探究向氯化铜溶液中通入直流电实验:将两根石墨棒分别跟直流电源的正极和负极连接,浸入U型管的CuCl2溶液中 ,再接通12V直流电,观察现象。约3~5min后切断电源。O2? Cl2?阴极---Cu解释阳极---有气泡产生有红色的固体2Cl--2e-=Cl2↑Cu2++2e-=Cu2Cl-+Cu2+= Cl2 ↑ +Cu总反应式:通电电极反应和总反应 为何当一个电极存在多种可能的放电离子时,是大家共同放电,还是只有一种离子放电?放电能力与什么因素有关?思考:(离子在电解池的阴、阳两极发生反应的过程叫放电。)阴极: ___电子,发生____反应,离子
______越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+ 酸>Fe2+>Zn2+> H+ 水>Al3+>Mg2+>Na+
阳极:___电子,发生____反应,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
得还原氧化性失氧化还原性想一想: 若以铜为阳极,铁为阴极,电解 氯化铜溶液,情况又如何?分析电解反应的一般思路:明确溶液中存在哪些离子根据阳极氧化,阴极还原分析得出产物接通电源后阴阳两极附近有哪些离子明确阴、阳极及材料(阳极的材料)依据溶液阴阳离子的放电规律练习及作业: 完成下列溶液的电极反应(以石墨为电极电解)硫酸溶液:
盐酸:
NaOH溶液:
CuBr2溶液:
KCl溶液:
CuSO4溶液:
Na2SO4溶液:
阴极: 得电子,发生还原反应,离子氧化性越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+ 酸>Fe2+>Zn2+> H+ 水>Al3+>Mg2+>Na+
阳极:失电子,发生氧化反应,离子还原性越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br - > Cl- > OH- > 含氧酸根 > F-
②当阳极为金属电极(除铂、金)时,金属电极优先放电。
阳极:4OH- - 4e- = 2H2O + O2↑
阴极:4H+ + 4e- = 2H2↑
总反应:2H2O 2H2↑ + O2↑阳极:2Cl - - 2e- == Cl2↑阴极:2H+ + 2e- == H2 ↑阳极:Cu – 2e- = Cu 2+
阴极:Cu 2+ + 2e- = Cu阳极:4OH- - 4e- = 2H2O + O2↑
阴极:2Cu 2+ + 4e- = 2Cu
总反应:2CuSO4 + 2H2O2Cu + 2H2SO4 + O2↑再 见!
通电后, Na+向__ 极(与电源____相连)移动,Cl-向___极(与电源____相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生_______反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______反应。
总反应为_______________________。 阴无规则自由负极阳正极电解池阴2NaCl 2Na +Cl2↑氧化还原电源正2Na++ 2e- == 2Na2Cl --2e-==Cl2↑
电解池(电解槽):把电能转化为化学能的装置。回顾:什么是电解池(电解槽)?回顾:什么是电解? 电解:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程。一、电解池1、定义:2、电解池的构成条件把电能转化为化学能的装置(1)外接直流电源(2)与电源相连的两个电极
电源正极——阳极,电源负极——阴极(3)电解质溶液或熔化的电解质 (4) 形成闭合回路回忆比较:电解池与原电池的区别3、电解池与原电池的比较电能转化为化学能化学能转化为电能阳极、阴极正极、负极阴离子向阳极迁移
阳离子向阴极迁移阴离子向负极迁移
阳离子向正极迁移阳极(接电源正极)负极阴极(接电源负极)正极有外加直流电源无外加直流电源都是氧化还原反应下面以石墨为电极电解氯化铜溶液为例来分析。刚才介绍的是电解熔融盐的情况。
电解电解质溶液又会发生什么反应呢?活动与探究向氯化铜溶液中通入直流电实验:将两根石墨棒分别跟直流电源的正极和负极连接,浸入U型管的CuCl2溶液中 ,再接通12V直流电,观察现象。约3~5min后切断电源。O2? Cl2?阴极---Cu解释阳极---有气泡产生有红色的固体2Cl--2e-=Cl2↑Cu2++2e-=Cu2Cl-+Cu2+= Cl2 ↑ +Cu总反应式:通电电极反应和总反应 为何当一个电极存在多种可能的放电离子时,是大家共同放电,还是只有一种离子放电?放电能力与什么因素有关?思考:(离子在电解池的阴、阳两极发生反应的过程叫放电。)阴极: ___电子,发生____反应,离子
______越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+ 酸>Fe2+>Zn2+> H+ 水>Al3+>Mg2+>Na+
阳极:___电子,发生____反应,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
得还原氧化性失氧化还原性想一想: 若以铜为阳极,铁为阴极,电解 氯化铜溶液,情况又如何?分析电解反应的一般思路:明确溶液中存在哪些离子根据阳极氧化,阴极还原分析得出产物接通电源后阴阳两极附近有哪些离子明确阴、阳极及材料(阳极的材料)依据溶液阴阳离子的放电规律练习及作业: 完成下列溶液的电极反应(以石墨为电极电解)硫酸溶液:
盐酸:
NaOH溶液:
CuBr2溶液:
KCl溶液:
CuSO4溶液:
Na2SO4溶液:
阴极: 得电子,发生还原反应,离子氧化性越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+ 酸>Fe2+>Zn2+> H+ 水>Al3+>Mg2+>Na+
阳极:失电子,发生氧化反应,离子还原性越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br - > Cl- > OH- > 含氧酸根 > F-
②当阳极为金属电极(除铂、金)时,金属电极优先放电。
阳极:4OH- - 4e- = 2H2O + O2↑
阴极:4H+ + 4e- = 2H2↑
总反应:2H2O 2H2↑ + O2↑阳极:2Cl - - 2e- == Cl2↑阴极:2H+ + 2e- == H2 ↑阳极:Cu – 2e- = Cu 2+
阴极:Cu 2+ + 2e- = Cu阳极:4OH- - 4e- = 2H2O + O2↑
阴极:2Cu 2+ + 4e- = 2Cu
总反应:2CuSO4 + 2H2O2Cu + 2H2SO4 + O2↑再 见!
